新人教版九年级上册(2012年秋使用)第五单元 化学方程式 课题1 质量守恒定律
文档属性
| 名称 | 新人教版九年级上册(2012年秋使用)第五单元 化学方程式 课题1 质量守恒定律 |  | |
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-10-10 20:11:26 | ||
图片预览






文档简介
(共27张PPT)
1.知识与技能
认识质量守恒定律,了解常见化学反应中反应物与生成物的质量关系。从微观角度认识,在一切化学反应中,反应前后原子的种类和原子的数目没有增减。
2.过程与方法
通过具体的探究活动,了解质量守恒定律的内容,并从微观角度解释化学反应的实质。
3.情感态度与价值观
通过对质量守恒定律的探究,体会成功的乐趣,培养同学们团结协作的团队精神。
(P92-95)
请阅读教材P92-95,完成相应实验并思考如下问题:
★参加 的各物质的质量总和 反应后生成的各物质的质量总和,这个规律叫质量守恒定律。
★从原子、分子观点来看,化学反应的过程,就是参加反应的各物质的 重新组合而生成新的 的过程。在一切化学反应中,反应前后原子的 没有改变,原子的 没有增减,原子的
也没有变化。所以,化学反应前后各物质的 必然相等。
1774年,拉瓦锡用精确的定量实验研究了氧化汞的分解和合成反应中各物质的质量之间的变化关系。他将45.0份质量的氧化汞加热分解,恰好得到了41.5份质量的汞和3.5份质量的氧气。
(P92-95)
1、拉瓦锡的实验发现
1789年,拉瓦锡出版了他的名著《化学概论》。在《化学概论》里,拉瓦锡批判了燃素学说,他自己的燃烧理论,归纳成这样四点:
1、燃烧时放出光和热;
2、物质只在氧气中燃烧;
3、氧气在燃烧时被消耗;燃烧物在燃烧后所增加的重量,等于所消耗的氧气的重量;
4、燃烧后,燃烧物往往变成酸性氧化物,而金属则变为残渣。
(P92-95)
2、活动探究
(1)、方案一:
(2)、方案二:
实验现象:点燃白磷,观察到剧烈燃烧,放热,产生大量白烟(气球先膨胀后缩小) 天平平衡、质量相等
实验现象:铁钉表面产生红色物质,溶液颜色 逐渐变浅(由蓝色变为浅绿色)
天平平衡、质量相等
(3)、探究结论:
参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。(质量守恒定律)
(P92-95)
3、实验5-1、实验5-2
(1)实验5-1 盐酸与碳酸钠粉末反应前后质量的测定
A、将盛有盐酸的小试管放入装有碳酸钠粉末的烧杯中
B、称量烧杯及烧杯内物质的总质量
C、将试管内的溶液倒入烧杯(试管仍留在烧杯中),使二者反应,观 察实验现象
D、称量烧杯及烧杯内物质的总质量
E、比较反应前后物质总质量的变化
碳酸钠粉末逐渐消失,有气泡产生
天平指针向右偏,失去平衡
(P92-95)
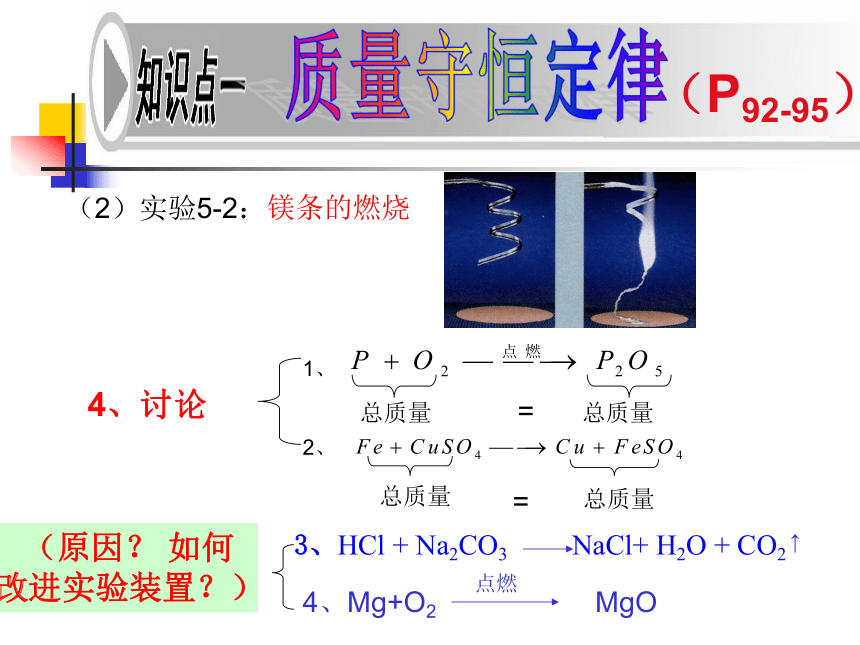
(2)实验5-2:
镁条的燃烧
4、讨论
3、HCl + Na2CO3 NaCl+ H2O + CO2
4、Mg+O2 MgO
点燃
总质量
总质量
=
1、
总质量
总质量
=
2、
(原因? 如何改进实验装置?)
↑
(P92-95)
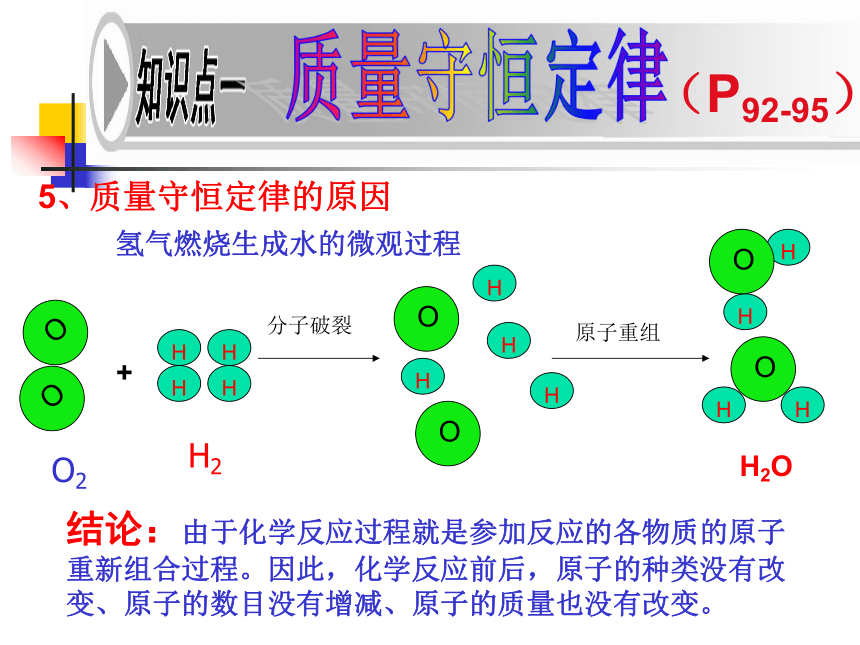
5、质量守恒定律的原因
O
H
H2
O2
O
O
H
H
H
H
+
分子破裂
H
H
O
H
H
H
O
H
H
O
原子重组
H2O
氢气燃烧生成水的微观过程
结论:由于化学反应过程就是参加反应的各物质的原子重新组合过程。因此,化学反应前后,原子的种类没有改变、原子的数目没有增减、原子的质量也没有改变。
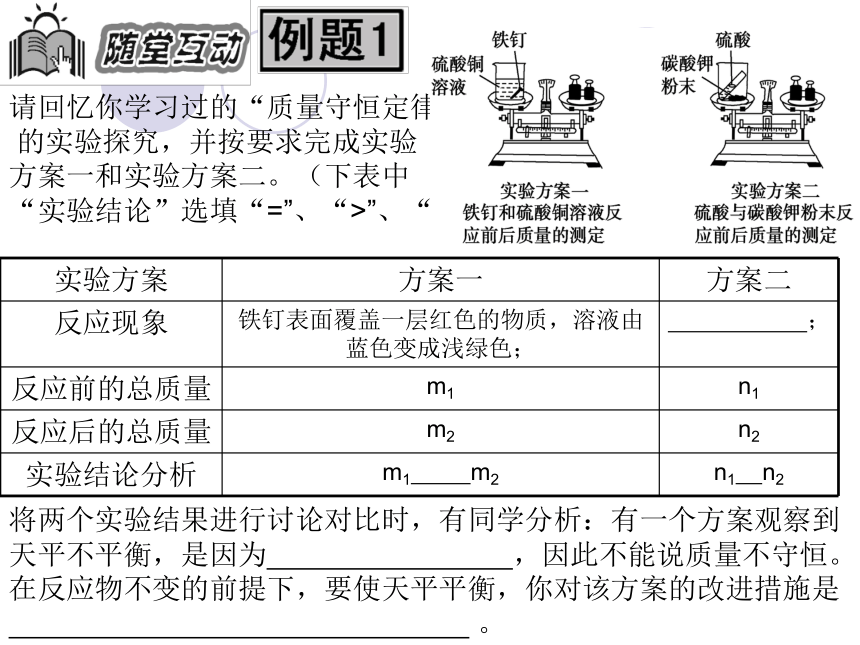
请回忆你学习过的“质量守恒定律”
的实验探究,并按要求完成实验
方案一和实验方案二。(下表中
“实验结论”选填“=”、“>”、“<”符号)
将两个实验结果进行讨论对比时,有同学分析:有一个方案观察到天平不平衡,是因为 ,因此不能说质量不守恒。在反应物不变的前提下,要使天平平衡,你对该方案的改进措施是
。
实验方案 方案一 方案二
反应现象 铁钉表面覆盖一层红色的物质,溶液由蓝色变成浅绿色; ;
反应前的总质量 m1 n1
反应后的总质量 m2 n2
实验结论分析 m1 m2 n1 n2
解析:Fe+CuSO4 = FeSO4+Cu,根据质量守恒定律,参加反应的铁钉和硫酸铜的总质量m1,应等于反应后生成的硫酸亚铁溶液和铜的总质量m2;H2SO4+K2CO3=K2SO4+H2O+CO2↑?,根据质量守恒定律,反应物硫酸和碳酸钾粉末的质量等于反应后生成的K2SO4溶液、H2O和CO2的质量总和,因CO2散逸到空气中,故n1>n2。
答案: 方案一:= 方案二:有气泡产生 >
碳酸钾粉末与硫酸反应产生的气体向空气中逸出;
使反应在密闭容器中进行。
(P92-95)
1.(多选)右图装置不能用作证明
质量守恒定律实验的是( )
2.下列质量守恒定律的理解中正
确的是( )
A.化学反应前后各物质的种类不变
B.化学反应前后各物质的质量不变
C.化学反应前后各物质质量总和等于反应后生成的各物质质量总和
D.参加化学反应的各物质质量总和与反应后生成的各物质质量总和相等
C、D
D
4、【解析】根据质量守恒定律可知化学反应前后原子的种类和数目不发生变化,分子的种类一定发生变化。故A、B项不正确;由微观图示所以知道该反应是二变一的反应为化合反应,故C项正确;参加反应的两种分子的个数比为1∶1,故D项错误。
(P92-95)
(P36-37)
3.(宁夏)在化学反应前后,肯定不会变化的是( )
①原子的数目 ②分子的数目 ③元素的种类 ④物质的质量总和 ⑤物质的种类 ⑥物质的体积 ⑦物质的状态
A.②④⑤ B.①③④ C.①③④⑥ D.①③⑦
B
4.下图为某反应的微观示意图,其中“ ”和“ ”表示不同元素的原子。下列说法正确的是( )
A.反应前后原子数目发生改变 B.反应前后分子种类没有改变
C.该反应属于化合反应 D.参加反应的两种分子个数比为1∶2
C
(P96-97)
请阅读教材P96-97,并思考如下问题:
★化学方程式是用 来表示化学反应的式子。它不仅可表示 、 和 ,
还可以表示各物质间的 (即
各物质间的 )。
★化学方程式能表示哪些意义?
举例说明。
(P96-97)
回顾并思考:以CO2为例,说明化学式表示的意义。
写起来很麻烦
怎么办
木炭在氧气中燃烧生成二氧化碳的反应可以用文字表示为
碳
点燃
二氧化碳
+
氧气
“
和
”
“
反应条件
”
“
生成
”
反应物
生成物
,
(P96-97)
C + O2 CO2
点燃
和
条件
生成
1、这种用化学式表示化学反应的式子,叫做化学方程式。
2、化学方程式表明了
(1)反应物、生成物和反应条件;
(2)参加反应的各微粒之间的数量关系;
(3)表示各物质之间的质量关系,即各物质之间的质量比,通过相对分子质量(或相对原子质量)来表示。
粒子个数比
质量比
反应物:S、O2。生成物:SO2。条件:点燃
表示反应物.生成物及反应条件
32 :16×2 :32+16×2
32 : 32 : 64
1 : 1 : 1
S+O2 SO2
意义
点燃
S + O2 SO2
点燃
例:S + O2 SO2
点燃
S + O2 SO2
点燃
(P96-97)
(P96-97)
化学方程式S+O2 SO2读作( )
A.硫元素和氧气点燃后生成二氧化硫
B.硫和氧气混合生成二氧化硫
C.硫和氧气在点燃条件下反应生成二氧化硫
D.硫加氧气等于二氧化硫
点燃
解析:A选项反应物是硫单质,而不是硫元素;B没有说明反应条件;C正确;D“+”在化学方程式中表示“和、与”,“”表示“生成”,而不能简单读成“加”、“等于”。
C
5.化学方程式可表明( )
①反应物、生成物和反应条件 ②反应物、生成物各物质之间的质量比③符合质量守恒定律④反应物和生成物之间分子(原子)数关系
A.①② B.④ C.②③④ D.①②③④
(P96-97)
(P37)
D
6.化学方程式2Mg+O2 2MgO读作( )
A.2个镁原子和1个氧分子在点燃条件下反应,生成2个氧化镁分子
B.镁跟氧气化合生成氧化镁
C.在点燃条件下,每48份质量的镁跟32份质量的氧气反应,生成80 份质量的氧化镁
D.镁加氧气等于氧化镁
点燃
C
1、通过实验探究从宏观角度得出并验 证了质量守恒定律:
参加化学反应 的各物质的质量总和,等于反应后生成的各物质的质量总和。
2、用分子和原子的有关知识从微观角度分析了质量守恒的原因;
原子数目
原子质量
原子种类
微观
物质的总质量
元素种类
物质的种类
分子的种类
改变
宏观
可能改变
分子的数目
五不变
3、应用质量守恒定律解决生活中遇到的问题。
4、化学方程式及其表示的意义
1.(成都)使用下图装置进行验证质量守恒定律的实验,下列反应中应选择( )
A.6HCl+2Al(OH)3 = 2AlCl3+6H2O
B.CO2+H2O=H2CO3
C.NH4Cl+NaOH=NaCl+NH3↑+H2O
D.4P+5O2=2P2O5
2.(西宁)某反应的微观示意图如下(一种小球代表一种元素的原子),下列说法错误的是( )
A.该反应符合质量守恒定律 B.该反应的本质是原子的重新组合
C.该反应中的反应物都是化合物 D.该反应前后分子的种类发生改变
第五单元 课题1 (P85)
第五单元 课题1 (P85)
3.(昆明)请根据化学方程式(2Mg+O2
2MgO)分析下图所示的四种说法,其中错误
的是( )
4.(扬州)如图所示:2个甲分子反应生成1个乙分子和3个丙分子,则下列判断不正确的是( )
A.1个丙分子中含有2个A原子
B.该反应属于分解反应
C.乙物质属于单质
D.反应中原子的种类发生了改变
5.(天津)下图中四位同学正在讨论某一化学方程式表示的意义,他们所描述的化学方程式是( )
A.C+O2 CO2
B.2CO+O2 2CO2
C.2H2+O2 2H2O
D.CH4+2O2 CO2+2H2O
点燃
点燃
点燃
点燃
点燃
第五单元 课题1 (P85)
6.(西宁)2011年5月1日起《中华人民共和国刑法修正案(八)》正式实施,司机酒后驾车将受到严惩。交警常用一种“酒精检测仪”检查司机是否酒后驾车。反应原理为C2H5OH+4CrO3+6H2SO4=2X+2CO2↑+9H2O,反应中红色的CrO3转变为绿色的化合物X。则X的化学式为( )
A.Cr2O3 B.CrSO3 C.Cr2S3 D.Cr2(SO4)3
7.(青岛)在“宏观—微观—符号”之间建立联系,是化学学科特有的思维方式。以下是某化学反应
的微观示意图:
请回答以下问题:
(1)该反应前后涉及的化合物
共有 种,A物质的化学式为 。
(2)分析微观示意图,你能获得的信息还有(各写一条):
宏观方面: ;
微观方面: 。
1.知识与技能
认识质量守恒定律,了解常见化学反应中反应物与生成物的质量关系。从微观角度认识,在一切化学反应中,反应前后原子的种类和原子的数目没有增减。
2.过程与方法
通过具体的探究活动,了解质量守恒定律的内容,并从微观角度解释化学反应的实质。
3.情感态度与价值观
通过对质量守恒定律的探究,体会成功的乐趣,培养同学们团结协作的团队精神。
(P92-95)
请阅读教材P92-95,完成相应实验并思考如下问题:
★参加 的各物质的质量总和 反应后生成的各物质的质量总和,这个规律叫质量守恒定律。
★从原子、分子观点来看,化学反应的过程,就是参加反应的各物质的 重新组合而生成新的 的过程。在一切化学反应中,反应前后原子的 没有改变,原子的 没有增减,原子的
也没有变化。所以,化学反应前后各物质的 必然相等。
1774年,拉瓦锡用精确的定量实验研究了氧化汞的分解和合成反应中各物质的质量之间的变化关系。他将45.0份质量的氧化汞加热分解,恰好得到了41.5份质量的汞和3.5份质量的氧气。
(P92-95)
1、拉瓦锡的实验发现
1789年,拉瓦锡出版了他的名著《化学概论》。在《化学概论》里,拉瓦锡批判了燃素学说,他自己的燃烧理论,归纳成这样四点:
1、燃烧时放出光和热;
2、物质只在氧气中燃烧;
3、氧气在燃烧时被消耗;燃烧物在燃烧后所增加的重量,等于所消耗的氧气的重量;
4、燃烧后,燃烧物往往变成酸性氧化物,而金属则变为残渣。
(P92-95)
2、活动探究
(1)、方案一:
(2)、方案二:
实验现象:点燃白磷,观察到剧烈燃烧,放热,产生大量白烟(气球先膨胀后缩小) 天平平衡、质量相等
实验现象:铁钉表面产生红色物质,溶液颜色 逐渐变浅(由蓝色变为浅绿色)
天平平衡、质量相等
(3)、探究结论:
参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。(质量守恒定律)
(P92-95)
3、实验5-1、实验5-2
(1)实验5-1 盐酸与碳酸钠粉末反应前后质量的测定
A、将盛有盐酸的小试管放入装有碳酸钠粉末的烧杯中
B、称量烧杯及烧杯内物质的总质量
C、将试管内的溶液倒入烧杯(试管仍留在烧杯中),使二者反应,观 察实验现象
D、称量烧杯及烧杯内物质的总质量
E、比较反应前后物质总质量的变化
碳酸钠粉末逐渐消失,有气泡产生
天平指针向右偏,失去平衡
(P92-95)
(2)实验5-2:
镁条的燃烧
4、讨论
3、HCl + Na2CO3 NaCl+ H2O + CO2
4、Mg+O2 MgO
点燃
总质量
总质量
=
1、
总质量
总质量
=
2、
(原因? 如何改进实验装置?)
↑
(P92-95)
5、质量守恒定律的原因
O
H
H2
O2
O
O
H
H
H
H
+
分子破裂
H
H
O
H
H
H
O
H
H
O
原子重组
H2O
氢气燃烧生成水的微观过程
结论:由于化学反应过程就是参加反应的各物质的原子重新组合过程。因此,化学反应前后,原子的种类没有改变、原子的数目没有增减、原子的质量也没有改变。
请回忆你学习过的“质量守恒定律”
的实验探究,并按要求完成实验
方案一和实验方案二。(下表中
“实验结论”选填“=”、“>”、“<”符号)
将两个实验结果进行讨论对比时,有同学分析:有一个方案观察到天平不平衡,是因为 ,因此不能说质量不守恒。在反应物不变的前提下,要使天平平衡,你对该方案的改进措施是
。
实验方案 方案一 方案二
反应现象 铁钉表面覆盖一层红色的物质,溶液由蓝色变成浅绿色; ;
反应前的总质量 m1 n1
反应后的总质量 m2 n2
实验结论分析 m1 m2 n1 n2
解析:Fe+CuSO4 = FeSO4+Cu,根据质量守恒定律,参加反应的铁钉和硫酸铜的总质量m1,应等于反应后生成的硫酸亚铁溶液和铜的总质量m2;H2SO4+K2CO3=K2SO4+H2O+CO2↑?,根据质量守恒定律,反应物硫酸和碳酸钾粉末的质量等于反应后生成的K2SO4溶液、H2O和CO2的质量总和,因CO2散逸到空气中,故n1>n2。
答案: 方案一:= 方案二:有气泡产生 >
碳酸钾粉末与硫酸反应产生的气体向空气中逸出;
使反应在密闭容器中进行。
(P92-95)
1.(多选)右图装置不能用作证明
质量守恒定律实验的是( )
2.下列质量守恒定律的理解中正
确的是( )
A.化学反应前后各物质的种类不变
B.化学反应前后各物质的质量不变
C.化学反应前后各物质质量总和等于反应后生成的各物质质量总和
D.参加化学反应的各物质质量总和与反应后生成的各物质质量总和相等
C、D
D
4、【解析】根据质量守恒定律可知化学反应前后原子的种类和数目不发生变化,分子的种类一定发生变化。故A、B项不正确;由微观图示所以知道该反应是二变一的反应为化合反应,故C项正确;参加反应的两种分子的个数比为1∶1,故D项错误。
(P92-95)
(P36-37)
3.(宁夏)在化学反应前后,肯定不会变化的是( )
①原子的数目 ②分子的数目 ③元素的种类 ④物质的质量总和 ⑤物质的种类 ⑥物质的体积 ⑦物质的状态
A.②④⑤ B.①③④ C.①③④⑥ D.①③⑦
B
4.下图为某反应的微观示意图,其中“ ”和“ ”表示不同元素的原子。下列说法正确的是( )
A.反应前后原子数目发生改变 B.反应前后分子种类没有改变
C.该反应属于化合反应 D.参加反应的两种分子个数比为1∶2
C
(P96-97)
请阅读教材P96-97,并思考如下问题:
★化学方程式是用 来表示化学反应的式子。它不仅可表示 、 和 ,
还可以表示各物质间的 (即
各物质间的 )。
★化学方程式能表示哪些意义?
举例说明。
(P96-97)
回顾并思考:以CO2为例,说明化学式表示的意义。
写起来很麻烦
怎么办
木炭在氧气中燃烧生成二氧化碳的反应可以用文字表示为
碳
点燃
二氧化碳
+
氧气
“
和
”
“
反应条件
”
“
生成
”
反应物
生成物
,
(P96-97)
C + O2 CO2
点燃
和
条件
生成
1、这种用化学式表示化学反应的式子,叫做化学方程式。
2、化学方程式表明了
(1)反应物、生成物和反应条件;
(2)参加反应的各微粒之间的数量关系;
(3)表示各物质之间的质量关系,即各物质之间的质量比,通过相对分子质量(或相对原子质量)来表示。
粒子个数比
质量比
反应物:S、O2。生成物:SO2。条件:点燃
表示反应物.生成物及反应条件
32 :16×2 :32+16×2
32 : 32 : 64
1 : 1 : 1
S+O2 SO2
意义
点燃
S + O2 SO2
点燃
例:S + O2 SO2
点燃
S + O2 SO2
点燃
(P96-97)
(P96-97)
化学方程式S+O2 SO2读作( )
A.硫元素和氧气点燃后生成二氧化硫
B.硫和氧气混合生成二氧化硫
C.硫和氧气在点燃条件下反应生成二氧化硫
D.硫加氧气等于二氧化硫
点燃
解析:A选项反应物是硫单质,而不是硫元素;B没有说明反应条件;C正确;D“+”在化学方程式中表示“和、与”,“”表示“生成”,而不能简单读成“加”、“等于”。
C
5.化学方程式可表明( )
①反应物、生成物和反应条件 ②反应物、生成物各物质之间的质量比③符合质量守恒定律④反应物和生成物之间分子(原子)数关系
A.①② B.④ C.②③④ D.①②③④
(P96-97)
(P37)
D
6.化学方程式2Mg+O2 2MgO读作( )
A.2个镁原子和1个氧分子在点燃条件下反应,生成2个氧化镁分子
B.镁跟氧气化合生成氧化镁
C.在点燃条件下,每48份质量的镁跟32份质量的氧气反应,生成80 份质量的氧化镁
D.镁加氧气等于氧化镁
点燃
C
1、通过实验探究从宏观角度得出并验 证了质量守恒定律:
参加化学反应 的各物质的质量总和,等于反应后生成的各物质的质量总和。
2、用分子和原子的有关知识从微观角度分析了质量守恒的原因;
原子数目
原子质量
原子种类
微观
物质的总质量
元素种类
物质的种类
分子的种类
改变
宏观
可能改变
分子的数目
五不变
3、应用质量守恒定律解决生活中遇到的问题。
4、化学方程式及其表示的意义
1.(成都)使用下图装置进行验证质量守恒定律的实验,下列反应中应选择( )
A.6HCl+2Al(OH)3 = 2AlCl3+6H2O
B.CO2+H2O=H2CO3
C.NH4Cl+NaOH=NaCl+NH3↑+H2O
D.4P+5O2=2P2O5
2.(西宁)某反应的微观示意图如下(一种小球代表一种元素的原子),下列说法错误的是( )
A.该反应符合质量守恒定律 B.该反应的本质是原子的重新组合
C.该反应中的反应物都是化合物 D.该反应前后分子的种类发生改变
第五单元 课题1 (P85)
第五单元 课题1 (P85)
3.(昆明)请根据化学方程式(2Mg+O2
2MgO)分析下图所示的四种说法,其中错误
的是( )
4.(扬州)如图所示:2个甲分子反应生成1个乙分子和3个丙分子,则下列判断不正确的是( )
A.1个丙分子中含有2个A原子
B.该反应属于分解反应
C.乙物质属于单质
D.反应中原子的种类发生了改变
5.(天津)下图中四位同学正在讨论某一化学方程式表示的意义,他们所描述的化学方程式是( )
A.C+O2 CO2
B.2CO+O2 2CO2
C.2H2+O2 2H2O
D.CH4+2O2 CO2+2H2O
点燃
点燃
点燃
点燃
点燃
第五单元 课题1 (P85)
6.(西宁)2011年5月1日起《中华人民共和国刑法修正案(八)》正式实施,司机酒后驾车将受到严惩。交警常用一种“酒精检测仪”检查司机是否酒后驾车。反应原理为C2H5OH+4CrO3+6H2SO4=2X+2CO2↑+9H2O,反应中红色的CrO3转变为绿色的化合物X。则X的化学式为( )
A.Cr2O3 B.CrSO3 C.Cr2S3 D.Cr2(SO4)3
7.(青岛)在“宏观—微观—符号”之间建立联系,是化学学科特有的思维方式。以下是某化学反应
的微观示意图:
请回答以下问题:
(1)该反应前后涉及的化合物
共有 种,A物质的化学式为 。
(2)分析微观示意图,你能获得的信息还有(各写一条):
宏观方面: ;
微观方面: 。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
