人教版(五四学制)八年级全一册 第3单元《物质构成的奥秘》单元测试卷(一)(word版 含答案)
文档属性
| 名称 | 人教版(五四学制)八年级全一册 第3单元《物质构成的奥秘》单元测试卷(一)(word版 含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 148.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-30 08:35:55 | ||
图片预览




文档简介
人教五四版八年级上学期单元测试卷(一)
第3单元《物质构成的奥秘》
一.选择题(共26小题)
1.3000L氧气在加压时可装入20L的钢瓶中是因为( )
A.分子的质量很小 B.分子在不断地运动
C.分子之间有间隔 D.分子是由原子构成
2.下列事实不能作为相应观点的证据的是( )
A.少量干冰放入塑料袋中并密封,塑料袋会快速鼓起,说明分子间隔变大
B.电解水得到氢气和氧气,说明分子是可分的
C.一氧化碳具有可燃性,而二氧化碳则不可燃,说明分子构成不同化学性质不同
D.二氧化锰是过氧化氢分解的催化剂,说明化学反应前后二氧化锰的质量和性质都不变
3.下列客观事实的微观解释正确的是( )
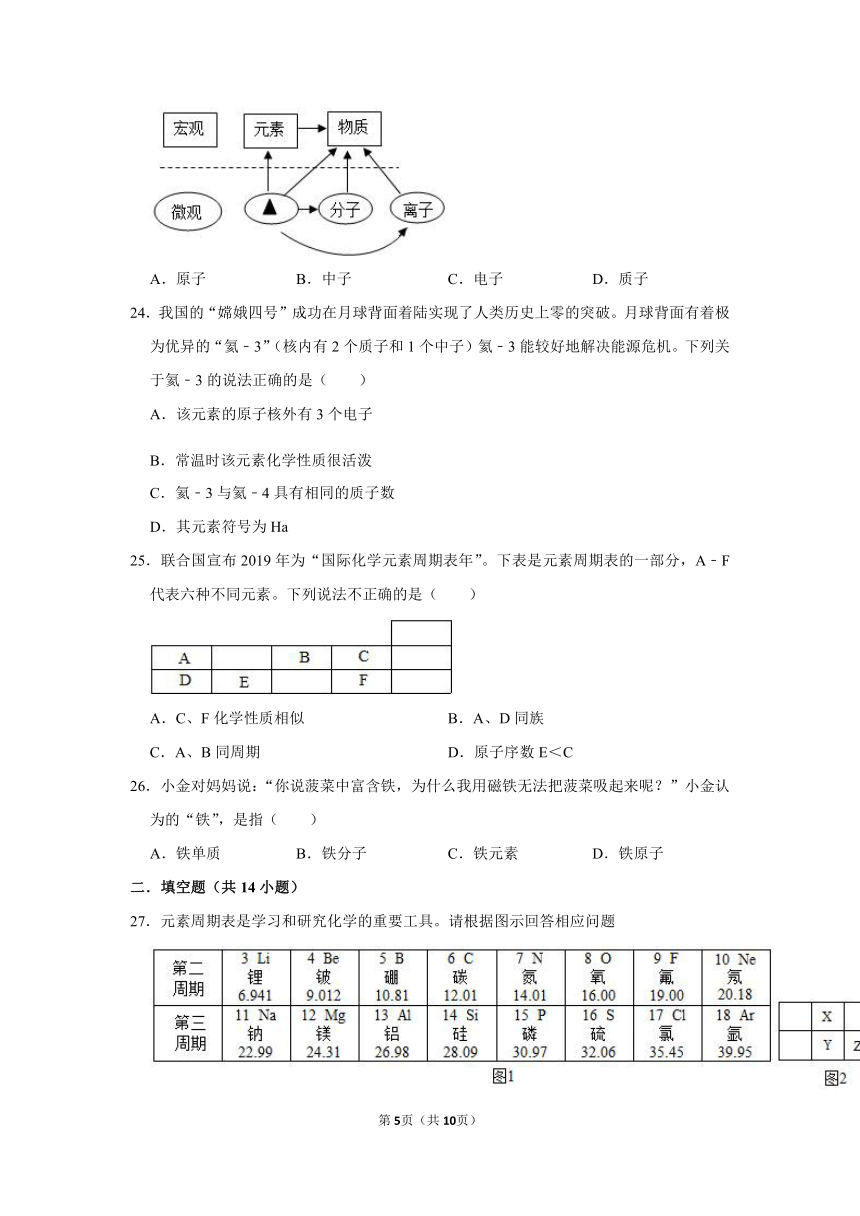
A.NaOH溶液能导电是因为溶液中存在自由移动的Na+、OH﹣
B.H2O在通电条件下产生H2是因为水分子中有氢分子
C.搅拌能加快蔗糖在水中的溶解是因为搅拌使蔗糖分子在水中溶解更多
D.水烧开后易把壶盖冲起是因为温度升高分子会变大
4.日常生活中有“加碘食盐”“高钙牛奶”“含氟牙膏”,这里的碘、钙、氟应理解为( )
A.分子 B.元素 C.原子 D.离子
5.地壳中含量最多的元素是( )
A.Si B.O C.Cl D.Al
6.如图表示四种原子的结构模型,下列说法正确的是( )
A.甲、丁的相对原子质量相同
B.甲、丁不属于同一种元素
C.甲、丙的核电荷数不同
D.甲、乙为互为同位素原子
7.下列各组都是非金属元素的是( )
A.S、Si、Fe B.P、H、O C.Cu、C、Cl D.Al、C、Ca
8.下列含金属元素的物质是( )
A.H2CO3 B.Al2O3 C.NO2 D.P2O5
9.如图中“〇”和“●”分别表示氧原子和碳原子,能保持一氧化碳化学性质的粒子是( )
A. B.
C. D.
10.科学家在深海海底发现了大量未来太阳能光伏发电必需的元素一碲,碲元素在周期表中的信息如图所示。下列说法不正确的是( )
A.碲原子的核外电子数为52
B.碲的元素符号为Te
C.碲原子的相对原子质量为127.6g
D.碲是非金属元素
11.地质学家在浙江的西北部发现了稀土矿,其中含有一种元素钪,钪呈银白色,质软,在空气中会迅速氧化而失去光泽。主要存在于极稀少的钪钇石中。下列有关钪的说法中错误的是( )
A.钪是一种金属元素,产量少
B.稀土矿是一种混合物
C.钪原子的相对原子质量为44.96
D.钪的化学性质不活泼
12.受损元素周期表中某元素的残留信息如图所示,根据残留信息得出的下列说法中正确的是( )
A.该元素位于第二周期
B.由图示可知该元素不能直接构成物质,必须先构成分子,再构成物质
C.该元素与钠离子化学性质相似
D.该元素的原子在化学反应中易失去一个电子
13.在最新公布中文名称的元素中元素的相关信息如图所示。下列有关的说法正确的是( )
A.原子序数为176 B.原子的质子数为118
C.元素符号为uU0 D.相对原子质量为294g
14.科学研究表明:海洋生物可利用氮的多寡是影响海洋生产力的重要因素,且氮的生物地球化学循环会产生大量温室效应气体。因而,氮循环的波动对全球气候变化有着重要影响。上述有关表述中的“氮”指的是( )
A.原子 B.分子 C.元素 D.物质
15.不同种元素最本质的区别是( )
A.质子数不同 B.核外电子数不同
C.中子数不同 D.最外层电子数不同
16.下列各种微粒,不带电的是( )
A.原子 B.电子 C.质子 D.原子核
17.图中“●”和“O”分别表示氢原子和氧原子,其中能表示水分子的是( )
A. B. C. D.
18.如图为元素周期表第四周期的局部。下列有关说法正确的是( )
A.砷和硒均属于金属元素
B.锗元素的相对原子质量x小于69.72
C.镓原子的核电荷数为31
D.Se2﹣的核外电子数为34
19.下列变化能证明分子可以再分的是( )
A.冰融化 B.切西瓜 C.碘升华 D.电解水
20.下列属于非金属元素的是( )
A.Mg B.Zn C.Cl D.Ag
21.元素周期表是学习和研究化学的重要工具,可以从表中获得许多信息。下表是元素周期表的一部分,有关推断不正确的是( )
A.①代表的是碳元素
B.②元素的原子容易失去两个电子
C.③元素与氮元素的化学性质相似
D.元素②和④组成物质的化学式为MgCl
22.考古学家通过测定碳14的含量等方法将人类生活在黄土高原的历史推前至距今212万年。碳14原子的核电荷数为6,相对原子质量为14,则该原子核外电子数为( )
A.6 B.8 C.14 D.20
23.思维导图有助于建构知识,如图是小金建立的有关物质宏观组成和微观构成的思维导图,其中“▲”应填入的是( )
A.原子 B.中子 C.电子 D.质子
24.我国的“嫦娥四号”成功在月球背面着陆实现了人类历史上零的突破。月球背面有着极为优异的“氦﹣3”(核内有2个质子和1个中子)氦﹣3能较好地解决能源危机。下列关于氦﹣3的说法正确的是( )
A.该元素的原子核外有3个电子
B.常温时该元素化学性质很活泼
C.氦﹣3与氦﹣4具有相同的质子数
D.其元素符号为Ha
25.联合国宣布2019年为“国际化学元素周期表年”。下表是元素周期表的一部分,A﹣F代表六种不同元素。下列说法不正确的是( )
A.C、F化学性质相似 B.A、D同族
C.A、B同周期 D.原子序数E<C
26.小金对妈妈说:“你说菠菜中富含铁,为什么我用磁铁无法把菠菜吸起来呢?”小金认为的“铁”,是指( )
A.铁单质 B.铁分子 C.铁元素 D.铁原子
二.填空题(共14小题)
27.元素周期表是学习和研究化学的重要工具。请根据图示回答相应问题
(1)原子序数为1、7、8的三种元素形成的氮肥的化学式是 。
(2)图2为元素周期表的一部分,X、Y、Z代表三种不同元素,以下 判断错误。
A.原子序数Z>Y B.核外电子数:X=Y C.Y和Z处于同一周期
(3)从图2中分析,X是氧元素,则Z的原子最外层电子数是 。
(4)具有相同原子数和电子数的分子或离子叫等电子体,等电子体具有相似的结构和性质,下列各组粒子中不属于等电子体的是 (填字母序号)。
A.CO和N2 B.SO2和CO2 C.PO43﹣和SO42﹣
(5)写出一条第二周期元素原子的核电荷数变化规律: 。
(6)钠元素与氯元素的本质区别是 。
28.铝是生活中用途很广的金属材料。根据如图回答问题:
(1)铝原子核内的质子数为 。
(2)铝的相对原子质量为 。
(3)地壳中含量最多的元素与铝元素组成的化合物的化学式为 ,该化合物中铝元素的化合价为 。
29.如图是元素周期表部分元素的信息,根据所给信息按要求填空。
(1)写出一个三原子分子,且含有10个电子,俗称生命之源的物质的化学式 。
(2)写出一个四原子分子,且一个分子内有10个电子,溶于水,水溶液显碱性的气体的化学式 。
(3)写出三种第一元素组成的物质的化学式 。
(4)写出16号元素的离子符号 。
(5)一种金属氧化物当含少量Fe3+的杂质时,叫红宝石,当含少量Fe2+的杂质时,叫绿宝石,写出这种金属氧化物的化学式 。
30.元素周期表是学习和研究化学的重要工具,请根据下列信息回答有关问题。
(1)2018年在新疆发现我国最大的铍(Be)矿。铍原子的核电荷数为 ,相对原子质量为 。
(2)X2+与Ar的核外电子排布相同,则X的元素符号是 ,它处在元素周期表中第 周期
(3)He、Ne、Ar的化学性质很不活泼,其原因是 。
31.从微观角度回答下列问题
(1)S8表示一个 (填“分子”、“原子”或“离子”)
(2)湿衣服在阳光下比在室内更容易晾干,从微观角度分析其原因是: 。
32.(1)元素周期表是化学学习和研究的重要工具。如图是元素周期表的一部分。
①表中查出硅(Si)元素的相对原子质量为 ;
②9号元素与12号元素形成化合物的化学式为 ;③11号元素至18号元素同属第三周期,从核外电子排布来看你发现的规律是 。
(2)在化学反应中,反应物中某元素的化合价在反应后如果增加,则该物质是还原剂,如果是减少的则该物质是氧化剂。请判断反应:2Na+Cl2═2NaCl中,还原剂是 。
33.元素周期表将已知元素科学有序地排列起来,便于我们研究它们的性质和用途。下表表示元素周期表的一部分,请回答下列问题。
(1)表中③代表的元素是 ,②代表的元素与N 元素间最本质的区别是 不同。
(2)表中氮元素的化合价有多种,写出化合价为+5 价的氮的氧化物化学式 。
(3)随着新元素的不断发现,元素周期表还将逐渐完善。最近,科学家用大量高速钙原子轰击锫原子,形成了 117 号元素的原子,该元素原子核中一定含有117 个 。
34.写出下列元素符号或名称
①铝 ②氯 ③Si ④Ca 。
35.(1)水和过氧化氢都是由 构成(填“分子”“原子”或“离子”);构成它们的微粒中都有氧 (填“分子”“原子”或“元素”);
(2)元素周期表中同一主族的元素具有相似的化学性质,例如硒(Se)和S有相似的化学性质,则图中m= ,硒离子的符号为 。
36.能保持二氧化碳化学性质的最小微粒是 ,能保持铁的化学性质的最小微粒是 ,在水通电分解生成氢气和氧气的化学变化中的最小微粒是 、 。
37.如图分别为空气成分示意图(按体积分数计算)和地壳中元素含量示意图(按质量分数计算),其中“A”表示的是 ,B和C所形成化合物的化学式为 。
38.化学的学科特征是从原子、分子的层面上研究物质,请从微观角度解释下列问题:
(1)通常状况下的6 000L 乙炔气体可被压缩进40L 的钢瓶中,说明了 。
(2)金刚石和石墨都是碳单质,但由于 不同,导致彼此物理性质迥异。
(3)空气是混合物,而氧气是纯净物,原因是 。
(4)水电解生成氢气和氧气,说明在化学变化中 发生了改变。
(5)气体X点燃可以在氧气中燃烧生成氮气和水,X分子中一定含有的原子是 (填符号)。
39.原子或离子半径大小比较的一般方法是:电子层数越多,半径越大;若电子层数相同,则核电荷数越大,半径越小;若电子层数和核电荷数均相同,则最外层电子数越多,半径越大。
对金属元素来说,原子半径越大,最外层电子数越少,金属性越强,其对应的氢氧化物碱性越强,其对应的阳离子的氧化性越弱。有Na、Mg、K(其原子核外电子排布是:第一层2个,第二层8个,第三层8个,第四层1个 )三种金属;NaOH、Mg(OH)2、KOH中碱性最强的是 ,Na+、Mg2+、K+中氧化性最强的是 。
40.科学研究证实,物质从宏观上讲是由元素组成,从微观上讲是粒子构成的,例如铁是由铁原子构成的。请你在下列空格里,用“元素、原子、分子、离子、质子、中子、电子等填空:
(1)水是由氧、氢两种 组成的;
(2)保持氢气化学性质的最小粒子是氢 ;
(3)化学变化中的最小粒子是 ;
(4)体温计中的汞是由汞 构成的;
(5)供给人呼吸的氧气是由氧 构成的;
(6)用于配制生理盐水的氯化钠晶体是由 构成的。
参考答案
一.选择题(共26小题)
1.C; 2.D; 3.A; 4.B; 5.B; 6.AB; 7.B; 8.B; 9.D; 10.C; 11.D; 12.D; 13.B; 14.C; 15.A; 16.A; 17.B; 18.C; 19.D; 20.C; 21.D; 22.A; 23.A; 24.C; 25.D; 26.A;
二.填空题(共14小题)
27.NH4NO3;B;7;B;从左到右,原子的核电荷数依次递增;质子数不同(或核电荷数不同);
28.13;26.98;Al2O3;+3;
29.H2O;NH3;HCl、H2SO4、NaOH;S2﹣;Al2O3;
30.4;9.012;Ca;四;原子最外层电子数都达到了稳定结构;
31.分子;阳光下温度高,水分子的运动速率加快;
32.28.09;MgF2;核外都是三个电子层,从左至右最外层电子数依次增加;Na; 33.镁;质子数;N2O5;质子;
34.Al;Cl;硅;钙; 35.分子;原子;34;Se2﹣; 36.二氧化碳分子;铁原子;氢原子;氧原子; 37.氮气;SiO2; 38.分子间有间隔,在受压时间隔变小;排列方式;分子构成不同;分子种类;N、H; 39.KOH;Mg2+; 40.元素;分子;原子;原子;分子;离子;
第1页(共2页)
第3单元《物质构成的奥秘》
一.选择题(共26小题)
1.3000L氧气在加压时可装入20L的钢瓶中是因为( )
A.分子的质量很小 B.分子在不断地运动
C.分子之间有间隔 D.分子是由原子构成
2.下列事实不能作为相应观点的证据的是( )
A.少量干冰放入塑料袋中并密封,塑料袋会快速鼓起,说明分子间隔变大
B.电解水得到氢气和氧气,说明分子是可分的
C.一氧化碳具有可燃性,而二氧化碳则不可燃,说明分子构成不同化学性质不同
D.二氧化锰是过氧化氢分解的催化剂,说明化学反应前后二氧化锰的质量和性质都不变
3.下列客观事实的微观解释正确的是( )
A.NaOH溶液能导电是因为溶液中存在自由移动的Na+、OH﹣
B.H2O在通电条件下产生H2是因为水分子中有氢分子
C.搅拌能加快蔗糖在水中的溶解是因为搅拌使蔗糖分子在水中溶解更多
D.水烧开后易把壶盖冲起是因为温度升高分子会变大
4.日常生活中有“加碘食盐”“高钙牛奶”“含氟牙膏”,这里的碘、钙、氟应理解为( )
A.分子 B.元素 C.原子 D.离子
5.地壳中含量最多的元素是( )
A.Si B.O C.Cl D.Al
6.如图表示四种原子的结构模型,下列说法正确的是( )
A.甲、丁的相对原子质量相同
B.甲、丁不属于同一种元素
C.甲、丙的核电荷数不同
D.甲、乙为互为同位素原子
7.下列各组都是非金属元素的是( )
A.S、Si、Fe B.P、H、O C.Cu、C、Cl D.Al、C、Ca
8.下列含金属元素的物质是( )
A.H2CO3 B.Al2O3 C.NO2 D.P2O5
9.如图中“〇”和“●”分别表示氧原子和碳原子,能保持一氧化碳化学性质的粒子是( )
A. B.
C. D.
10.科学家在深海海底发现了大量未来太阳能光伏发电必需的元素一碲,碲元素在周期表中的信息如图所示。下列说法不正确的是( )
A.碲原子的核外电子数为52
B.碲的元素符号为Te
C.碲原子的相对原子质量为127.6g
D.碲是非金属元素
11.地质学家在浙江的西北部发现了稀土矿,其中含有一种元素钪,钪呈银白色,质软,在空气中会迅速氧化而失去光泽。主要存在于极稀少的钪钇石中。下列有关钪的说法中错误的是( )
A.钪是一种金属元素,产量少
B.稀土矿是一种混合物
C.钪原子的相对原子质量为44.96
D.钪的化学性质不活泼
12.受损元素周期表中某元素的残留信息如图所示,根据残留信息得出的下列说法中正确的是( )
A.该元素位于第二周期
B.由图示可知该元素不能直接构成物质,必须先构成分子,再构成物质
C.该元素与钠离子化学性质相似
D.该元素的原子在化学反应中易失去一个电子
13.在最新公布中文名称的元素中元素的相关信息如图所示。下列有关的说法正确的是( )
A.原子序数为176 B.原子的质子数为118
C.元素符号为uU0 D.相对原子质量为294g
14.科学研究表明:海洋生物可利用氮的多寡是影响海洋生产力的重要因素,且氮的生物地球化学循环会产生大量温室效应气体。因而,氮循环的波动对全球气候变化有着重要影响。上述有关表述中的“氮”指的是( )
A.原子 B.分子 C.元素 D.物质
15.不同种元素最本质的区别是( )
A.质子数不同 B.核外电子数不同
C.中子数不同 D.最外层电子数不同
16.下列各种微粒,不带电的是( )
A.原子 B.电子 C.质子 D.原子核
17.图中“●”和“O”分别表示氢原子和氧原子,其中能表示水分子的是( )
A. B. C. D.
18.如图为元素周期表第四周期的局部。下列有关说法正确的是( )
A.砷和硒均属于金属元素
B.锗元素的相对原子质量x小于69.72
C.镓原子的核电荷数为31
D.Se2﹣的核外电子数为34
19.下列变化能证明分子可以再分的是( )
A.冰融化 B.切西瓜 C.碘升华 D.电解水
20.下列属于非金属元素的是( )
A.Mg B.Zn C.Cl D.Ag
21.元素周期表是学习和研究化学的重要工具,可以从表中获得许多信息。下表是元素周期表的一部分,有关推断不正确的是( )
A.①代表的是碳元素
B.②元素的原子容易失去两个电子
C.③元素与氮元素的化学性质相似
D.元素②和④组成物质的化学式为MgCl
22.考古学家通过测定碳14的含量等方法将人类生活在黄土高原的历史推前至距今212万年。碳14原子的核电荷数为6,相对原子质量为14,则该原子核外电子数为( )
A.6 B.8 C.14 D.20
23.思维导图有助于建构知识,如图是小金建立的有关物质宏观组成和微观构成的思维导图,其中“▲”应填入的是( )
A.原子 B.中子 C.电子 D.质子
24.我国的“嫦娥四号”成功在月球背面着陆实现了人类历史上零的突破。月球背面有着极为优异的“氦﹣3”(核内有2个质子和1个中子)氦﹣3能较好地解决能源危机。下列关于氦﹣3的说法正确的是( )
A.该元素的原子核外有3个电子
B.常温时该元素化学性质很活泼
C.氦﹣3与氦﹣4具有相同的质子数
D.其元素符号为Ha
25.联合国宣布2019年为“国际化学元素周期表年”。下表是元素周期表的一部分,A﹣F代表六种不同元素。下列说法不正确的是( )
A.C、F化学性质相似 B.A、D同族
C.A、B同周期 D.原子序数E<C
26.小金对妈妈说:“你说菠菜中富含铁,为什么我用磁铁无法把菠菜吸起来呢?”小金认为的“铁”,是指( )
A.铁单质 B.铁分子 C.铁元素 D.铁原子
二.填空题(共14小题)
27.元素周期表是学习和研究化学的重要工具。请根据图示回答相应问题
(1)原子序数为1、7、8的三种元素形成的氮肥的化学式是 。
(2)图2为元素周期表的一部分,X、Y、Z代表三种不同元素,以下 判断错误。
A.原子序数Z>Y B.核外电子数:X=Y C.Y和Z处于同一周期
(3)从图2中分析,X是氧元素,则Z的原子最外层电子数是 。
(4)具有相同原子数和电子数的分子或离子叫等电子体,等电子体具有相似的结构和性质,下列各组粒子中不属于等电子体的是 (填字母序号)。
A.CO和N2 B.SO2和CO2 C.PO43﹣和SO42﹣
(5)写出一条第二周期元素原子的核电荷数变化规律: 。
(6)钠元素与氯元素的本质区别是 。
28.铝是生活中用途很广的金属材料。根据如图回答问题:
(1)铝原子核内的质子数为 。
(2)铝的相对原子质量为 。
(3)地壳中含量最多的元素与铝元素组成的化合物的化学式为 ,该化合物中铝元素的化合价为 。
29.如图是元素周期表部分元素的信息,根据所给信息按要求填空。
(1)写出一个三原子分子,且含有10个电子,俗称生命之源的物质的化学式 。
(2)写出一个四原子分子,且一个分子内有10个电子,溶于水,水溶液显碱性的气体的化学式 。
(3)写出三种第一元素组成的物质的化学式 。
(4)写出16号元素的离子符号 。
(5)一种金属氧化物当含少量Fe3+的杂质时,叫红宝石,当含少量Fe2+的杂质时,叫绿宝石,写出这种金属氧化物的化学式 。
30.元素周期表是学习和研究化学的重要工具,请根据下列信息回答有关问题。
(1)2018年在新疆发现我国最大的铍(Be)矿。铍原子的核电荷数为 ,相对原子质量为 。
(2)X2+与Ar的核外电子排布相同,则X的元素符号是 ,它处在元素周期表中第 周期
(3)He、Ne、Ar的化学性质很不活泼,其原因是 。
31.从微观角度回答下列问题
(1)S8表示一个 (填“分子”、“原子”或“离子”)
(2)湿衣服在阳光下比在室内更容易晾干,从微观角度分析其原因是: 。
32.(1)元素周期表是化学学习和研究的重要工具。如图是元素周期表的一部分。
①表中查出硅(Si)元素的相对原子质量为 ;
②9号元素与12号元素形成化合物的化学式为 ;③11号元素至18号元素同属第三周期,从核外电子排布来看你发现的规律是 。
(2)在化学反应中,反应物中某元素的化合价在反应后如果增加,则该物质是还原剂,如果是减少的则该物质是氧化剂。请判断反应:2Na+Cl2═2NaCl中,还原剂是 。
33.元素周期表将已知元素科学有序地排列起来,便于我们研究它们的性质和用途。下表表示元素周期表的一部分,请回答下列问题。
(1)表中③代表的元素是 ,②代表的元素与N 元素间最本质的区别是 不同。
(2)表中氮元素的化合价有多种,写出化合价为+5 价的氮的氧化物化学式 。
(3)随着新元素的不断发现,元素周期表还将逐渐完善。最近,科学家用大量高速钙原子轰击锫原子,形成了 117 号元素的原子,该元素原子核中一定含有117 个 。
34.写出下列元素符号或名称
①铝 ②氯 ③Si ④Ca 。
35.(1)水和过氧化氢都是由 构成(填“分子”“原子”或“离子”);构成它们的微粒中都有氧 (填“分子”“原子”或“元素”);
(2)元素周期表中同一主族的元素具有相似的化学性质,例如硒(Se)和S有相似的化学性质,则图中m= ,硒离子的符号为 。
36.能保持二氧化碳化学性质的最小微粒是 ,能保持铁的化学性质的最小微粒是 ,在水通电分解生成氢气和氧气的化学变化中的最小微粒是 、 。
37.如图分别为空气成分示意图(按体积分数计算)和地壳中元素含量示意图(按质量分数计算),其中“A”表示的是 ,B和C所形成化合物的化学式为 。
38.化学的学科特征是从原子、分子的层面上研究物质,请从微观角度解释下列问题:
(1)通常状况下的6 000L 乙炔气体可被压缩进40L 的钢瓶中,说明了 。
(2)金刚石和石墨都是碳单质,但由于 不同,导致彼此物理性质迥异。
(3)空气是混合物,而氧气是纯净物,原因是 。
(4)水电解生成氢气和氧气,说明在化学变化中 发生了改变。
(5)气体X点燃可以在氧气中燃烧生成氮气和水,X分子中一定含有的原子是 (填符号)。
39.原子或离子半径大小比较的一般方法是:电子层数越多,半径越大;若电子层数相同,则核电荷数越大,半径越小;若电子层数和核电荷数均相同,则最外层电子数越多,半径越大。
对金属元素来说,原子半径越大,最外层电子数越少,金属性越强,其对应的氢氧化物碱性越强,其对应的阳离子的氧化性越弱。有Na、Mg、K(其原子核外电子排布是:第一层2个,第二层8个,第三层8个,第四层1个 )三种金属;NaOH、Mg(OH)2、KOH中碱性最强的是 ,Na+、Mg2+、K+中氧化性最强的是 。
40.科学研究证实,物质从宏观上讲是由元素组成,从微观上讲是粒子构成的,例如铁是由铁原子构成的。请你在下列空格里,用“元素、原子、分子、离子、质子、中子、电子等填空:
(1)水是由氧、氢两种 组成的;
(2)保持氢气化学性质的最小粒子是氢 ;
(3)化学变化中的最小粒子是 ;
(4)体温计中的汞是由汞 构成的;
(5)供给人呼吸的氧气是由氧 构成的;
(6)用于配制生理盐水的氯化钠晶体是由 构成的。
参考答案
一.选择题(共26小题)
1.C; 2.D; 3.A; 4.B; 5.B; 6.AB; 7.B; 8.B; 9.D; 10.C; 11.D; 12.D; 13.B; 14.C; 15.A; 16.A; 17.B; 18.C; 19.D; 20.C; 21.D; 22.A; 23.A; 24.C; 25.D; 26.A;
二.填空题(共14小题)
27.NH4NO3;B;7;B;从左到右,原子的核电荷数依次递增;质子数不同(或核电荷数不同);
28.13;26.98;Al2O3;+3;
29.H2O;NH3;HCl、H2SO4、NaOH;S2﹣;Al2O3;
30.4;9.012;Ca;四;原子最外层电子数都达到了稳定结构;
31.分子;阳光下温度高,水分子的运动速率加快;
32.28.09;MgF2;核外都是三个电子层,从左至右最外层电子数依次增加;Na; 33.镁;质子数;N2O5;质子;
34.Al;Cl;硅;钙; 35.分子;原子;34;Se2﹣; 36.二氧化碳分子;铁原子;氢原子;氧原子; 37.氮气;SiO2; 38.分子间有间隔,在受压时间隔变小;排列方式;分子构成不同;分子种类;N、H; 39.KOH;Mg2+; 40.元素;分子;原子;原子;分子;离子;
第1页(共2页)
同课章节目录
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的构成
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题1 质量守恒定律
- 课题2 如何正确书写化学方程式
- 课题3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动3 燃烧的条件
- 旧版目录
- 第五单元 物质组成的表示
- 课题2 燃料和热量
- 课题3 使用燃料对环境的影响
