8.2第2课时稀酸的化学性质同步作业—2020-2021学年九年级化学科粤版(2012)下册(含解析)
文档属性
| 名称 | 8.2第2课时稀酸的化学性质同步作业—2020-2021学年九年级化学科粤版(2012)下册(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 160.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-30 10:55:31 | ||
图片预览


文档简介
第2课时 稀酸的化学性质
知识点 稀酸的化学性质
1.下列物质不能与稀硫酸反应的是 ( )
A.Mg B.Ba(NO3)2 C.Fe2O3 D.FeSO4
2.下列实验不能达到实验目的的是 ( )
A.用浓硫酸干燥氧气 B.用稀硫酸除去铁粉中的铜粉
C.用适量的盐酸除铁锈 D.用稀盐酸清洗试剂瓶壁上的碳酸钙
3.[2020·遵义] 醋酸(CH3COOH)是食醋的成分之一,其水溶液中存在H+和CH3COO-,与盐酸化学性质相似。下列说法正确的是 ( )
A.醋酸属于氧化物 B.醋酸不能用于除铁锈
C.醋酸能与碳酸钠反应产生二氧化碳 D.能将醋酸放入铁质容器中存放
4.[2020·广州] 下列关于硫酸的认识,正确的是 ( )
A.组成:硫酸溶液中H+和S的数目相同
B.性质:能与CO2、SO3等非金属氧化物反应
C.用途:可用于实验室制备CuSO4
D.生产:含硫酸的废水用NaCl处理后直接排放
5.向滴有石蕊溶液的稀盐酸中加入下列物质,恰好完全反应后,溶液颜色没有发生变化的是 ( )
A.碳酸钠溶液 B.硝酸银溶液
C.氧化铜 D.铁
6.下列化学变化会使溶液总质量增加的是 ( )
A.铁和硫酸铜溶液反应 B.氧化铁和稀盐酸反应
C.碳酸钠溶液和稀盐酸反应 D.氯化钡溶液与稀硫酸反应
7.在一定质量表面被氧化的镁条中,慢慢加入一定浓度的盐酸,下列对反应中有关量的变化情况描述正确的是 ( )
8.某同学将一定量的稀硫酸与氯化钡溶液混合,要想检验反应后硫酸是否过量,可选用的试剂是 ( )
A.Ba(NO3)2溶液 B.锌粒
C.Na2CO3溶液 D.酚酞溶液
9.[2021·深圳改编] 小明在探究稀硫酸性质时,下列说法正确的是 ( )
A.稀硫酸与紫色石蕊溶液反应后,溶液变蓝
B.若稀硫酸能与X反应制取H2,则X是Cu
C.稀硫酸与金属氧化物反应,有盐和水生成
D.若稀硫酸与Y发生反应生成白色沉淀,则Y一定是BaCl2
10.[2021·南充改编] 归纳推理是化学学习中常用的思维方法。下列推理正确的是 ( )
A.酸溶液呈酸性,酸性溶液一定是酸溶液
B.单质是由一种元素组成的物质,由一种元素组成的物质一定是单质
C.稀盐酸能用来除铁锈,稀硫酸也能用来除铁锈
D.碳酸盐与盐酸反应放出气体,与盐酸反应放出气体的物质一定是碳酸盐
11.小明、小芳两名同学为探究盐酸的化学性质,做了如图所示实验。
(1)能产生气泡的是 (填字母)。
(2)试管A中恰好反应后,溶液中的阳离子是
(填符号),该反应的基本类型是 。
(3)试管B中发生反应的化学方程式为 ,现象是 。
(4)通过观察试管C中产生的现象得出的结论是 。
(5)分别写出试管D、E中发生反应的化学方程式: 、
。
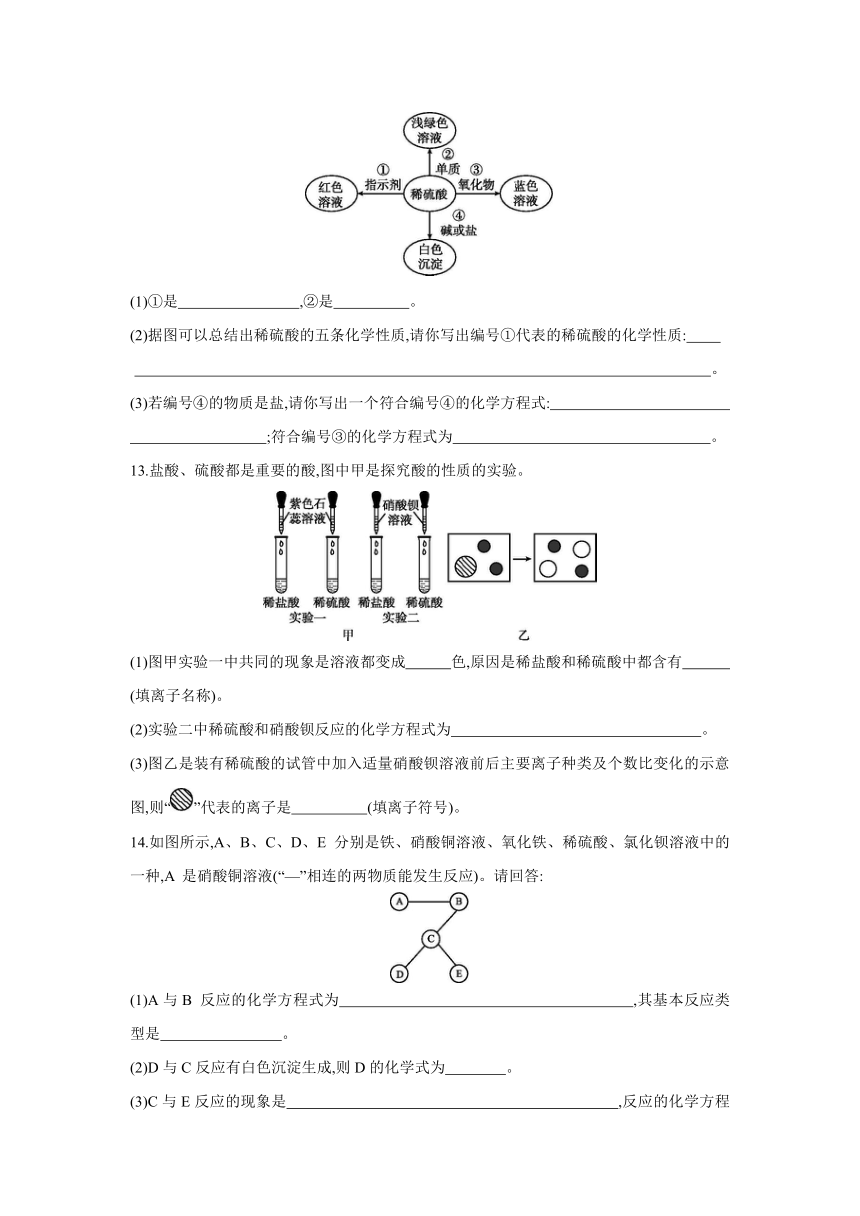
12.化学使世界变得绚丽多彩。如图是某些物质之间发生化学反应的颜色变化。
(1)①是 ,②是 。
(2)据图可以总结出稀硫酸的五条化学性质,请你写出编号①代表的稀硫酸的化学性质:
。
(3)若编号④的物质是盐,请你写出一个符合编号④的化学方程式:
;符合编号③的化学方程式为 。
13.盐酸、硫酸都是重要的酸,图中甲是探究酸的性质的实验。
(1)图甲实验一中共同的现象是溶液都变成 色,原因是稀盐酸和稀硫酸中都含有
(填离子名称)。
(2)实验二中稀硫酸和硝酸钡反应的化学方程式为 。
(3)图乙是装有稀硫酸的试管中加入适量硝酸钡溶液前后主要离子种类及个数比变化的示意图,则“”代表的离子是 (填离子符号)。
14.如图所示,A、B、C、D、E 分别是铁、硝酸铜溶液、氧化铁、稀硫酸、氯化钡溶液中的一种,A 是硝酸铜溶液(“—”相连的两物质能发生反应)。请回答:
(1)A与B 反应的化学方程式为 ,其基本反应类型是 。
(2)D与C反应有白色沉淀生成,则D的化学式为 。
(3)C与E反应的现象是 ,反应的化学方程式为 。
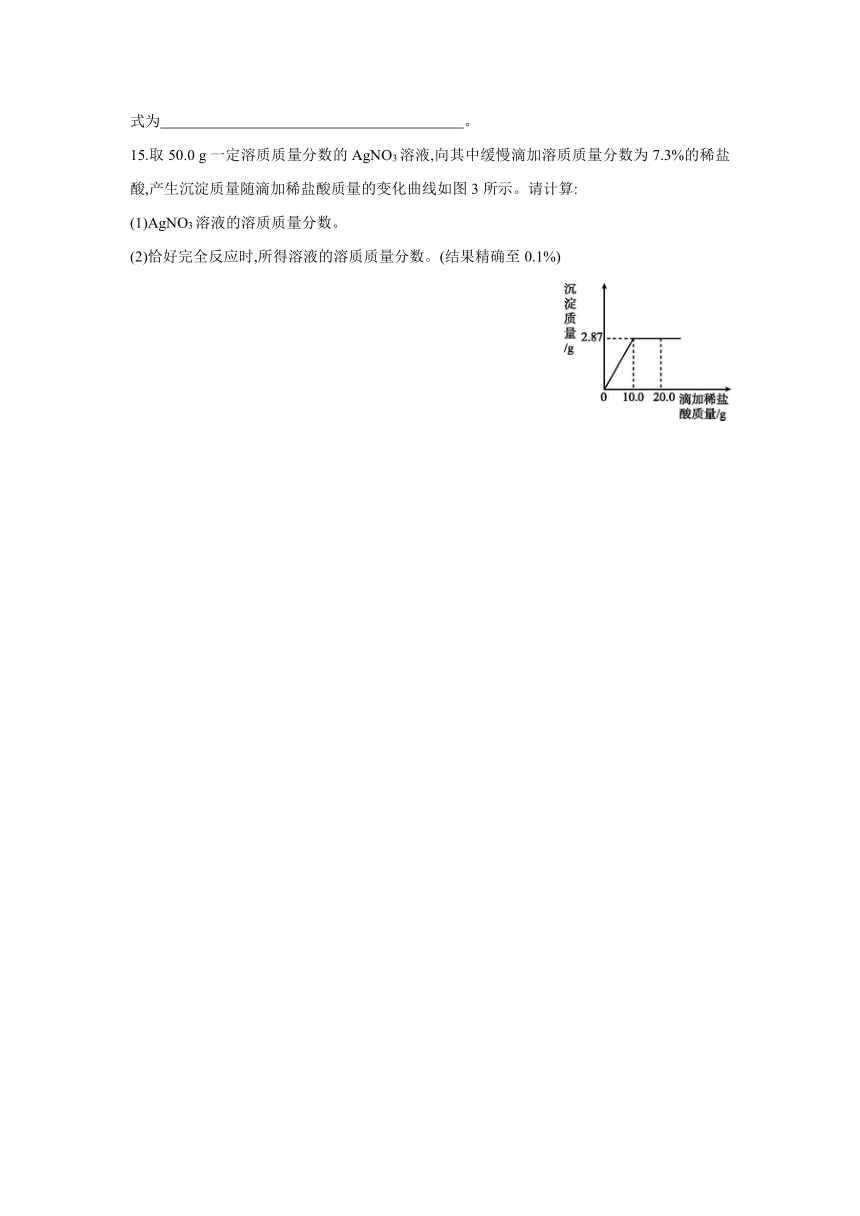
15.取50.0 g一定溶质质量分数的AgNO3溶液,向其中缓慢滴加溶质质量分数为7.3%的稀盐酸,产生沉淀质量随滴加稀盐酸质量的变化曲线如图3所示。请计算:
(1)AgNO3溶液的溶质质量分数。
(2)恰好完全反应时,所得溶液的溶质质量分数。(结果精确至0.1%)
第2课时 稀酸的化学性质
1.D [解析] 镁能与稀硫酸反应生成硫酸镁和氢气;硝酸钡能与稀硫酸反应生成硫酸钡沉淀和硝酸;氧化铁能与稀硫酸反应生成硫酸铁和水;硫酸亚铁和稀硫酸不能反应。
2.(1)AD
(2)Fe2+ 置换反应
(3)Fe2O3+6HCl2FeCl3+3H2O 红棕色固体消失,溶液由无色变为黄色
(4)酸不能使酚酞变色
(5)Na2CO3+2HCl2NaCl+H2O+CO2↑ HCl+AgNO3AgCl↓+HNO3
3.(1)紫色石蕊溶液 铁(或Fe)
(2)稀硫酸可使紫色石蕊溶液变红(或稀硫酸显酸性)
(3)H2SO4+BaCl2BaSO4↓+2HCl(合理即可) CuO+H2SO4CuSO4+H2O
4.B [解析] 稀硫酸加入铁粉和铜粉的混合物中,除去的是铁粉。
5.C [解析] 醋酸由三种元素组成,不属于氧化物;醋酸能和氧化铁反应,可用于除铁锈;醋酸能与铁反应,不能将醋酸放入铁质容器中存放。
6.C [解析] 硫酸解离出H+的数目是S数目的2倍,水几乎不解离,溶液中H+的数目大于S;酸可与金属氧化物反应生成盐和水,不与CO2、SO3等非金属氧化物反应;硫酸和氧化铜反应生成硫酸铜和水,可用于制备CuSO4;硫酸与NaCl不反应,不能用氯化钠除去稀硫酸。
7.B [解析] 硝酸银溶液与稀盐酸反应生成氯化银和硝酸,溶液呈酸性,溶液的颜色仍为红色。
8.B [解析] 铁和硫酸铜溶液反应生成铜和硫酸亚铁,溶液总质量减少;氧化铁和稀盐酸反应生成氯化铁和水,溶液总质量增加;碳酸钠溶液和稀盐酸反应生成水、二氧化碳和氯化钠,有气体逸出,溶液总质量减少;氯化钡溶液和稀硫酸反应生成硫酸钡沉淀和盐酸,有沉淀生成,溶液总质量减少。
9.A [解析] 氧化镁和镁均能与盐酸反应生成氯化镁,随着盐酸质量的增加,氯化镁的质量逐渐增加,氧化镁和镁被完全消耗后,氯化镁的质量不再增加;氧化镁覆盖在镁的外面,盐酸先和氧化镁反应,因此开始时不产生氢气;随着反应的进行,溶液质量增加,当完全反应后,随着盐酸的加入,溶液质量仍然增加。
10.A [解析] 将一定量的稀硫酸与氯化钡溶液混合,稀硫酸能与氯化钡溶液反应生成硫酸钡沉淀和盐酸,要想检验反应后硫酸是否过量,应检验溶液中是否含有硫酸根离子。硝酸钡溶液能与硫酸反应生成不溶于酸的硫酸钡白色沉淀,可检验反应后硫酸是否过量;锌粒与稀硫酸、稀盐酸均能反应生成氢气,不能检验反应后硫酸是否过量;碳酸钠溶液与稀硫酸、稀盐酸均能反应生成二氧化碳气体,不能检验反应后硫酸是否过量;酚酞溶液遇稀硫酸、稀盐酸均不变色,不能检验反应后硫酸是否过量。
11.(1)红 氢离子
(2)H2SO4+Ba(NO3)2BaSO4↓+2HNO3
(3)S
[解析] (1)实验一中稀盐酸和稀硫酸都能使紫色石蕊溶液变红,这是因为稀盐酸和稀硫酸中都含有氢离子。(2)稀硫酸和硝酸钡溶液反应生成硫酸钡沉淀和硝酸,反应的化学方程式为H2SO4+Ba(NO3)2BaSO4↓+2HNO3。(3)根据硫酸的化学式可知,反应前溶液中离子为氢离子和硫酸根离子,加入硝酸钡溶液后,反应生成硫酸钡沉淀和硝酸,反应后溶液中的离子变为氢离子和硝酸根离子,故“”代表的离子是S。
12.(1)Fe+Cu(NO3)2Cu+Fe(NO3)2 置换反应
(2)BaCl2
(3)红棕色固体消失,溶液由无色变为黄色 Fe2O3+3H2SO4Fe2(SO4)3+3H2O
13.解:(1)设50.0 g待测溶液中AgNO3的质量为x,生成HNO3的质量为y。
AgNO3+HClAgCl↓+HNO3
170 143.5 63
x 2.87 g y
= x=3.4 g
= y=1.26 g
AgNO3溶液的溶质质量分数为×100%=6.8%。
(2)恰好完全反应时,溶液的质量为50.0 g+10.0 g-2.87 g=57.13 g。
所得溶液的溶质质量分数为×100%=2.2%。
答:(1)AgNO3溶液的溶质质量分数为6.8%;
(2)恰好完全反应时,所得溶液的溶质质量分数为2.2%。
14.C [解析] 紫色石蕊溶液遇酸性溶液变红;若稀硫酸能与X反应制取H2,则X不可能是Cu,Cu不与稀硫酸反应;若稀硫酸与Y反应生成白色沉淀,则Y可能是在水中能解离出Ba2+的盐或碱,所以也可能是硝酸钡。
15.C [解析] 酸溶液一定呈酸性,但酸性溶液不一定是酸溶液,一些盐溶液也呈酸性;单质是由一种元素组成的物质,但由一种元素组成的物质不一定是单质,也可能是混合物;碳酸盐与盐酸反应放出气体,但与盐酸反应放出气体的物质不一定是碳酸盐,也可能是活泼金属等。
知识点 稀酸的化学性质
1.下列物质不能与稀硫酸反应的是 ( )
A.Mg B.Ba(NO3)2 C.Fe2O3 D.FeSO4
2.下列实验不能达到实验目的的是 ( )
A.用浓硫酸干燥氧气 B.用稀硫酸除去铁粉中的铜粉
C.用适量的盐酸除铁锈 D.用稀盐酸清洗试剂瓶壁上的碳酸钙
3.[2020·遵义] 醋酸(CH3COOH)是食醋的成分之一,其水溶液中存在H+和CH3COO-,与盐酸化学性质相似。下列说法正确的是 ( )
A.醋酸属于氧化物 B.醋酸不能用于除铁锈
C.醋酸能与碳酸钠反应产生二氧化碳 D.能将醋酸放入铁质容器中存放
4.[2020·广州] 下列关于硫酸的认识,正确的是 ( )
A.组成:硫酸溶液中H+和S的数目相同
B.性质:能与CO2、SO3等非金属氧化物反应
C.用途:可用于实验室制备CuSO4
D.生产:含硫酸的废水用NaCl处理后直接排放
5.向滴有石蕊溶液的稀盐酸中加入下列物质,恰好完全反应后,溶液颜色没有发生变化的是 ( )
A.碳酸钠溶液 B.硝酸银溶液
C.氧化铜 D.铁
6.下列化学变化会使溶液总质量增加的是 ( )
A.铁和硫酸铜溶液反应 B.氧化铁和稀盐酸反应
C.碳酸钠溶液和稀盐酸反应 D.氯化钡溶液与稀硫酸反应
7.在一定质量表面被氧化的镁条中,慢慢加入一定浓度的盐酸,下列对反应中有关量的变化情况描述正确的是 ( )
8.某同学将一定量的稀硫酸与氯化钡溶液混合,要想检验反应后硫酸是否过量,可选用的试剂是 ( )
A.Ba(NO3)2溶液 B.锌粒
C.Na2CO3溶液 D.酚酞溶液
9.[2021·深圳改编] 小明在探究稀硫酸性质时,下列说法正确的是 ( )
A.稀硫酸与紫色石蕊溶液反应后,溶液变蓝
B.若稀硫酸能与X反应制取H2,则X是Cu
C.稀硫酸与金属氧化物反应,有盐和水生成
D.若稀硫酸与Y发生反应生成白色沉淀,则Y一定是BaCl2
10.[2021·南充改编] 归纳推理是化学学习中常用的思维方法。下列推理正确的是 ( )
A.酸溶液呈酸性,酸性溶液一定是酸溶液
B.单质是由一种元素组成的物质,由一种元素组成的物质一定是单质
C.稀盐酸能用来除铁锈,稀硫酸也能用来除铁锈
D.碳酸盐与盐酸反应放出气体,与盐酸反应放出气体的物质一定是碳酸盐
11.小明、小芳两名同学为探究盐酸的化学性质,做了如图所示实验。
(1)能产生气泡的是 (填字母)。
(2)试管A中恰好反应后,溶液中的阳离子是
(填符号),该反应的基本类型是 。
(3)试管B中发生反应的化学方程式为 ,现象是 。
(4)通过观察试管C中产生的现象得出的结论是 。
(5)分别写出试管D、E中发生反应的化学方程式: 、
。
12.化学使世界变得绚丽多彩。如图是某些物质之间发生化学反应的颜色变化。
(1)①是 ,②是 。
(2)据图可以总结出稀硫酸的五条化学性质,请你写出编号①代表的稀硫酸的化学性质:
。
(3)若编号④的物质是盐,请你写出一个符合编号④的化学方程式:
;符合编号③的化学方程式为 。
13.盐酸、硫酸都是重要的酸,图中甲是探究酸的性质的实验。
(1)图甲实验一中共同的现象是溶液都变成 色,原因是稀盐酸和稀硫酸中都含有
(填离子名称)。
(2)实验二中稀硫酸和硝酸钡反应的化学方程式为 。
(3)图乙是装有稀硫酸的试管中加入适量硝酸钡溶液前后主要离子种类及个数比变化的示意图,则“”代表的离子是 (填离子符号)。
14.如图所示,A、B、C、D、E 分别是铁、硝酸铜溶液、氧化铁、稀硫酸、氯化钡溶液中的一种,A 是硝酸铜溶液(“—”相连的两物质能发生反应)。请回答:
(1)A与B 反应的化学方程式为 ,其基本反应类型是 。
(2)D与C反应有白色沉淀生成,则D的化学式为 。
(3)C与E反应的现象是 ,反应的化学方程式为 。
15.取50.0 g一定溶质质量分数的AgNO3溶液,向其中缓慢滴加溶质质量分数为7.3%的稀盐酸,产生沉淀质量随滴加稀盐酸质量的变化曲线如图3所示。请计算:
(1)AgNO3溶液的溶质质量分数。
(2)恰好完全反应时,所得溶液的溶质质量分数。(结果精确至0.1%)
第2课时 稀酸的化学性质
1.D [解析] 镁能与稀硫酸反应生成硫酸镁和氢气;硝酸钡能与稀硫酸反应生成硫酸钡沉淀和硝酸;氧化铁能与稀硫酸反应生成硫酸铁和水;硫酸亚铁和稀硫酸不能反应。
2.(1)AD
(2)Fe2+ 置换反应
(3)Fe2O3+6HCl2FeCl3+3H2O 红棕色固体消失,溶液由无色变为黄色
(4)酸不能使酚酞变色
(5)Na2CO3+2HCl2NaCl+H2O+CO2↑ HCl+AgNO3AgCl↓+HNO3
3.(1)紫色石蕊溶液 铁(或Fe)
(2)稀硫酸可使紫色石蕊溶液变红(或稀硫酸显酸性)
(3)H2SO4+BaCl2BaSO4↓+2HCl(合理即可) CuO+H2SO4CuSO4+H2O
4.B [解析] 稀硫酸加入铁粉和铜粉的混合物中,除去的是铁粉。
5.C [解析] 醋酸由三种元素组成,不属于氧化物;醋酸能和氧化铁反应,可用于除铁锈;醋酸能与铁反应,不能将醋酸放入铁质容器中存放。
6.C [解析] 硫酸解离出H+的数目是S数目的2倍,水几乎不解离,溶液中H+的数目大于S;酸可与金属氧化物反应生成盐和水,不与CO2、SO3等非金属氧化物反应;硫酸和氧化铜反应生成硫酸铜和水,可用于制备CuSO4;硫酸与NaCl不反应,不能用氯化钠除去稀硫酸。
7.B [解析] 硝酸银溶液与稀盐酸反应生成氯化银和硝酸,溶液呈酸性,溶液的颜色仍为红色。
8.B [解析] 铁和硫酸铜溶液反应生成铜和硫酸亚铁,溶液总质量减少;氧化铁和稀盐酸反应生成氯化铁和水,溶液总质量增加;碳酸钠溶液和稀盐酸反应生成水、二氧化碳和氯化钠,有气体逸出,溶液总质量减少;氯化钡溶液和稀硫酸反应生成硫酸钡沉淀和盐酸,有沉淀生成,溶液总质量减少。
9.A [解析] 氧化镁和镁均能与盐酸反应生成氯化镁,随着盐酸质量的增加,氯化镁的质量逐渐增加,氧化镁和镁被完全消耗后,氯化镁的质量不再增加;氧化镁覆盖在镁的外面,盐酸先和氧化镁反应,因此开始时不产生氢气;随着反应的进行,溶液质量增加,当完全反应后,随着盐酸的加入,溶液质量仍然增加。
10.A [解析] 将一定量的稀硫酸与氯化钡溶液混合,稀硫酸能与氯化钡溶液反应生成硫酸钡沉淀和盐酸,要想检验反应后硫酸是否过量,应检验溶液中是否含有硫酸根离子。硝酸钡溶液能与硫酸反应生成不溶于酸的硫酸钡白色沉淀,可检验反应后硫酸是否过量;锌粒与稀硫酸、稀盐酸均能反应生成氢气,不能检验反应后硫酸是否过量;碳酸钠溶液与稀硫酸、稀盐酸均能反应生成二氧化碳气体,不能检验反应后硫酸是否过量;酚酞溶液遇稀硫酸、稀盐酸均不变色,不能检验反应后硫酸是否过量。
11.(1)红 氢离子
(2)H2SO4+Ba(NO3)2BaSO4↓+2HNO3
(3)S
[解析] (1)实验一中稀盐酸和稀硫酸都能使紫色石蕊溶液变红,这是因为稀盐酸和稀硫酸中都含有氢离子。(2)稀硫酸和硝酸钡溶液反应生成硫酸钡沉淀和硝酸,反应的化学方程式为H2SO4+Ba(NO3)2BaSO4↓+2HNO3。(3)根据硫酸的化学式可知,反应前溶液中离子为氢离子和硫酸根离子,加入硝酸钡溶液后,反应生成硫酸钡沉淀和硝酸,反应后溶液中的离子变为氢离子和硝酸根离子,故“”代表的离子是S。
12.(1)Fe+Cu(NO3)2Cu+Fe(NO3)2 置换反应
(2)BaCl2
(3)红棕色固体消失,溶液由无色变为黄色 Fe2O3+3H2SO4Fe2(SO4)3+3H2O
13.解:(1)设50.0 g待测溶液中AgNO3的质量为x,生成HNO3的质量为y。
AgNO3+HClAgCl↓+HNO3
170 143.5 63
x 2.87 g y
= x=3.4 g
= y=1.26 g
AgNO3溶液的溶质质量分数为×100%=6.8%。
(2)恰好完全反应时,溶液的质量为50.0 g+10.0 g-2.87 g=57.13 g。
所得溶液的溶质质量分数为×100%=2.2%。
答:(1)AgNO3溶液的溶质质量分数为6.8%;
(2)恰好完全反应时,所得溶液的溶质质量分数为2.2%。
14.C [解析] 紫色石蕊溶液遇酸性溶液变红;若稀硫酸能与X反应制取H2,则X不可能是Cu,Cu不与稀硫酸反应;若稀硫酸与Y反应生成白色沉淀,则Y可能是在水中能解离出Ba2+的盐或碱,所以也可能是硝酸钡。
15.C [解析] 酸溶液一定呈酸性,但酸性溶液不一定是酸溶液,一些盐溶液也呈酸性;单质是由一种元素组成的物质,但由一种元素组成的物质不一定是单质,也可能是混合物;碳酸盐与盐酸反应放出气体,但与盐酸反应放出气体的物质不一定是碳酸盐,也可能是活泼金属等。
