物质的分类课件
图片预览






文档简介
(共20张PPT)
第二章 元素与物质世界
第一节 元素与物质分类
一、元素与物质的关系
二、物质的分类
三、胶体
*
*
(1)110多种元素是如何构成几千万种物
质的?
(2)为了更好地研究物质的性质和用途,
应怎样对物质进行分类? 用什么样
的标准分类?
(3)各类物质之间具有怎样的关系?
*
*
单质:由同种元素组成的纯净物。
游离态:元素以单质的形式存在的状态。
化合物:由两种或两种以上的元素组成的纯净物。
化合态:元素以化合物的形式存在的状态
完成P31 交流研讨
*
*
以上讨论对你认识元素与物质的关系有什么启发?
⑴元素是物质的基本组成成分,物质都是由元素组成的;
⑵每一种元素可以自身组成物质—单质;
⑶不同种元素相互之间按照一定的规律
可以组成纯净物—化合物。
⑷相同的元素可以组成不同的化合物
问题探究二
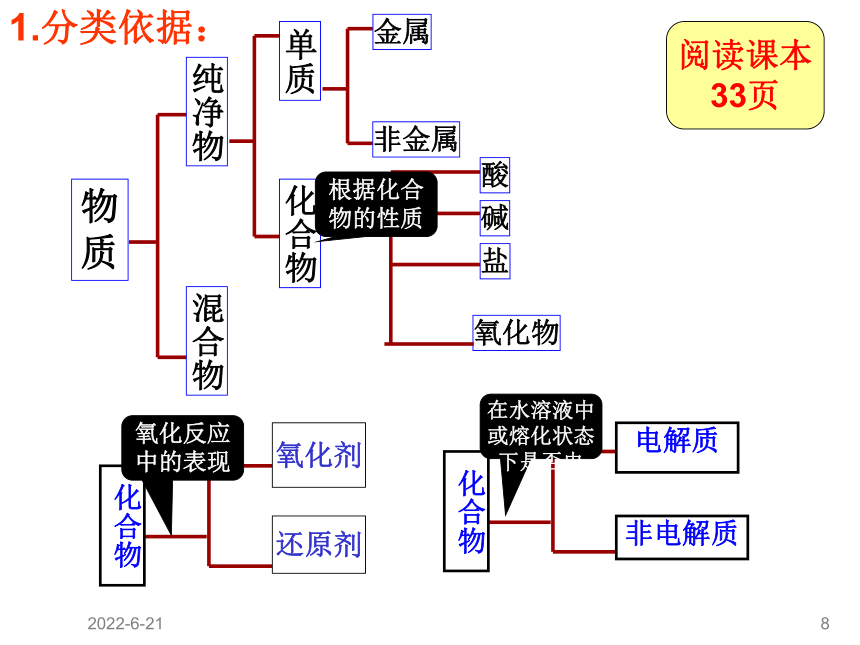
物质的分类
*
*
物
质
纯净物
混合物
单质
化合物
金属
非金属
氧化物
酸
碱
盐
根据化合物的性质
化合物
氧化反应中的表现
化合物
在水溶液中或熔化状态下是否电
氧化剂
还原剂
电解质
非电解质
1.分类依据:
阅读课本
33页
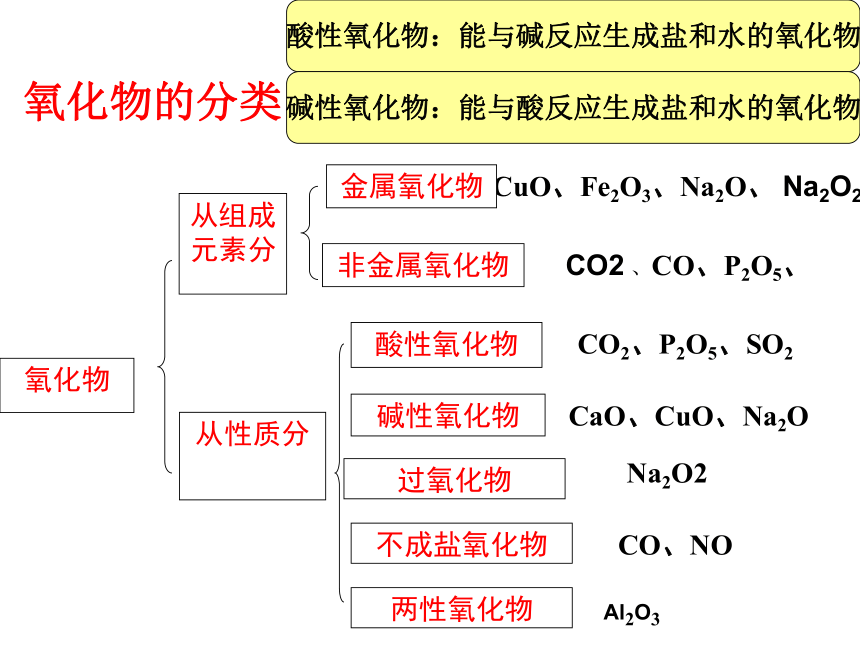
氧化物
酸性氧化物
碱性氧化物
两性氧化物
CuO、Fe2O3、Na2O、 Na2O2
CO2 、CO、P2O5、
CO2、P2O5、SO2
CaO、CuO、Na2O
CO、NO
从组成元素分
非金属氧化物
金属氧化物
从性质分
氧化物的分类
不成盐氧化物
Al2O3
过氧化物
Na2O2
酸性氧化物:能与碱反应生成盐和水的氧化物
碱性氧化物:能与酸反应生成盐和水的氧化物
酸的分类
按是否含氧元素:
酸
按含氢原子数目:
一元酸HCl、 HNO3
含氧酸H2SO4、HNO3、H3PO4(磷酸)
无氧酸HCl、H2S(氢硫酸)
二元酸H2SO4 、H2CO3、 H2S
三元酸H3PO4
按酸性强弱:
强酸、弱酸
*
*
练习:今有下列三种物质,每组中都有一种物质跟其他三 种属于不同的种类。将此种物质和分类依据
三组物质分别为: (1)O2、F2、S、N2;
(2)Fe、Na、Al、Si;
(3)NO、CO2、SO2、P2O5。
组 别 被选出的物质 分类依据
第(1)组
第(2)组
第(3)组
▲
▲
▲
对物质分类后,可以认识某类物质的一般性质,并据此对该类别的具体物质的性质进行预测
2、根据物质类别研究物质性质
【活动与探究4】
方法
导引
研究单质、氧化物、酸、碱和盐之间的相互
关系,首先选定一种物质,预测它可能与哪些
类别的物质发生反应;然后推知该类物质的性质。
类别:指示剂
类别:金属单质
类别:碱性氧化物
类别:碱
类别:盐
石蕊试液
金属铁
AgNO3
类别:酸
稀盐酸
金属
酸
碱性氧
化物
盐
指示剂
碱
AgNO3
盐酸
Fe
--盐+水
--盐+酸
--盐+水
NaOH
Na2O
反应关系
氢氧化钠
反应关系
类别:指示剂
类别:非金属单质
类别:酸性氧化物
类别:酸
类别:盐
类别:碱
酚酞试液
Cl2
CO2
H2SO4
CuSO4
氢氧化钠
非金属
碱
盐
酸性
氧化物
指示剂
酸
盐酸
CuSO4
NaOH
CO2
Cl2
--盐+水
--盐+碱
--盐+水
活动·探究
盐
盐
碱
金属
酸
Ca(OH)2
Fe
AgNO3
盐酸
NaCl
活动·探究
碱性
氧化物
酸性
氧化物
Na2O
CO2
酸
盐酸
--盐+水
酸性
氧化物
CO2
--盐
水
--碱
碱
Ca(OH)2
--盐+水
碱性
氧化物
CaO
--盐
水
--酸
碱性氧化物 酸性氧化物
碱 酸
盐 盐
归纳总结:将下图中可能发生反应的物质类别用线连起来。
【应用练习】已知K2O是碱性氧化物,请你预测K2O能否与CO2、HCl反应,若能写出化学方程式。
*
*
1、每组物中都有一种物质与其他物质在分类上不同,试分析每组物质中的组成规律,将这种不同于其他物质的物质找出来。
A.NaCl KCl NaClO MgCl2
B.HClO3 KClO3 Cl2 NaClO3
C.H3PO4 H4SiO4 HCl H2SO4
D.铜 金 铂 钙
只有NaClO不是盐酸盐
只有Cl2中化合价为0价 其余为+5价
只有HCl不是含氧酸
只有Ca是活泼金属
《基础训练》P29 基础达标
*
*
第二章 元素与物质世界
第一节 元素与物质分类
一、元素与物质的关系
二、物质的分类
三、胶体
*
*
(1)110多种元素是如何构成几千万种物
质的?
(2)为了更好地研究物质的性质和用途,
应怎样对物质进行分类? 用什么样
的标准分类?
(3)各类物质之间具有怎样的关系?
*
*
单质:由同种元素组成的纯净物。
游离态:元素以单质的形式存在的状态。
化合物:由两种或两种以上的元素组成的纯净物。
化合态:元素以化合物的形式存在的状态
完成P31 交流研讨
*
*
以上讨论对你认识元素与物质的关系有什么启发?
⑴元素是物质的基本组成成分,物质都是由元素组成的;
⑵每一种元素可以自身组成物质—单质;
⑶不同种元素相互之间按照一定的规律
可以组成纯净物—化合物。
⑷相同的元素可以组成不同的化合物
问题探究二
物质的分类
*
*
物
质
纯净物
混合物
单质
化合物
金属
非金属
氧化物
酸
碱
盐
根据化合物的性质
化合物
氧化反应中的表现
化合物
在水溶液中或熔化状态下是否电
氧化剂
还原剂
电解质
非电解质
1.分类依据:
阅读课本
33页
氧化物
酸性氧化物
碱性氧化物
两性氧化物
CuO、Fe2O3、Na2O、 Na2O2
CO2 、CO、P2O5、
CO2、P2O5、SO2
CaO、CuO、Na2O
CO、NO
从组成元素分
非金属氧化物
金属氧化物
从性质分
氧化物的分类
不成盐氧化物
Al2O3
过氧化物
Na2O2
酸性氧化物:能与碱反应生成盐和水的氧化物
碱性氧化物:能与酸反应生成盐和水的氧化物
酸的分类
按是否含氧元素:
酸
按含氢原子数目:
一元酸HCl、 HNO3
含氧酸H2SO4、HNO3、H3PO4(磷酸)
无氧酸HCl、H2S(氢硫酸)
二元酸H2SO4 、H2CO3、 H2S
三元酸H3PO4
按酸性强弱:
强酸、弱酸
*
*
练习:今有下列三种物质,每组中都有一种物质跟其他三 种属于不同的种类。将此种物质和分类依据
三组物质分别为: (1)O2、F2、S、N2;
(2)Fe、Na、Al、Si;
(3)NO、CO2、SO2、P2O5。
组 别 被选出的物质 分类依据
第(1)组
第(2)组
第(3)组
▲
▲
▲
对物质分类后,可以认识某类物质的一般性质,并据此对该类别的具体物质的性质进行预测
2、根据物质类别研究物质性质
【活动与探究4】
方法
导引
研究单质、氧化物、酸、碱和盐之间的相互
关系,首先选定一种物质,预测它可能与哪些
类别的物质发生反应;然后推知该类物质的性质。
类别:指示剂
类别:金属单质
类别:碱性氧化物
类别:碱
类别:盐
石蕊试液
金属铁
AgNO3
类别:酸
稀盐酸
金属
酸
碱性氧
化物
盐
指示剂
碱
AgNO3
盐酸
Fe
--盐+水
--盐+酸
--盐+水
NaOH
Na2O
反应关系
氢氧化钠
反应关系
类别:指示剂
类别:非金属单质
类别:酸性氧化物
类别:酸
类别:盐
类别:碱
酚酞试液
Cl2
CO2
H2SO4
CuSO4
氢氧化钠
非金属
碱
盐
酸性
氧化物
指示剂
酸
盐酸
CuSO4
NaOH
CO2
Cl2
--盐+水
--盐+碱
--盐+水
活动·探究
盐
盐
碱
金属
酸
Ca(OH)2
Fe
AgNO3
盐酸
NaCl
活动·探究
碱性
氧化物
酸性
氧化物
Na2O
CO2
酸
盐酸
--盐+水
酸性
氧化物
CO2
--盐
水
--碱
碱
Ca(OH)2
--盐+水
碱性
氧化物
CaO
--盐
水
--酸
碱性氧化物 酸性氧化物
碱 酸
盐 盐
归纳总结:将下图中可能发生反应的物质类别用线连起来。
【应用练习】已知K2O是碱性氧化物,请你预测K2O能否与CO2、HCl反应,若能写出化学方程式。
*
*
1、每组物中都有一种物质与其他物质在分类上不同,试分析每组物质中的组成规律,将这种不同于其他物质的物质找出来。
A.NaCl KCl NaClO MgCl2
B.HClO3 KClO3 Cl2 NaClO3
C.H3PO4 H4SiO4 HCl H2SO4
D.铜 金 铂 钙
只有NaClO不是盐酸盐
只有Cl2中化合价为0价 其余为+5价
只有HCl不是含氧酸
只有Ca是活泼金属
《基础训练》P29 基础达标
*
*
