2021-2022学年高中化学苏教版(2019)必修第一册专题三 第三单元海洋化学资源的综合利用 练习(word版含解析)
文档属性
| 名称 | 2021-2022学年高中化学苏教版(2019)必修第一册专题三 第三单元海洋化学资源的综合利用 练习(word版含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 157.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-01 22:05:05 | ||
图片预览



文档简介
专题三 第三单元海洋化学资源的综合利用练习
一、单选题
我国历来十分重视海水资源的综合利用,下列有关海水综合利用的说法正确的是
A. 利用潮汐发电是将化学能转化为电能
B. 海水蒸发制海盐的过程中发生了化学变化
C. 海水中含有溴元素,只需经过物理变化就可以得到溴单质
D. 从海水中可以得到,电解熔融可制备
许多国家十分重视海水资源的综合利用,不需要化学变化就能从海水中获得的物质是
A. 、、 B. 粗盐、淡水 C. 、、 D. 、
下列说法正确的是
A. 氧化镁常用于制造信号弹 B. 碘化银是胶卷中必不可少的成分
C. 溴化银可用于人工降雨 D. 二氧化碳不能作金属镁着火的灭火剂
海洋资源的开发利用具有广阔的前景,下列以海洋资源为基础的化工生产过程中,未涉及氧化还原反应的是
A. 海水提镁 B. 海水晒盐 C. 海水提溴 D. 海带提碘
下列叙述中正确的是
A. 液溴易挥发,在存放液溴的试剂瓶中应加水封
B. 能使润湿的淀粉试纸变成蓝色的物质一定是
C. 某溶液加入,层显紫色,证明原溶液中存在
D. 某溶液加入溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有
辛勤劳动才能获得海洋的馈赠。下列离子方程式错误的是
A. 氯碱工业:
B. 海带提碘中的氧化:
C. 海水提镁中用石灰乳沉镁:
D. 海水提溴中的吸收:
海水综合利用要符合可持续发展的原则,其联合工业体系部分如图所示,下列说法错误的是
A. 中可采用蒸馏法 B. 制镁过程中用到的沉淀剂是石灰乳
C. 中提溴涉及到复分解反应 D. 的产品可生产盐酸、漂白液等
海水中蕴含丰富的资源,对海水进行综合利用,可制备一系列物质见下图,下列说法正确的是
A. 步骤中,除去粗盐中的、、等杂质,加入试剂及相关操作顺序可以是:溶液溶液溶液盐酸过滤
B. 步骤中反应利用的原理是:相同条件下的溶解度比小
C. 步骤在工业上通过向母液中加固体实现
D. 步骤利用了的挥发性、还原性,该步的作用是富集
向和的混合溶液中滴加足量的溴水,待反应完全后,将溶液蒸干、灼烧,最后残留的固体物质为
A. 和 B. 、和 C. D. 和
二、不定项选择题
关于从海水中提镁的说法正确的是
A. 工业上海水提镁用到的沉淀剂为
B. 溶液中获得无水需在氯化氢的气流中加热
C. 电解氯化镁溶液制镁可得到副产品氯气
D. 粗盐中因含有、易潮解
下列检验方法与结论相符的一组是
选项 检验方法 结论
A. 一种未知溶液滴加溶液,有白色沉淀生成 未知溶液中一定含有
B. 某溶液焰色反应的火焰呈黄色 该溶液中只含钠离子,不含钾离子
C. 一种未知溶液滴加溶液,加热后产生能使湿润的蓝色石蕊试纸变红的气体 未知溶液中一定含有
D. 某溶液先加入淀粉溶液,无变化,再滴入少量溶液后,溶液变蓝 说明原溶液中有
已知:某溶液中可能含有、、、、、、,且所有离子物质的量浓度相等.向该无色溶液中滴加少量溴水,溶液仍呈无色.下列关于该溶液的判断正确的是
A. 肯定不含 B. 肯定不含
C. 肯定含有 D. 肯定含有
氯酸是强酸,在酸性介质中是强氧化剂,可与碘单质发生反应,若碘单质过量,还会发生反应下列说法错误的是
A. 化学方程式表明的还原性强于
B. 是元素的最高价氧化物对应的水化物
C. 反应中,每生成Cl2,转移电子
D. 在烧碱溶液中发生反应,生成物为和
某食盐水含有可溶性的、、等杂质,通过如下几个实验步骤,可制得纯净的食盐水:加入稍过量的溶液;加入稍过量的溶液;加入稍过量的溶液;滴入稀盐酸至无气泡产生;过滤正确的操作顺序是
A. B. C. D.
关于从海带中提取碘单质的实验说法不正确的是
A. 酒精润湿海带的目的是为了使海带充分灼烧
B. 在蒸发皿中灼烧海带,将灰烬转移到烧杯中加蒸馏水煮沸、搅拌、过滤,取滤液
C. 用硫酸酸化的氧化为单质碘,并用萃取
D. 海带中碘元素的存在形式为
三、填空题
写出下列反应的离子方程式。实验室用锌与稀硫酸制取氢气____________________________;
实验室用石灰石与稀盐酸制取二氧化碳气体____________________。
氯气溶于水____________________________________
苏打溶液与盐酸混合______________________________
氯气通入到溴化钠溶液中___________________________
碘化钠溶液与硝酸银溶液混合_______________________________
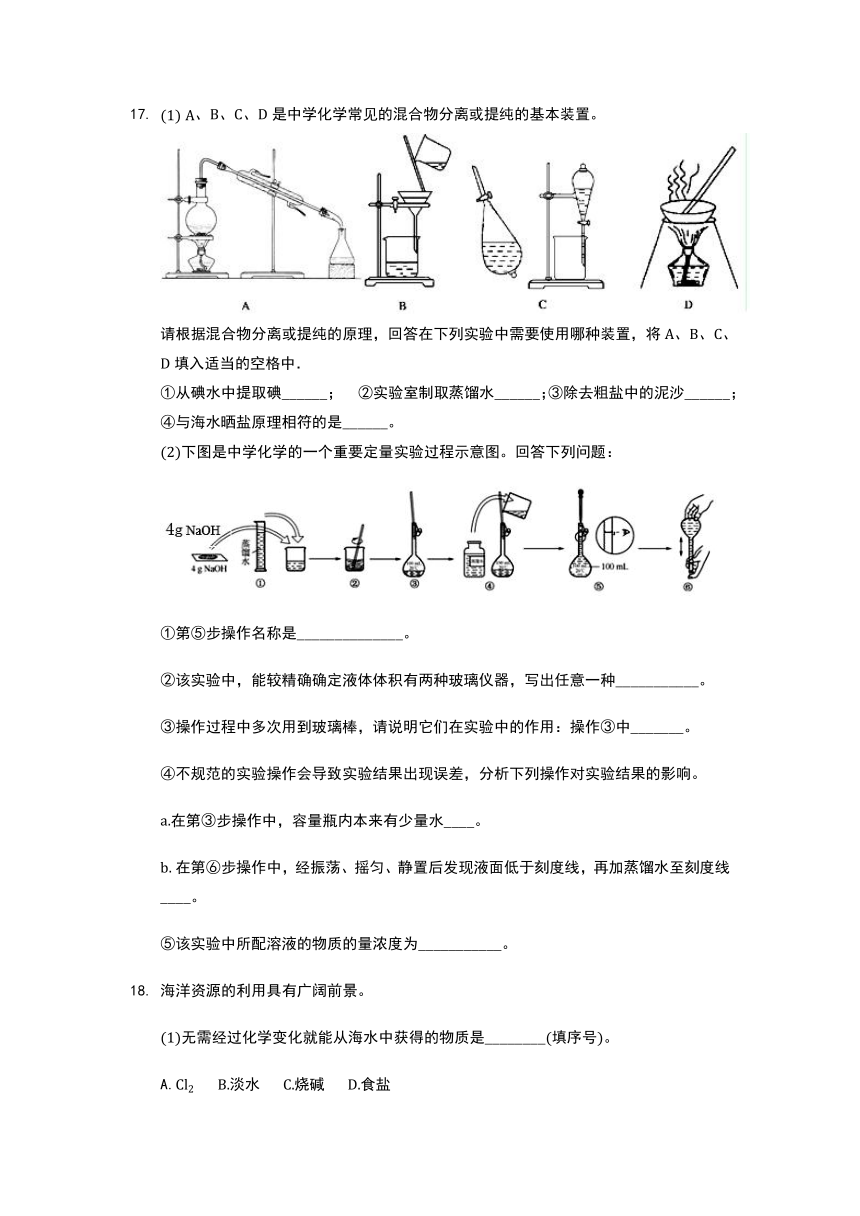
、、、是中学化学常见的混合物分离或提纯的基本装置。
请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置,将、、、填入适当的空格中.
从碘水中提取碘______; 实验室制取蒸馏水______;除去粗盐中的泥沙______;与海水晒盐原理相符的是______。
下图是中学化学的一个重要定量实验过程示意图。回答下列问题:
第步操作名称是______________。
该实验中,能较精确确定液体体积有两种玻璃仪器,写出任意一种___________。
操作过程中多次用到玻璃棒,请说明它们在实验中的作用:操作中_______。
不规范的实验操作会导致实验结果出现误差,分析下列操作对实验结果的影响。
在第步操作中,容量瓶内本来有少量水____。
在第步操作中,经振荡、摇匀、静置后发现液面低于刻度线,再加蒸馏水至刻度线____。
该实验中所配溶液的物质的量浓度为___________。
海洋资源的利用具有广阔前景。
无需经过化学变化就能从海水中获得的物质是________填序号。
A. 淡水 烧碱 食盐
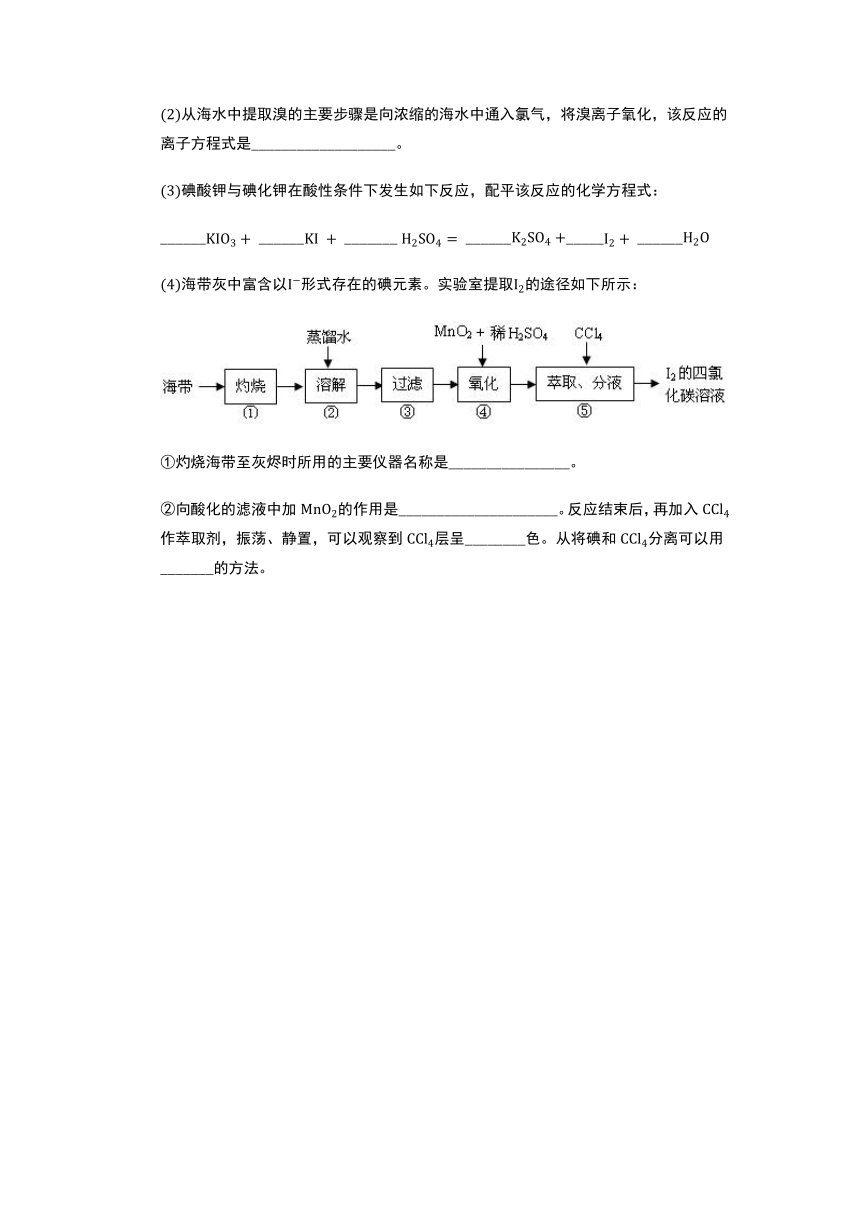
从海水中提取溴的主要步骤是向浓缩的海水中通入氯气,将溴离子氧化,该反应的离子方程式是___________________。
碘酸钾与碘化钾在酸性条件下发生如下反应,配平该反应的化学方程式:
___________________ _________________
海带灰中富含以形式存在的碘元素。实验室提取的途径如下所示:
灼烧海带至灰烬时所用的主要仪器名称是________________。
向酸化的滤液中加的作用是_____________________。反应结束后,再加入作萃取剂,振荡、静置,可以观察到层呈________色。从将碘和分离可以用_______的方法。
参考答案
1.【解答】A.潮汐发电是将潮汐能转化为电能,故A错误;
B.因水的沸点较低,可用海水蒸发制海盐,其过程是物理变化过程,故B错误;
C.海水提溴的工艺主要步骤是在预先浓缩并酸化的海水中,通入足量氯气:,需要加入氧化剂才能获得单质溴,故C错误;
D.从海水中提取金属镁,最基本的方法是往海水里加石灰乳,得到沉淀,将沉淀分离后再加入盐酸变成;之后经过滤、干燥、镁是活泼金属,为离子化合物,电解,即可得到金属镁,故D正确。
2.【解答】根据从海水制备物质的原理可知,金属单质与非金属单质需要利用化学反应来制取,而食盐可利用蒸发原理来得到,淡水利用蒸馏原理来得到。
A.可从海水中获得氯化钠,通过电解熔融氯化钠得到钠和氯气,是化学变化,通过氯气将溴离子和碘离子氧化为溴单质和碘单质,是化学变化,故A不符合题意;
B.把海水用蒸馏等方法可以得到淡水,把海水用太阳暴晒,蒸发水分后可得食盐,不需要化学变化就能够从海水中获得食盐、淡水,故B符合题意。
C.可从海水中获得氯化钠,电解熔融氯化钠得到钠和氯气,是化学变化,通过电解熔融的氯化镁和氧化铝即得镁和铝,是化学变化,故C不符合题意;
D.可从海水中获得氯化钠,配制成饱和食盐水,然后电解,即得烧碱、氢气和氯气,是化学变化,故D不符合题意;故选B。
3.【解答】A.镁在空气中点燃,剧烈燃烧,发出耀眼的白光,放出大量的热,生成白色固体氧化镁,镁是制造信号弹,故A错误;
B.溴化银见光分解,是重要的感光材料,是胶卷中必不可少的成分,故B错误;
C.碘化银用于人工降雨,故C错误;
D.金属镁能在二氧化碳中燃烧,故不能做金属镁着火的灭火剂,故D正确。
4.【解答】A.海水提镁 ,涉及将镁离子变为镁单质,属于氧化还原反应,故不选;
B.海水晒盐,利用的是蒸发水,没有新物质产生,不属于氧化还原反应,故选;
C.海水提溴,涉及将溴离子变为溴单质,属于氧化还原反应,故不选;
D.海带提碘,涉及将碘离子转化为碘单质,属于氧化还原反应,故不选;故选B.
5.【解答】A.液溴易挥发,在存放液溴的试剂瓶中应加水封,项正确;
B.能把氧化为的氧化剂有很多,如、等,项错误;
C.碘的四氯化碳溶液显紫色,是因为中溶解了,项错误;
D.某溶液加入溶液,产生不溶于稀硝酸的白色沉淀,该溶液还可能含有、,项错误。
故选A。
6.【解答】
A.氯碱工业为电解饱和食盐水制取氯气和碱:,A正确;
B.海带提碘中利用将碘离子氧化为碘单质,离子方程式为,B错误;
C.海水提镁中,用石灰乳沉镁,石灰乳在离子方程式中写化学式,,C正确;
D.海水提溴中用二氧化硫吸收:,D正确。
7.【解答】A.利用蒸馏原理可从海水中提取淡水,故A正确;
B.从海水中得到镁,需要首先从海水中获得氯化镁,先加入石灰乳沉淀镁离子,过滤后沉淀溶解于盐酸得到氯化镁溶液,经过一系列操作后得到氯化镁固体,然后再电解熔融状态的氯化镁制得镁,制镁过程中用到的沉淀剂是石灰乳,故B正确;
C.将苦卤浓缩通入过量氯气进行氧化,静置,溴沉在底部,继而通入空气和水蒸气,将溴吹入吸收塔,使溴蒸汽和吸收剂二氧化硫发生作用转化成氢溴酸以达到富集溴,然后再用氯气将其氧化得到溴,反应过程中不涉及复分解反应,故C错误;
D.从海水中得到氯化钠后,电解氯化钠溶液,得氢氧化钠、氢气和氯气,利用制得的氯气可以生产盐酸和漂白液,故D正确。故选C。
8.【解答】A.步骤中,除去粗盐中的、、等杂质,加入试剂及相关操作顺序可以是:溶液溶液溶液过滤盐酸,故A错误;
B.中、二氧化碳、氨气、水反应生成碳酸氢钠和氯化铵,过滤分离出碳酸氢钠,是因为相同条件下的溶解度比小,故B正确;
C.从经济上考虑,步骤在工业上通过向母液中加石灰乳实现,故C错误;
D.中一般用二氧化硫与溴反应生成、硫酸,元素的化合价降低,体现溴的氧化性,故D错误;
故选B。
9.【解答】的氧化性强于,因此能将氧化成碘单质,反应方程式为,则向和的混合溶液中滴加足量的溴水后,溶液中存在的物质有、、、,而易挥发,易升华,故将反应后的溶液蒸干、灼烧,最后得到的残留固体物质为和。故选A。
10.【解答】
A.工业上海水提镁用到的沉淀剂为,故A错误;
B.溶液中获得无水需在氯化氢的气流中加热,防止镁离子水解,故B正确;
C.电解熔融氯化镁制镁,故C错误;
D.粗盐中因含有、易吸水,所以粗盐易潮解,故D正确。
11.【解析】硫酸银、氯化银、碳酸银都是白色沉淀,A错误;判断是否含有钾元素,要透过蓝色钴玻璃观察火焰颜色,B错误;一种未知溶液滴加溶液,加热后产生能使湿润的红色石蕊试纸变蓝的气体,该气体为氨气,故原溶液中存在铵根离子,故C错误;某溶液先加入淀粉溶液,无变化,说明没有碘单质存在,再滴入少量溶液,溶液变蓝,说明原溶液中有,D正确。
12.【解析】解:、均与溴水发生氧化还原反应后,溶液具有颜色,由可知,
则向该无色溶液中滴加少量溴水,溶液仍呈无色,则一定不含,一定含,
又离子浓度相等、溶液为电中性,
若阴离子只有,则含 、、中的两种,
若含、,则含 、、,
若含、,不遵循电荷守恒,则一定不存在,
故选:。
向该无色溶液中滴加少量溴水,溶液仍呈无色,则一定不含,一定含,结合离子浓度相等、溶液为电中性来解答.
13.【解析】解:反应中做还原剂,为还原产物,还原剂的还原性大于还原产物的还原性,说明的还原性强于,故A正确;
B.元素的最高价为价,中元素的化合价为价,不是元素的最高价氧化物对应的水化物,故B错误;
C.反应的生成物中元素的化合价从价降低为价,则每生成,转移电子,故C正确;
D.中元素的化合价为价,为价,所以在烧碱溶液中发生反应,生成物为和,故D正确; 故选:。
14.【解答】
此题考查粗盐提纯,其中有两个注意事项,注意事项一:过量的碳酸钠溶液有两个作用,一是除去粗盐溶液当中的氯化钙,二是除去粗盐溶液中加入过量的那部分钡离子,所以碳酸钠溶液的加入应该在加入过量氯化钡之后;注意事项二:盐酸加入之前必须将前边沉淀过滤,因为有一部分沉淀溶于盐酸,所以盐酸应该在过滤之后,综上所述选AC。故答案为。
15.【解答】
A.酒精润湿海带的目的是为了使海带充分灼烧,故A正确;
B.灼烧海带应在坩埚中进行,故B错误;
C.海带中碘元素的存在形式为,用硫酸酸化的氧化为单质碘,并用萃取,故C正确;
D.海带中碘元素的存在形式为,故D错误。故选BD。
16.I. ;
【解析】略
17.;;;;
定容; 量筒或容量瓶; 引流; 无影响;偏小;
【解答】由图可知,是蒸馏装置,是过滤装置,是萃取分液装置,是蒸发装置,
从碘水中提取碘,利用溶质碘单质在有机溶剂例如:四氯化碳中的溶解度比在原溶剂水中大的原理,并且四氯化碳与水不互溶,所以可以从碘水中提取碘单质,再静置分层后分液,所以应选萃取分液装置,故选C;
蒸馏是利用互相溶解的液体混合物中各组分沸点不同而进行分离提纯的操作过程,所以实验室制取蒸馏水应该选取蒸馏装置,故选A;
除去粗盐中的泥沙,因为氯化钠易溶解于水中,而泥沙不溶于水,所以可以将粗盐溶解于蒸馏水中配成溶液,用过滤方法将食盐中的泥沙进行分离,所以应选过滤装置,故选B;
海水晒盐原理是利用食盐的溶解度受温度的影响小,从食盐溶液中获得食盐主要利用蒸发溶剂的方法,所以与其原理相符的应选取蒸发装置,故选D;
综上所述,故答案是:;;;;
配制一定物质的量的浓度溶液时的步骤是:计算称量溶解转移洗涤振荡定容摇匀等,由上图可知第步操作名称是:定容,故答案是:定容;
该实验中,因为溶解氢氧化钠要用到量筒量取蒸馏水,同时定容时用到的容量瓶,所以能较精确确定液体体积有两种玻璃仪器,量筒、容量瓶,故答案是:量筒或容量瓶;
实验操作过程中溶解氢氧化钠用到玻璃棒搅拌,移液用到玻璃棒引流,操作玻璃棒在实验中的作用是引流,故答案是:引流;
操作过程不当会引起误差,在第步操作中,容量瓶内本来有少量水对配制得到的溶液的浓度无影响,因为定容时还要继续加蒸馏水;故答案是:无影响;
在第步摇匀操作中,经振荡、摇匀、静置后发现液面低于刻度线,,是因为部分溶液残留在容量瓶的瓶塞与容量瓶之间的缝隙中,此时配制的溶液浓度准确,欲再加蒸馏水至刻度线会造成溶液体积偏大,则引起溶液浓度偏小,故答案是:偏小;
该实验中所配溶液的物质的量浓度为:,故答案是: 。
18.
;;;;;
坩埚; 氧化剂;紫或紫红;蒸馏
【解答】
直接经过蒸馏可得到淡水,经过蒸发、结晶可得食盐;
故答案为:;
氯气可与溴离子反应生成氯离子和溴单质,离子方程式为:;
故答案为:;
该反应中化合价的变化为:,元素由价价;,元素由价价,根据得失电子守恒,的计量数为,的计量数为,其它元素根据原子守恒配平,所以反应方程式为:;
故答案为:;;;;;;
灼烧固体要用坩埚;
故答案为:坩埚;
向酸化的滤液中加可将氧化为,起到氧化剂的作用;加入四氯化碳萃取使碘单质溶于四氯化碳溶液使其呈紫色或紫红色;采用蒸馏的方法将碘和分离;
故答案为:氧化剂;紫或紫红;蒸馏。
一、单选题
我国历来十分重视海水资源的综合利用,下列有关海水综合利用的说法正确的是
A. 利用潮汐发电是将化学能转化为电能
B. 海水蒸发制海盐的过程中发生了化学变化
C. 海水中含有溴元素,只需经过物理变化就可以得到溴单质
D. 从海水中可以得到,电解熔融可制备
许多国家十分重视海水资源的综合利用,不需要化学变化就能从海水中获得的物质是
A. 、、 B. 粗盐、淡水 C. 、、 D. 、
下列说法正确的是
A. 氧化镁常用于制造信号弹 B. 碘化银是胶卷中必不可少的成分
C. 溴化银可用于人工降雨 D. 二氧化碳不能作金属镁着火的灭火剂
海洋资源的开发利用具有广阔的前景,下列以海洋资源为基础的化工生产过程中,未涉及氧化还原反应的是
A. 海水提镁 B. 海水晒盐 C. 海水提溴 D. 海带提碘
下列叙述中正确的是
A. 液溴易挥发,在存放液溴的试剂瓶中应加水封
B. 能使润湿的淀粉试纸变成蓝色的物质一定是
C. 某溶液加入,层显紫色,证明原溶液中存在
D. 某溶液加入溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有
辛勤劳动才能获得海洋的馈赠。下列离子方程式错误的是
A. 氯碱工业:
B. 海带提碘中的氧化:
C. 海水提镁中用石灰乳沉镁:
D. 海水提溴中的吸收:
海水综合利用要符合可持续发展的原则,其联合工业体系部分如图所示,下列说法错误的是
A. 中可采用蒸馏法 B. 制镁过程中用到的沉淀剂是石灰乳
C. 中提溴涉及到复分解反应 D. 的产品可生产盐酸、漂白液等
海水中蕴含丰富的资源,对海水进行综合利用,可制备一系列物质见下图,下列说法正确的是
A. 步骤中,除去粗盐中的、、等杂质,加入试剂及相关操作顺序可以是:溶液溶液溶液盐酸过滤
B. 步骤中反应利用的原理是:相同条件下的溶解度比小
C. 步骤在工业上通过向母液中加固体实现
D. 步骤利用了的挥发性、还原性,该步的作用是富集
向和的混合溶液中滴加足量的溴水,待反应完全后,将溶液蒸干、灼烧,最后残留的固体物质为
A. 和 B. 、和 C. D. 和
二、不定项选择题
关于从海水中提镁的说法正确的是
A. 工业上海水提镁用到的沉淀剂为
B. 溶液中获得无水需在氯化氢的气流中加热
C. 电解氯化镁溶液制镁可得到副产品氯气
D. 粗盐中因含有、易潮解
下列检验方法与结论相符的一组是
选项 检验方法 结论
A. 一种未知溶液滴加溶液,有白色沉淀生成 未知溶液中一定含有
B. 某溶液焰色反应的火焰呈黄色 该溶液中只含钠离子,不含钾离子
C. 一种未知溶液滴加溶液,加热后产生能使湿润的蓝色石蕊试纸变红的气体 未知溶液中一定含有
D. 某溶液先加入淀粉溶液,无变化,再滴入少量溶液后,溶液变蓝 说明原溶液中有
已知:某溶液中可能含有、、、、、、,且所有离子物质的量浓度相等.向该无色溶液中滴加少量溴水,溶液仍呈无色.下列关于该溶液的判断正确的是
A. 肯定不含 B. 肯定不含
C. 肯定含有 D. 肯定含有
氯酸是强酸,在酸性介质中是强氧化剂,可与碘单质发生反应,若碘单质过量,还会发生反应下列说法错误的是
A. 化学方程式表明的还原性强于
B. 是元素的最高价氧化物对应的水化物
C. 反应中,每生成Cl2,转移电子
D. 在烧碱溶液中发生反应,生成物为和
某食盐水含有可溶性的、、等杂质,通过如下几个实验步骤,可制得纯净的食盐水:加入稍过量的溶液;加入稍过量的溶液;加入稍过量的溶液;滴入稀盐酸至无气泡产生;过滤正确的操作顺序是
A. B. C. D.
关于从海带中提取碘单质的实验说法不正确的是
A. 酒精润湿海带的目的是为了使海带充分灼烧
B. 在蒸发皿中灼烧海带,将灰烬转移到烧杯中加蒸馏水煮沸、搅拌、过滤,取滤液
C. 用硫酸酸化的氧化为单质碘,并用萃取
D. 海带中碘元素的存在形式为
三、填空题
写出下列反应的离子方程式。实验室用锌与稀硫酸制取氢气____________________________;
实验室用石灰石与稀盐酸制取二氧化碳气体____________________。
氯气溶于水____________________________________
苏打溶液与盐酸混合______________________________
氯气通入到溴化钠溶液中___________________________
碘化钠溶液与硝酸银溶液混合_______________________________
、、、是中学化学常见的混合物分离或提纯的基本装置。
请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置,将、、、填入适当的空格中.
从碘水中提取碘______; 实验室制取蒸馏水______;除去粗盐中的泥沙______;与海水晒盐原理相符的是______。
下图是中学化学的一个重要定量实验过程示意图。回答下列问题:
第步操作名称是______________。
该实验中,能较精确确定液体体积有两种玻璃仪器,写出任意一种___________。
操作过程中多次用到玻璃棒,请说明它们在实验中的作用:操作中_______。
不规范的实验操作会导致实验结果出现误差,分析下列操作对实验结果的影响。
在第步操作中,容量瓶内本来有少量水____。
在第步操作中,经振荡、摇匀、静置后发现液面低于刻度线,再加蒸馏水至刻度线____。
该实验中所配溶液的物质的量浓度为___________。
海洋资源的利用具有广阔前景。
无需经过化学变化就能从海水中获得的物质是________填序号。
A. 淡水 烧碱 食盐
从海水中提取溴的主要步骤是向浓缩的海水中通入氯气,将溴离子氧化,该反应的离子方程式是___________________。
碘酸钾与碘化钾在酸性条件下发生如下反应,配平该反应的化学方程式:
___________________ _________________
海带灰中富含以形式存在的碘元素。实验室提取的途径如下所示:
灼烧海带至灰烬时所用的主要仪器名称是________________。
向酸化的滤液中加的作用是_____________________。反应结束后,再加入作萃取剂,振荡、静置,可以观察到层呈________色。从将碘和分离可以用_______的方法。
参考答案
1.【解答】A.潮汐发电是将潮汐能转化为电能,故A错误;
B.因水的沸点较低,可用海水蒸发制海盐,其过程是物理变化过程,故B错误;
C.海水提溴的工艺主要步骤是在预先浓缩并酸化的海水中,通入足量氯气:,需要加入氧化剂才能获得单质溴,故C错误;
D.从海水中提取金属镁,最基本的方法是往海水里加石灰乳,得到沉淀,将沉淀分离后再加入盐酸变成;之后经过滤、干燥、镁是活泼金属,为离子化合物,电解,即可得到金属镁,故D正确。
2.【解答】根据从海水制备物质的原理可知,金属单质与非金属单质需要利用化学反应来制取,而食盐可利用蒸发原理来得到,淡水利用蒸馏原理来得到。
A.可从海水中获得氯化钠,通过电解熔融氯化钠得到钠和氯气,是化学变化,通过氯气将溴离子和碘离子氧化为溴单质和碘单质,是化学变化,故A不符合题意;
B.把海水用蒸馏等方法可以得到淡水,把海水用太阳暴晒,蒸发水分后可得食盐,不需要化学变化就能够从海水中获得食盐、淡水,故B符合题意。
C.可从海水中获得氯化钠,电解熔融氯化钠得到钠和氯气,是化学变化,通过电解熔融的氯化镁和氧化铝即得镁和铝,是化学变化,故C不符合题意;
D.可从海水中获得氯化钠,配制成饱和食盐水,然后电解,即得烧碱、氢气和氯气,是化学变化,故D不符合题意;故选B。
3.【解答】A.镁在空气中点燃,剧烈燃烧,发出耀眼的白光,放出大量的热,生成白色固体氧化镁,镁是制造信号弹,故A错误;
B.溴化银见光分解,是重要的感光材料,是胶卷中必不可少的成分,故B错误;
C.碘化银用于人工降雨,故C错误;
D.金属镁能在二氧化碳中燃烧,故不能做金属镁着火的灭火剂,故D正确。
4.【解答】A.海水提镁 ,涉及将镁离子变为镁单质,属于氧化还原反应,故不选;
B.海水晒盐,利用的是蒸发水,没有新物质产生,不属于氧化还原反应,故选;
C.海水提溴,涉及将溴离子变为溴单质,属于氧化还原反应,故不选;
D.海带提碘,涉及将碘离子转化为碘单质,属于氧化还原反应,故不选;故选B.
5.【解答】A.液溴易挥发,在存放液溴的试剂瓶中应加水封,项正确;
B.能把氧化为的氧化剂有很多,如、等,项错误;
C.碘的四氯化碳溶液显紫色,是因为中溶解了,项错误;
D.某溶液加入溶液,产生不溶于稀硝酸的白色沉淀,该溶液还可能含有、,项错误。
故选A。
6.【解答】
A.氯碱工业为电解饱和食盐水制取氯气和碱:,A正确;
B.海带提碘中利用将碘离子氧化为碘单质,离子方程式为,B错误;
C.海水提镁中,用石灰乳沉镁,石灰乳在离子方程式中写化学式,,C正确;
D.海水提溴中用二氧化硫吸收:,D正确。
7.【解答】A.利用蒸馏原理可从海水中提取淡水,故A正确;
B.从海水中得到镁,需要首先从海水中获得氯化镁,先加入石灰乳沉淀镁离子,过滤后沉淀溶解于盐酸得到氯化镁溶液,经过一系列操作后得到氯化镁固体,然后再电解熔融状态的氯化镁制得镁,制镁过程中用到的沉淀剂是石灰乳,故B正确;
C.将苦卤浓缩通入过量氯气进行氧化,静置,溴沉在底部,继而通入空气和水蒸气,将溴吹入吸收塔,使溴蒸汽和吸收剂二氧化硫发生作用转化成氢溴酸以达到富集溴,然后再用氯气将其氧化得到溴,反应过程中不涉及复分解反应,故C错误;
D.从海水中得到氯化钠后,电解氯化钠溶液,得氢氧化钠、氢气和氯气,利用制得的氯气可以生产盐酸和漂白液,故D正确。故选C。
8.【解答】A.步骤中,除去粗盐中的、、等杂质,加入试剂及相关操作顺序可以是:溶液溶液溶液过滤盐酸,故A错误;
B.中、二氧化碳、氨气、水反应生成碳酸氢钠和氯化铵,过滤分离出碳酸氢钠,是因为相同条件下的溶解度比小,故B正确;
C.从经济上考虑,步骤在工业上通过向母液中加石灰乳实现,故C错误;
D.中一般用二氧化硫与溴反应生成、硫酸,元素的化合价降低,体现溴的氧化性,故D错误;
故选B。
9.【解答】的氧化性强于,因此能将氧化成碘单质,反应方程式为,则向和的混合溶液中滴加足量的溴水后,溶液中存在的物质有、、、,而易挥发,易升华,故将反应后的溶液蒸干、灼烧,最后得到的残留固体物质为和。故选A。
10.【解答】
A.工业上海水提镁用到的沉淀剂为,故A错误;
B.溶液中获得无水需在氯化氢的气流中加热,防止镁离子水解,故B正确;
C.电解熔融氯化镁制镁,故C错误;
D.粗盐中因含有、易吸水,所以粗盐易潮解,故D正确。
11.【解析】硫酸银、氯化银、碳酸银都是白色沉淀,A错误;判断是否含有钾元素,要透过蓝色钴玻璃观察火焰颜色,B错误;一种未知溶液滴加溶液,加热后产生能使湿润的红色石蕊试纸变蓝的气体,该气体为氨气,故原溶液中存在铵根离子,故C错误;某溶液先加入淀粉溶液,无变化,说明没有碘单质存在,再滴入少量溶液,溶液变蓝,说明原溶液中有,D正确。
12.【解析】解:、均与溴水发生氧化还原反应后,溶液具有颜色,由可知,
则向该无色溶液中滴加少量溴水,溶液仍呈无色,则一定不含,一定含,
又离子浓度相等、溶液为电中性,
若阴离子只有,则含 、、中的两种,
若含、,则含 、、,
若含、,不遵循电荷守恒,则一定不存在,
故选:。
向该无色溶液中滴加少量溴水,溶液仍呈无色,则一定不含,一定含,结合离子浓度相等、溶液为电中性来解答.
13.【解析】解:反应中做还原剂,为还原产物,还原剂的还原性大于还原产物的还原性,说明的还原性强于,故A正确;
B.元素的最高价为价,中元素的化合价为价,不是元素的最高价氧化物对应的水化物,故B错误;
C.反应的生成物中元素的化合价从价降低为价,则每生成,转移电子,故C正确;
D.中元素的化合价为价,为价,所以在烧碱溶液中发生反应,生成物为和,故D正确; 故选:。
14.【解答】
此题考查粗盐提纯,其中有两个注意事项,注意事项一:过量的碳酸钠溶液有两个作用,一是除去粗盐溶液当中的氯化钙,二是除去粗盐溶液中加入过量的那部分钡离子,所以碳酸钠溶液的加入应该在加入过量氯化钡之后;注意事项二:盐酸加入之前必须将前边沉淀过滤,因为有一部分沉淀溶于盐酸,所以盐酸应该在过滤之后,综上所述选AC。故答案为。
15.【解答】
A.酒精润湿海带的目的是为了使海带充分灼烧,故A正确;
B.灼烧海带应在坩埚中进行,故B错误;
C.海带中碘元素的存在形式为,用硫酸酸化的氧化为单质碘,并用萃取,故C正确;
D.海带中碘元素的存在形式为,故D错误。故选BD。
16.I. ;
【解析】略
17.;;;;
定容; 量筒或容量瓶; 引流; 无影响;偏小;
【解答】由图可知,是蒸馏装置,是过滤装置,是萃取分液装置,是蒸发装置,
从碘水中提取碘,利用溶质碘单质在有机溶剂例如:四氯化碳中的溶解度比在原溶剂水中大的原理,并且四氯化碳与水不互溶,所以可以从碘水中提取碘单质,再静置分层后分液,所以应选萃取分液装置,故选C;
蒸馏是利用互相溶解的液体混合物中各组分沸点不同而进行分离提纯的操作过程,所以实验室制取蒸馏水应该选取蒸馏装置,故选A;
除去粗盐中的泥沙,因为氯化钠易溶解于水中,而泥沙不溶于水,所以可以将粗盐溶解于蒸馏水中配成溶液,用过滤方法将食盐中的泥沙进行分离,所以应选过滤装置,故选B;
海水晒盐原理是利用食盐的溶解度受温度的影响小,从食盐溶液中获得食盐主要利用蒸发溶剂的方法,所以与其原理相符的应选取蒸发装置,故选D;
综上所述,故答案是:;;;;
配制一定物质的量的浓度溶液时的步骤是:计算称量溶解转移洗涤振荡定容摇匀等,由上图可知第步操作名称是:定容,故答案是:定容;
该实验中,因为溶解氢氧化钠要用到量筒量取蒸馏水,同时定容时用到的容量瓶,所以能较精确确定液体体积有两种玻璃仪器,量筒、容量瓶,故答案是:量筒或容量瓶;
实验操作过程中溶解氢氧化钠用到玻璃棒搅拌,移液用到玻璃棒引流,操作玻璃棒在实验中的作用是引流,故答案是:引流;
操作过程不当会引起误差,在第步操作中,容量瓶内本来有少量水对配制得到的溶液的浓度无影响,因为定容时还要继续加蒸馏水;故答案是:无影响;
在第步摇匀操作中,经振荡、摇匀、静置后发现液面低于刻度线,,是因为部分溶液残留在容量瓶的瓶塞与容量瓶之间的缝隙中,此时配制的溶液浓度准确,欲再加蒸馏水至刻度线会造成溶液体积偏大,则引起溶液浓度偏小,故答案是:偏小;
该实验中所配溶液的物质的量浓度为:,故答案是: 。
18.
;;;;;
坩埚; 氧化剂;紫或紫红;蒸馏
【解答】
直接经过蒸馏可得到淡水,经过蒸发、结晶可得食盐;
故答案为:;
氯气可与溴离子反应生成氯离子和溴单质,离子方程式为:;
故答案为:;
该反应中化合价的变化为:,元素由价价;,元素由价价,根据得失电子守恒,的计量数为,的计量数为,其它元素根据原子守恒配平,所以反应方程式为:;
故答案为:;;;;;;
灼烧固体要用坩埚;
故答案为:坩埚;
向酸化的滤液中加可将氧化为,起到氧化剂的作用;加入四氯化碳萃取使碘单质溶于四氯化碳溶液使其呈紫色或紫红色;采用蒸馏的方法将碘和分离;
故答案为:氧化剂;紫或紫红;蒸馏。
