9.2.3 溶解度 同步课件(共17张PPT)
文档属性
| 名称 | 9.2.3 溶解度 同步课件(共17张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 10.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-02 14:30:43 | ||
图片预览




文档简介
(共17张PPT)
一、情景引入,导入新知
回顾:
1、什么叫溶解性?溶解性受哪些因素影响?
2、什么叫溶解度?溶解性和溶解度是什么关系?
3、固体物质溶解度包含哪几大要素?易溶可溶、微溶、难溶是什么含义?
4、气体物质溶解度包含哪几大要素?气体物质溶解度受哪些外因影响?
一、情景引入,导入新知
课题2 溶解度
第九单元 溶液
(第3课时)
2021-2022学年九年级化学下册同步(人教版)
二、自主学习,发现疑问
01
02
疑问一
疑问二
什么是溶解度曲线?如何绘制溶解度曲线?
根据溶解度曲线可知道固体物质的溶解度随温度的变化有什么规律?
03
疑问三
从溶解度曲线能获取哪些信息?这些信息有哪些应用?
01
探究一
三、合作探究,质疑解难
(溶解度g)
0
(温度℃)
10
20
30
40
50
60
70
80
90
100
20
40
60
80
100
120
140
160
180
200
KNO3
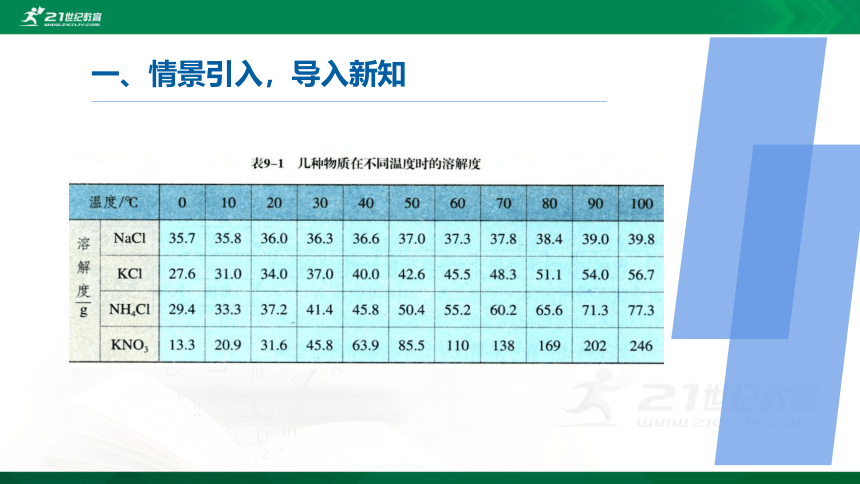
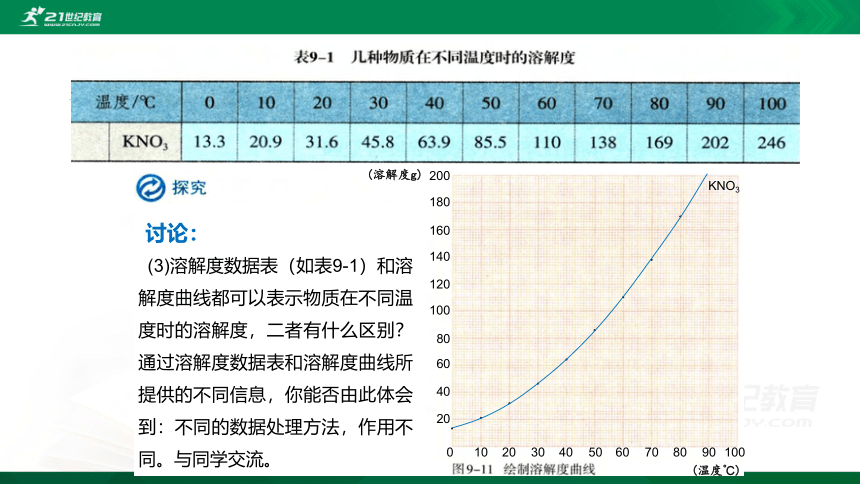
(3)溶解度数据表(如表9-1)和溶解度曲线都可以表示物质在不同温度时的溶解度,二者有什么区别?通过溶解度数据表和溶解度曲线所提供的不同信息,你能否由此体会到:不同的数据处理方法,作用不同。与同学交流。
讨论:
三、合作探究,质疑解难
(1)根据图9-12和图9-13分析,这些固体物质的溶解度随温度的变化有什么规律?举例说明。
讨论:
固体物质溶解度随温度变化的规律:
多数固体物质溶解度随温度升高而增大,如KNO3;
少数固体物质溶解度受温度影响很小,如NaCl;
极少数固体物质溶解度随温度升高而减小,如Ca(OH)2。
注意:熟石灰溶解度的两大特征:一是微溶,二是随温度升高而减小。
02
探究二
01
探究一
03
探究三
三、合作探究,质疑解难
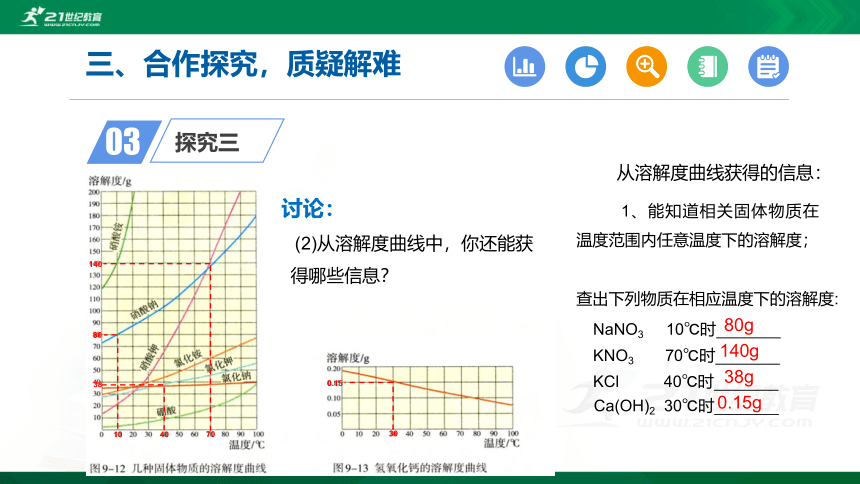
(2)从溶解度曲线中,你还能获得哪些信息?
讨论:
查出下列物质在相应温度下的溶解度:
NaNO3 10℃时
KNO3 70℃时
KCl 40℃时
Ca(OH)2 30℃时
80g
140g
38g
0.15g
10
80
40
70
140
38
30
0.15
从溶解度曲线获得的信息:
1、能知道相关固体物质在温度范围内任意温度下的溶解度;
03
探究三
三、合作探究,质疑解难
(2)从溶解度曲线中,你还能获得哪些信息?
讨论:
2、了解相关固体物质溶解度随温度变化趋势:
从溶解度曲线获得的信息:
1、能知道相关固体物质在温度范围内任意温度下的溶解度;
“撇”得越陡,溶解度随温度升高增大越快;
“横”得越平,溶解度随温度升高变化越小;
“捺”得越陡,溶解度随温度升高减小越快。
03
探究三
三、合作探究,质疑解难
(2)从溶解度曲线中,你还能获得哪些信息?
讨论:
这些信息有什么用途?
20
2、比较同一温度或同一温度段不同固体物质溶解度的大小;
溶解度曲线的用途:
1、查某固体物质在某温度下的溶解度;
3、了解固体溶解度随温度变化情况;
03
探究三
三、合作探究,质疑解难
138.4g
仅析出3g
2、比较同一温度或同一温度段不同固体物质溶解度的大小;
溶解度曲线的用途:
1、查某固体物质在某温度下的溶解度;
3、了解固体溶解度随温度变化情况;
4、选择结晶的方法:
“撇”得越陡,越适合用降温结晶;
“横”得越平,越适合用蒸发结晶;
“捺”得越陡,越适合用升温结晶。
KNO3
NaCl
三、合作探究,质疑解难
138.4g
没有晶体析出
2、比较同一温度或同一温度段不同固体物质溶解度的大小;
溶解度曲线的用途:
1、查某固体物质在某温度下的溶解度;
3、了解固体溶解度随温度变化情况;
4、选择结晶的方法;
5、选择提纯的方法:
适合用什么方法结晶,就适合用什么方法提纯。
KNO3
NaCl
固体物质溶解度随温度变化的规律
概念及画 法
溶解度曲线的概念及画法
用 途
溶解度曲 线
1、引导总结
四、展示归纳,点拨提升
多数固体物质溶解度随温度升高而增大,如KNO3;
少数固体物质溶解度受温度影响很小,如NaCl;
固体溶解度的规 律
1、溶解度曲线就是固体物质溶解随温度变化的曲线。
2、画法。
极少数固体物质溶解度随温度升高而减小,如Ca(OH)2。
溶解度曲线的用途
1、查某固体物质在某温度下的溶解度;
2、比较同一温度或同一温度段不同固体物质溶解度的大小;
3、了解固体溶解度随温度变化情况;
4、选择结晶的方法;
5、选择提纯的方法。
四、展示归纳,点拨提升
2、讨论点拨
在溶解度曲线中,点、线、面分别是什么含义?
点:溶解度曲线上的每一个点均表示某一温度下的溶解度,且为饱和溶液;交点表示某温度下两种物质溶解度相同;
线:溶解度曲线表示物质溶解度随温度变化的趋势;
面:溶解度曲线上方所有点形成的面表示的是饱和溶液,且有未溶解完的溶质;溶解度曲线下方所有点形成的面表示的是不饱和溶液。
五、目标检测,检查效果
01
练习一
硝酸钾的溶解度曲线如图所示。
(1)30℃时,硝酸钾的溶解度是 。
(2)60℃时,在200g水中加入120g硝酸钾固体,充分搅拌。
①所得溶液是 (选填“饱和”或“不饱 和”)溶液;
②将上述溶液降温至30℃,可析出硝酸钾晶体
。
45.8g
不饱和
28.4g
五、目标检测,检查效果
02
练习二
A、B、C三种物质的溶解度曲线如图,请回答下列问题:
(1)t3℃时A的溶解度为 。
(2)P点的含义是 。
(3)N点为A的 ,可通过 的方法
使 它变为饱和。
(4)t1℃时A、B、C溶解度由大到小的顺序为 。
(5)从A溶液中获取A晶体可用 方法。
(6)从B溶液混有少量的A,适宜采用 方法提纯。
80g
A、C的溶解度相同
不饱和溶液
加A物质等
BCA
降温结晶
蒸发结晶
https://www.21cnjy.com/help/help_extract.php
一、情景引入,导入新知
回顾:
1、什么叫溶解性?溶解性受哪些因素影响?
2、什么叫溶解度?溶解性和溶解度是什么关系?
3、固体物质溶解度包含哪几大要素?易溶可溶、微溶、难溶是什么含义?
4、气体物质溶解度包含哪几大要素?气体物质溶解度受哪些外因影响?
一、情景引入,导入新知
课题2 溶解度
第九单元 溶液
(第3课时)
2021-2022学年九年级化学下册同步(人教版)
二、自主学习,发现疑问
01
02
疑问一
疑问二
什么是溶解度曲线?如何绘制溶解度曲线?
根据溶解度曲线可知道固体物质的溶解度随温度的变化有什么规律?
03
疑问三
从溶解度曲线能获取哪些信息?这些信息有哪些应用?
01
探究一
三、合作探究,质疑解难
(溶解度g)
0
(温度℃)
10
20
30
40
50
60
70
80
90
100
20
40
60
80
100
120
140
160
180
200
KNO3
(3)溶解度数据表(如表9-1)和溶解度曲线都可以表示物质在不同温度时的溶解度,二者有什么区别?通过溶解度数据表和溶解度曲线所提供的不同信息,你能否由此体会到:不同的数据处理方法,作用不同。与同学交流。
讨论:
三、合作探究,质疑解难
(1)根据图9-12和图9-13分析,这些固体物质的溶解度随温度的变化有什么规律?举例说明。
讨论:
固体物质溶解度随温度变化的规律:
多数固体物质溶解度随温度升高而增大,如KNO3;
少数固体物质溶解度受温度影响很小,如NaCl;
极少数固体物质溶解度随温度升高而减小,如Ca(OH)2。
注意:熟石灰溶解度的两大特征:一是微溶,二是随温度升高而减小。
02
探究二
01
探究一
03
探究三
三、合作探究,质疑解难
(2)从溶解度曲线中,你还能获得哪些信息?
讨论:
查出下列物质在相应温度下的溶解度:
NaNO3 10℃时
KNO3 70℃时
KCl 40℃时
Ca(OH)2 30℃时
80g
140g
38g
0.15g
10
80
40
70
140
38
30
0.15
从溶解度曲线获得的信息:
1、能知道相关固体物质在温度范围内任意温度下的溶解度;
03
探究三
三、合作探究,质疑解难
(2)从溶解度曲线中,你还能获得哪些信息?
讨论:
2、了解相关固体物质溶解度随温度变化趋势:
从溶解度曲线获得的信息:
1、能知道相关固体物质在温度范围内任意温度下的溶解度;
“撇”得越陡,溶解度随温度升高增大越快;
“横”得越平,溶解度随温度升高变化越小;
“捺”得越陡,溶解度随温度升高减小越快。
03
探究三
三、合作探究,质疑解难
(2)从溶解度曲线中,你还能获得哪些信息?
讨论:
这些信息有什么用途?
20
2、比较同一温度或同一温度段不同固体物质溶解度的大小;
溶解度曲线的用途:
1、查某固体物质在某温度下的溶解度;
3、了解固体溶解度随温度变化情况;
03
探究三
三、合作探究,质疑解难
138.4g
仅析出3g
2、比较同一温度或同一温度段不同固体物质溶解度的大小;
溶解度曲线的用途:
1、查某固体物质在某温度下的溶解度;
3、了解固体溶解度随温度变化情况;
4、选择结晶的方法:
“撇”得越陡,越适合用降温结晶;
“横”得越平,越适合用蒸发结晶;
“捺”得越陡,越适合用升温结晶。
KNO3
NaCl
三、合作探究,质疑解难
138.4g
没有晶体析出
2、比较同一温度或同一温度段不同固体物质溶解度的大小;
溶解度曲线的用途:
1、查某固体物质在某温度下的溶解度;
3、了解固体溶解度随温度变化情况;
4、选择结晶的方法;
5、选择提纯的方法:
适合用什么方法结晶,就适合用什么方法提纯。
KNO3
NaCl
固体物质溶解度随温度变化的规律
概念及画 法
溶解度曲线的概念及画法
用 途
溶解度曲 线
1、引导总结
四、展示归纳,点拨提升
多数固体物质溶解度随温度升高而增大,如KNO3;
少数固体物质溶解度受温度影响很小,如NaCl;
固体溶解度的规 律
1、溶解度曲线就是固体物质溶解随温度变化的曲线。
2、画法。
极少数固体物质溶解度随温度升高而减小,如Ca(OH)2。
溶解度曲线的用途
1、查某固体物质在某温度下的溶解度;
2、比较同一温度或同一温度段不同固体物质溶解度的大小;
3、了解固体溶解度随温度变化情况;
4、选择结晶的方法;
5、选择提纯的方法。
四、展示归纳,点拨提升
2、讨论点拨
在溶解度曲线中,点、线、面分别是什么含义?
点:溶解度曲线上的每一个点均表示某一温度下的溶解度,且为饱和溶液;交点表示某温度下两种物质溶解度相同;
线:溶解度曲线表示物质溶解度随温度变化的趋势;
面:溶解度曲线上方所有点形成的面表示的是饱和溶液,且有未溶解完的溶质;溶解度曲线下方所有点形成的面表示的是不饱和溶液。
五、目标检测,检查效果
01
练习一
硝酸钾的溶解度曲线如图所示。
(1)30℃时,硝酸钾的溶解度是 。
(2)60℃时,在200g水中加入120g硝酸钾固体,充分搅拌。
①所得溶液是 (选填“饱和”或“不饱 和”)溶液;
②将上述溶液降温至30℃,可析出硝酸钾晶体
。
45.8g
不饱和
28.4g
五、目标检测,检查效果
02
练习二
A、B、C三种物质的溶解度曲线如图,请回答下列问题:
(1)t3℃时A的溶解度为 。
(2)P点的含义是 。
(3)N点为A的 ,可通过 的方法
使 它变为饱和。
(4)t1℃时A、B、C溶解度由大到小的顺序为 。
(5)从A溶液中获取A晶体可用 方法。
(6)从B溶液混有少量的A,适宜采用 方法提纯。
80g
A、C的溶解度相同
不饱和溶液
加A物质等
BCA
降温结晶
蒸发结晶
https://www.21cnjy.com/help/help_extract.php
同课章节目录
