2021北京市部分学校高三(上)期中化学(含答案)
文档属性
| 名称 | 2021北京市部分学校高三(上)期中化学(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 337.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-04 21:30:08 | ||
图片预览


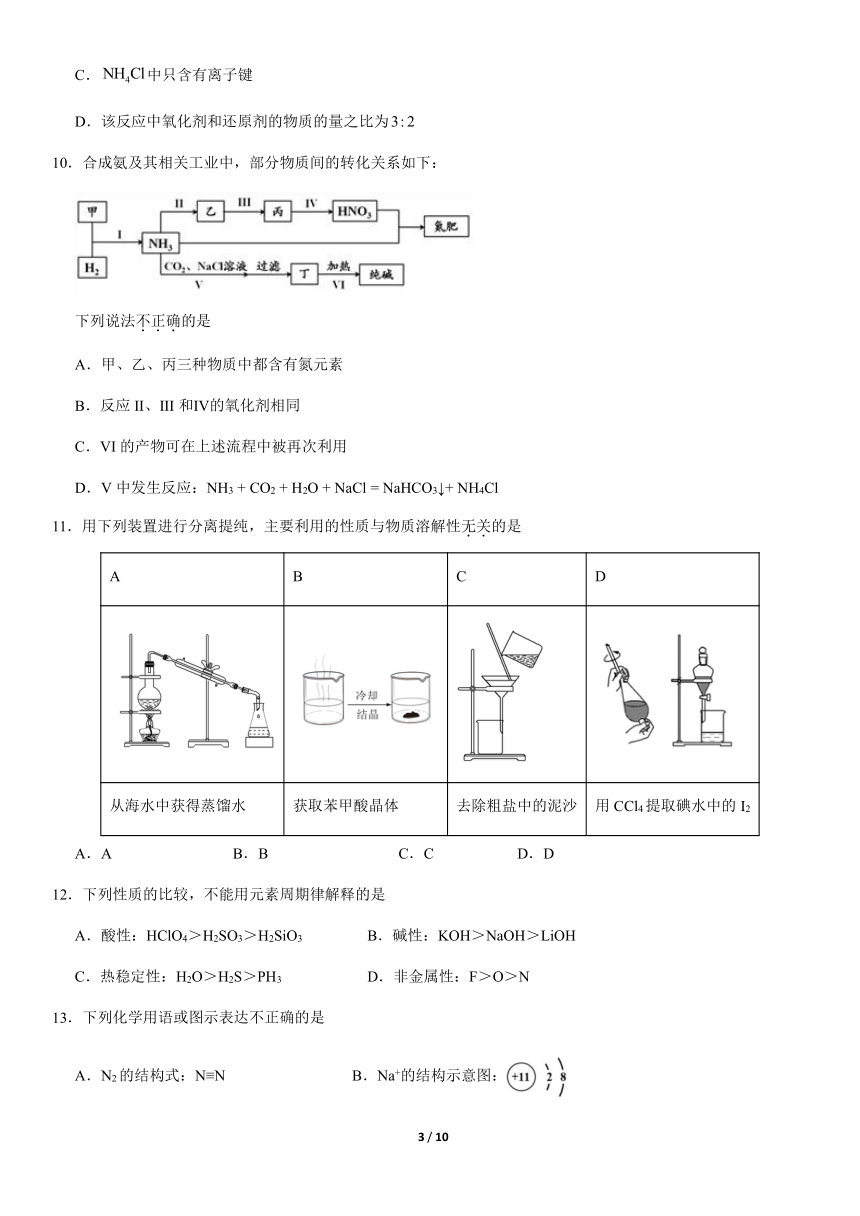
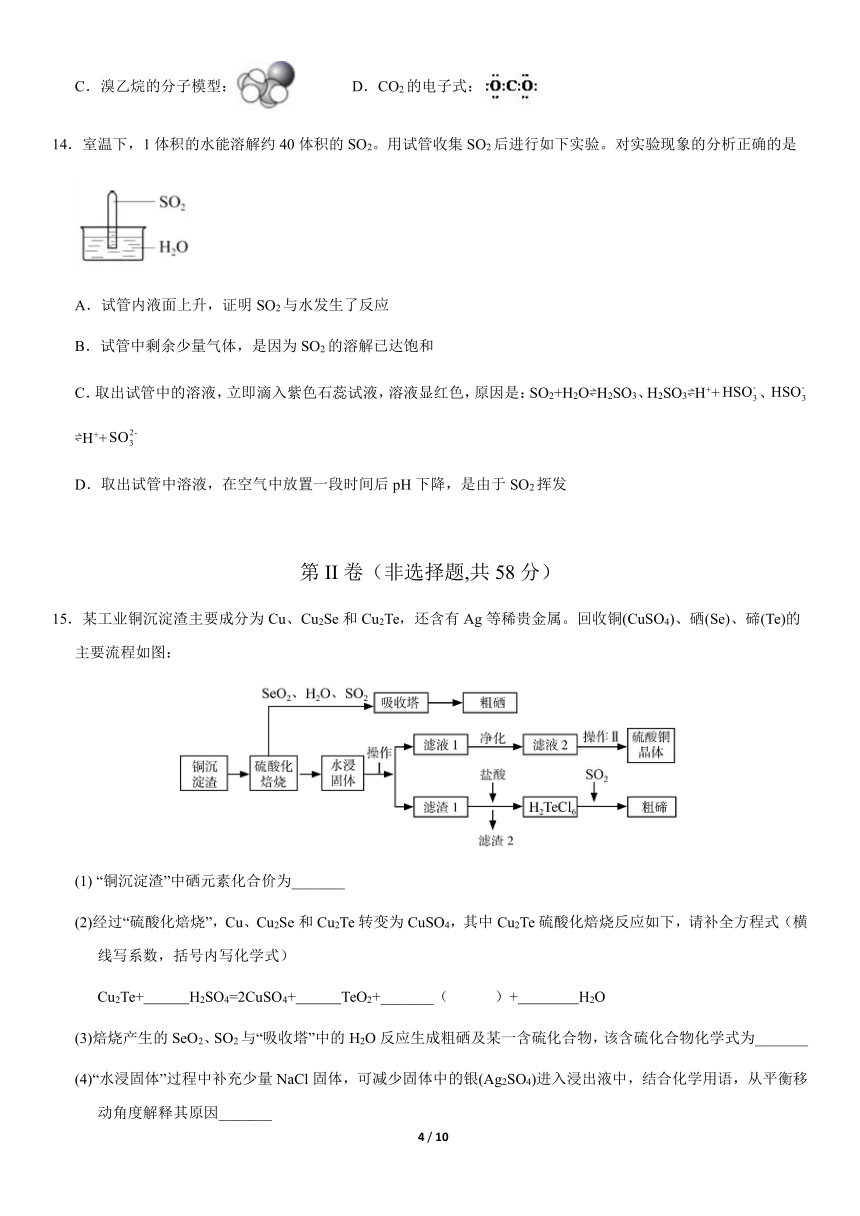

文档简介
2021高三(上)期中
化 学
2021年11月3日
考 生 须 知 1. 本练习共两道大题19小题,共8页,满分100分,考试时间90分钟。 2. 本次考试所有答案均在答题卡上完成。选择题用2B铅笔以正确方式填涂,非选择题用黑色签字笔填写,字迹要工整、清楚。 3. 请严格按照答题卡上题号作答,在答题卡规定区域内书写答案,在试卷、草稿纸上答题无效。请保持答题卡清洁,不要折叠、污损。 4. 在试卷和草稿纸上准确填写姓名、教育ID号,本人所在年级、班级,格式:初一(X)班。
第I卷(选择题,共42分)
一、单选题(本题共14小题,每小题只有一个选项符合题意,每小题3分,共42分)
1.下列关于物质分类的叙述中,不正确的是( )
A.Na属于单质 B.Na2O属于氧化物
C.HClO属于酸 D.NaClO属于碱
2.下列化学用语表达正确的是
A.NaCl溶液导电 :NaCl=Na++Cl
B.氯气通入水中制备氯水:Cl2+H2O=2H++ClO-+Cl-
C.CO2通入苯酚钠溶液中出现浑浊:CO2+H2O+2C6H5O-→2 C6H5OH+CO
D.石灰水敞口存放,出现白色固体:2OH- + CO2 =CO+ H2O
3.室温下,下列各组离子在指定溶液中一定能大量存在的是
A.0.1mol/LNaOH溶液:Na+、K+、、
B.0.1mol/LFeCl2溶液:K+、Mg2+、、
C.0.1mol/LK2CO3溶液:Na+、Ba2+、Cl-、OH-
D.水电离的c(H+)=110-13mol/L溶液:K+、、、
4.下列古诗词描述的场景中发生的化学反应不属于氧化还原反应的是( )
A.爆竹声中一岁除——黑火药受热爆炸 B.烈火焚烧若等闲——石灰石分解
C.蜡炬成灰泪始干——石蜡的燃烧 D.炉火照天地,红星乱紫烟——铁的冶炼
5.下列实验中的颜色变化,与氧化还原反应无关的是
A.FeCl3溶液滴入Mg(OH)2浊液中,白色浑浊转化为红褐色沉淀
B.AgNO3溶液滴入氯水中,产生白色沉淀,随后淡黄绿色褪去
C.Na块放在坩埚里并加热,发出黄色火焰,生成淡黄色固体
D.H2C2O4溶液滴入KMnO4酸性溶液中,产生气泡,随后紫色褪去
6.下列试剂的保存方法中错误的是
A.少量的钠保存在煤油中 B.新制的氯水保存在棕色玻璃瓶中
C.NaOH溶液保存在带橡皮塞的玻璃瓶中 D.氢氟酸保存在玻璃瓶中
7.下列检验方法,利用该气体的还原性的是
A.使品红溶液褪色 B.遇到空气变为红棕色
C.使湿润的红色石蕊试纸变蓝 D.使湿润的淀粉碘化钾试纸变蓝
8.含硫煤燃烧会产生大气污染物,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是
A.该过程中可得到化工产品
B.该工艺流程是除去煤燃烧时产生的
C.该过程中化合价发生改变的元素只有O和S
D.图中涉及的反应之一为:
9.工业上利用反应检查氯气管道是否漏气。下列不正确的是
A.将浓氨水接近管道,若产生白烟说明管道漏气
B.的电子式为:
C.中只含有离子键
D.该反应中氧化剂和还原剂的物质的量之比为
10.合成氨及其相关工业中,部分物质间的转化关系如下:
下列说法不正确的是
A.甲、乙、丙三种物质中都含有氮元素
B.反应II、III和Ⅳ的氧化剂相同
C.VI的产物可在上述流程中被再次利用
D.V中发生反应:NH3 + CO2 + H2O + NaCl = NaHCO3↓+ NH4Cl
11.用下列装置进行分离提纯,主要利用的性质与物质溶解性无关的是
A B C D
从海水中获得蒸馏水 获取苯甲酸晶体 去除粗盐中的泥沙 用CCl4提取碘水中的I2
A.A B.B C.C D.D
12.下列性质的比较,不能用元素周期律解释的是
A.酸性:HClO4>H2SO3>H2SiO3 B.碱性:KOH>NaOH>LiOH
C.热稳定性:H2O>H2S>PH3 D.非金属性:F>O>N
13.下列化学用语或图示表达不正确的是
A.N2的结构式:N≡N B.Na+的结构示意图:
C.溴乙烷的分子模型: D.CO2的电子式:
14.室温下,1体积的水能溶解约40体积的SO2。用试管收集SO2后进行如下实验。对实验现象的分析正确的是
A.试管内液面上升,证明SO2与水发生了反应
B.试管中剩余少量气体,是因为SO2的溶解已达饱和
C.取出试管中的溶液,立即滴入紫色石蕊试液,溶液显红色,原因是:SO2+H2O H2SO3、H2SO3 H++、 H++
D.取出试管中溶液,在空气中放置一段时间后pH下降,是由于SO2挥发
第II卷(非选择题,共58分)
15.某工业铜沉淀渣主要成分为Cu、Cu2Se和Cu2Te,还含有Ag等稀贵金属。回收铜(CuSO4)、硒(Se)、碲(Te)的主要流程如图:
(1) “铜沉淀渣”中硒元素化合价为_______
(2)经过“硫酸化焙烧”,Cu、Cu2Se和Cu2Te转变为CuSO4,其中Cu2Te硫酸化焙烧反应如下,请补全方程式(横线写系数,括号内写化学式)
Cu2Te+ H2SO4=2CuSO4+ TeO2+_______( )+ H2O
(3)焙烧产生的SeO2、SO2与“吸收塔”中的H2O反应生成粗硒及某一含硫化合物,该含硫化合物化学式为_______
(4)“水浸固体”过程中补充少量NaCl固体,可减少固体中的银(Ag2SO4)进入浸出液中,结合化学用语,从平衡移动角度解释其原因_______
(5)“滤液2”经过_______、_______、过滤、洗涤、干燥可以得到硫酸铜晶体。(填操作名称)
(6)碲化镉薄膜电池是具有发展前景的太阳能技术之一。用如图装置可以完成碲的精炼。写出碱性条件下实现碲(Te)沉积的电极反应式 _______
16.琥珀酸亚铁,呈暗黄色,是市场上一种常见的补铁药物,该药品不溶于水但能溶于人体中的胃酸(主要成分为盐酸)。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
(1)试剂1是___________,试剂2是___________,加入新制氯水所发生的离子反应方程式是___________、___________。
(2)该同学猜想红色溶液褪色的原因是溶液中的Fe3+被还原为Fe2+,你认为该同学的猜想合理吗?___________,理由是___________;请设计一个简单的实验加以验证__________。
(3)该药品须密封保存,若表面出现颜色变化,说明部分Fe2+已变成Fe3+。药品中经常放入维生素C,可以延长保质期。请你解释原因___________。
17.小王同学在一次实验中发现:把新制氯水逐滴加到含有酚酞的氢氧化钠溶液中,当加到最后一滴时溶液的红色突然消失。
(1)将氯气通入水中发生反应的化学方程式为_______。
(2)氯水的颜色呈浅黄绿色,说明氯水中含有_______ ;向氯水中滴加AgNO3溶液,反应的离子方程式是_______。
(3)探究“溶液的红色突然消失”的原因:
①猜想
a:是氯水中的盐酸和次氯酸中和了 NaOH,使酚酞由红色变成无色;
b:是 _______。
②设计实验:往已褪色的溶液中连续滴加 NaOH溶液至过量,若现象为 _______,则证明“猜想 a”正确;若现象为_______,则证明“猜想 b”正确。
18.为纪念元素周期表诞生 150 周年,IUPAC 等从世界范围征集优秀青年化学家为化学元素代言,我国有8 位化学家成为硫(S)等元素的代言人。回答下列问题:
(1)S 在周期表中的位置是___________
(2)下列有关性质的比较,能用元素周期律解释的是___________(填字母序号)
a.非金属性:O>S
b.离子半径:S2->Cl-
c.酸性:H2SO4>H2SO3
d.酸性:H2SO4>H3PO4
(3)Se 与 S 位于同一主族,二者氢化物稳定性较强的是:___________(用化学式表示),用原子结构解释原因___________
(4)某同学用如下装置探究不同价态硫元素之间的转化。培养皿中 A、B、C 三个塑料瓶盖内盛有不同物质。向 Na2SO3 固体上滴加 70%硫酸,迅速用玻璃片将培养皿盖严,实验记录如下。
实验装置 瓶盖 物质 实验现象
A 蘸有品红溶液的棉花 品红溶液褪色
B HCl、BaCl2 的混合溶液 无明显变化
C HCl、BaCl2、FeCl3 的混合溶液 产生白色沉淀
能够说明硫元素由+4 价转化为+6 价的证据是___________
19.某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
(1)浓盐酸与MnO2混合加热生成氯气。氯气不再逸出时,固液混合物A中仍存在盐酸和MnO2。
①反应的离子方程式是_______。
②电极反应式:
i.还原反应:MnO2+2e-+4H+=Mn2++2H2O
ii.氧化反应:_______。
③根据电极反应式,分析A中仍存在盐酸和MnO2的原因。
i.随c(H+)降低或c(Mn2+)浓度升高,MnO2氧化性减弱。
ii.随c(Cl-)降低,_______。
④补充实验证实了③中的分析。
实验操作 试剂 产物
I 较浓H2SO4 有氯气
II a 有氯气
III a+b 无氯气
a是_______,b是_______。
(2)利用c(H+)浓度对MnO2氧化性的影响,探究卤素离子的还原性。相同浓度的KCl、KBr和KI溶液,能与MnO2反应所需的最低c(H+)由大到小的顺序是_______,从原子结构角度说明理由______________。
(3)根据(1)中结论推测:酸性条件下,加入某种化合物可以提高溴的氧化性,将Mn2+氧化为MnO2。经实验证实了推测,该化合物是_______。
(4)Ag分别与1mol·L1的盐酸、氢溴酸和氢碘酸混合,Ag只与氢碘酸发生置换反应,试解释原因:_______。
(5)总结:物质氧化性和还原性变化的一般规律是_______。
参考答案
第I卷(选择题)(共42分)
题号 1 2 3 4 5 6 7
答案 D A A B A D B
题号 8 9 10 11 12 13 14
答案 C C B A A D C
第二部分 非选择题(共58分)
15.(共10分)
(1)-2 (1分)
(2)Cu2Te+6H2SO4=2CuSO4+1TeO2+4SO2+6H2O (2分)
(3)H2SO4 (1分)
(4)Ag2SO4(s) Ag+(aq) + SO(aq),加入NaCl后Cl-与Ag+结合生成更难溶的AgCl,使c(Ag+)降低,进而减少了银进入溶液中. (2分)
(5)加热浓缩 (1分) 冷却结晶 (1分)
(6)TeO+4e-+3H2O=Te+6OH- (2分)
16.(共13分)
(1)稀盐酸(或HCl) (1分) KSCN溶液 (1分)
Cl2+2Fe2+=2Fe3++2Cl-(2分)、Fe3++3SCN-=Fe(SCN)3 (2分)
(2)不合理(1分) 氯水氧化性强,不会还原Fe3+ (2分) 向褪色后的溶液中加入FeCl3溶液,仍不变红色或者向褪色后的溶液中加入KSCN溶液,变红色 (2分)
(3)维生素C具有还原性,可将Fe3+还原为Fe2+(2分)
17.(共9分)
(1)Cl2+H2O HCl+HClO(2分)
(2)Cl2(1分) Ag++Cl-=AgCl↓ (2分)
(3)①氯水中的次氯酸有漂白性,使溶液由红色变为无色 (2分)
②溶液变红(1分) 溶液仍为无色 (1分)
18.(共9分)
(1)第三周期ⅥA族 (2分)
(2)a、b、d (2分)
(3) (1分) 核电荷数SSe,非金属性S>Se,所以氢化物稳定性 (2分)
(4)A中品红溶液褪色说明有SO2生成,C中产出白色沉淀而B中无明显变化,证明SO2 (+4价)在C中转化为 (+6价) (2分)
19.(共17分)
(1)① MnO2+4H+ +2Cl- Mn2++Cl2↑ + 2H2O (2分)
② 2Cl--2e- =Cl2↑ (2分)
③Cl-还原性减弱或Cl2 的氧化性增强 (2分)
④KCl固体(或浓/饱和溶液) (1分) MnSO4固体(或浓/饱和溶液) (1分)
(2)KCl>KBr>KI (1分)
Cl、Br、I位于第VIIA族,从上到下电子层数逐渐增加,原子半径逐渐增大,得电子能力逐渐减弱,阴离子的还原性逐渐增强 (2分)
(3)AgNO3 或Ag2SO4(2分)
(4)比较AgX的溶解度,AgI 溶解度最小,Ag++I-= AgI↓使得Ag还原性增强的最多,使得2Ag+2H+=2Ag++ H2↑反应得以发生(2分)
(5)氧化剂(还原剂)的浓度越大,其氧化性(还原性)越强,还原产物(还原产物)的浓度越大,氧化剂(还原剂)的氧化性(还原性)越小;还原反应中,反应物浓度越大或生成物浓度越小,氧化剂氧化性越强。(2分) 1 / 3
化 学
2021年11月3日
考 生 须 知 1. 本练习共两道大题19小题,共8页,满分100分,考试时间90分钟。 2. 本次考试所有答案均在答题卡上完成。选择题用2B铅笔以正确方式填涂,非选择题用黑色签字笔填写,字迹要工整、清楚。 3. 请严格按照答题卡上题号作答,在答题卡规定区域内书写答案,在试卷、草稿纸上答题无效。请保持答题卡清洁,不要折叠、污损。 4. 在试卷和草稿纸上准确填写姓名、教育ID号,本人所在年级、班级,格式:初一(X)班。
第I卷(选择题,共42分)
一、单选题(本题共14小题,每小题只有一个选项符合题意,每小题3分,共42分)
1.下列关于物质分类的叙述中,不正确的是( )
A.Na属于单质 B.Na2O属于氧化物
C.HClO属于酸 D.NaClO属于碱
2.下列化学用语表达正确的是
A.NaCl溶液导电 :NaCl=Na++Cl
B.氯气通入水中制备氯水:Cl2+H2O=2H++ClO-+Cl-
C.CO2通入苯酚钠溶液中出现浑浊:CO2+H2O+2C6H5O-→2 C6H5OH+CO
D.石灰水敞口存放,出现白色固体:2OH- + CO2 =CO+ H2O
3.室温下,下列各组离子在指定溶液中一定能大量存在的是
A.0.1mol/LNaOH溶液:Na+、K+、、
B.0.1mol/LFeCl2溶液:K+、Mg2+、、
C.0.1mol/LK2CO3溶液:Na+、Ba2+、Cl-、OH-
D.水电离的c(H+)=110-13mol/L溶液:K+、、、
4.下列古诗词描述的场景中发生的化学反应不属于氧化还原反应的是( )
A.爆竹声中一岁除——黑火药受热爆炸 B.烈火焚烧若等闲——石灰石分解
C.蜡炬成灰泪始干——石蜡的燃烧 D.炉火照天地,红星乱紫烟——铁的冶炼
5.下列实验中的颜色变化,与氧化还原反应无关的是
A.FeCl3溶液滴入Mg(OH)2浊液中,白色浑浊转化为红褐色沉淀
B.AgNO3溶液滴入氯水中,产生白色沉淀,随后淡黄绿色褪去
C.Na块放在坩埚里并加热,发出黄色火焰,生成淡黄色固体
D.H2C2O4溶液滴入KMnO4酸性溶液中,产生气泡,随后紫色褪去
6.下列试剂的保存方法中错误的是
A.少量的钠保存在煤油中 B.新制的氯水保存在棕色玻璃瓶中
C.NaOH溶液保存在带橡皮塞的玻璃瓶中 D.氢氟酸保存在玻璃瓶中
7.下列检验方法,利用该气体的还原性的是
A.使品红溶液褪色 B.遇到空气变为红棕色
C.使湿润的红色石蕊试纸变蓝 D.使湿润的淀粉碘化钾试纸变蓝
8.含硫煤燃烧会产生大气污染物,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是
A.该过程中可得到化工产品
B.该工艺流程是除去煤燃烧时产生的
C.该过程中化合价发生改变的元素只有O和S
D.图中涉及的反应之一为:
9.工业上利用反应检查氯气管道是否漏气。下列不正确的是
A.将浓氨水接近管道,若产生白烟说明管道漏气
B.的电子式为:
C.中只含有离子键
D.该反应中氧化剂和还原剂的物质的量之比为
10.合成氨及其相关工业中,部分物质间的转化关系如下:
下列说法不正确的是
A.甲、乙、丙三种物质中都含有氮元素
B.反应II、III和Ⅳ的氧化剂相同
C.VI的产物可在上述流程中被再次利用
D.V中发生反应:NH3 + CO2 + H2O + NaCl = NaHCO3↓+ NH4Cl
11.用下列装置进行分离提纯,主要利用的性质与物质溶解性无关的是
A B C D
从海水中获得蒸馏水 获取苯甲酸晶体 去除粗盐中的泥沙 用CCl4提取碘水中的I2
A.A B.B C.C D.D
12.下列性质的比较,不能用元素周期律解释的是
A.酸性:HClO4>H2SO3>H2SiO3 B.碱性:KOH>NaOH>LiOH
C.热稳定性:H2O>H2S>PH3 D.非金属性:F>O>N
13.下列化学用语或图示表达不正确的是
A.N2的结构式:N≡N B.Na+的结构示意图:
C.溴乙烷的分子模型: D.CO2的电子式:
14.室温下,1体积的水能溶解约40体积的SO2。用试管收集SO2后进行如下实验。对实验现象的分析正确的是
A.试管内液面上升,证明SO2与水发生了反应
B.试管中剩余少量气体,是因为SO2的溶解已达饱和
C.取出试管中的溶液,立即滴入紫色石蕊试液,溶液显红色,原因是:SO2+H2O H2SO3、H2SO3 H++、 H++
D.取出试管中溶液,在空气中放置一段时间后pH下降,是由于SO2挥发
第II卷(非选择题,共58分)
15.某工业铜沉淀渣主要成分为Cu、Cu2Se和Cu2Te,还含有Ag等稀贵金属。回收铜(CuSO4)、硒(Se)、碲(Te)的主要流程如图:
(1) “铜沉淀渣”中硒元素化合价为_______
(2)经过“硫酸化焙烧”,Cu、Cu2Se和Cu2Te转变为CuSO4,其中Cu2Te硫酸化焙烧反应如下,请补全方程式(横线写系数,括号内写化学式)
Cu2Te+ H2SO4=2CuSO4+ TeO2+_______( )+ H2O
(3)焙烧产生的SeO2、SO2与“吸收塔”中的H2O反应生成粗硒及某一含硫化合物,该含硫化合物化学式为_______
(4)“水浸固体”过程中补充少量NaCl固体,可减少固体中的银(Ag2SO4)进入浸出液中,结合化学用语,从平衡移动角度解释其原因_______
(5)“滤液2”经过_______、_______、过滤、洗涤、干燥可以得到硫酸铜晶体。(填操作名称)
(6)碲化镉薄膜电池是具有发展前景的太阳能技术之一。用如图装置可以完成碲的精炼。写出碱性条件下实现碲(Te)沉积的电极反应式 _______
16.琥珀酸亚铁,呈暗黄色,是市场上一种常见的补铁药物,该药品不溶于水但能溶于人体中的胃酸(主要成分为盐酸)。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
(1)试剂1是___________,试剂2是___________,加入新制氯水所发生的离子反应方程式是___________、___________。
(2)该同学猜想红色溶液褪色的原因是溶液中的Fe3+被还原为Fe2+,你认为该同学的猜想合理吗?___________,理由是___________;请设计一个简单的实验加以验证__________。
(3)该药品须密封保存,若表面出现颜色变化,说明部分Fe2+已变成Fe3+。药品中经常放入维生素C,可以延长保质期。请你解释原因___________。
17.小王同学在一次实验中发现:把新制氯水逐滴加到含有酚酞的氢氧化钠溶液中,当加到最后一滴时溶液的红色突然消失。
(1)将氯气通入水中发生反应的化学方程式为_______。
(2)氯水的颜色呈浅黄绿色,说明氯水中含有_______ ;向氯水中滴加AgNO3溶液,反应的离子方程式是_______。
(3)探究“溶液的红色突然消失”的原因:
①猜想
a:是氯水中的盐酸和次氯酸中和了 NaOH,使酚酞由红色变成无色;
b:是 _______。
②设计实验:往已褪色的溶液中连续滴加 NaOH溶液至过量,若现象为 _______,则证明“猜想 a”正确;若现象为_______,则证明“猜想 b”正确。
18.为纪念元素周期表诞生 150 周年,IUPAC 等从世界范围征集优秀青年化学家为化学元素代言,我国有8 位化学家成为硫(S)等元素的代言人。回答下列问题:
(1)S 在周期表中的位置是___________
(2)下列有关性质的比较,能用元素周期律解释的是___________(填字母序号)
a.非金属性:O>S
b.离子半径:S2->Cl-
c.酸性:H2SO4>H2SO3
d.酸性:H2SO4>H3PO4
(3)Se 与 S 位于同一主族,二者氢化物稳定性较强的是:___________(用化学式表示),用原子结构解释原因___________
(4)某同学用如下装置探究不同价态硫元素之间的转化。培养皿中 A、B、C 三个塑料瓶盖内盛有不同物质。向 Na2SO3 固体上滴加 70%硫酸,迅速用玻璃片将培养皿盖严,实验记录如下。
实验装置 瓶盖 物质 实验现象
A 蘸有品红溶液的棉花 品红溶液褪色
B HCl、BaCl2 的混合溶液 无明显变化
C HCl、BaCl2、FeCl3 的混合溶液 产生白色沉淀
能够说明硫元素由+4 价转化为+6 价的证据是___________
19.某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
(1)浓盐酸与MnO2混合加热生成氯气。氯气不再逸出时,固液混合物A中仍存在盐酸和MnO2。
①反应的离子方程式是_______。
②电极反应式:
i.还原反应:MnO2+2e-+4H+=Mn2++2H2O
ii.氧化反应:_______。
③根据电极反应式,分析A中仍存在盐酸和MnO2的原因。
i.随c(H+)降低或c(Mn2+)浓度升高,MnO2氧化性减弱。
ii.随c(Cl-)降低,_______。
④补充实验证实了③中的分析。
实验操作 试剂 产物
I 较浓H2SO4 有氯气
II a 有氯气
III a+b 无氯气
a是_______,b是_______。
(2)利用c(H+)浓度对MnO2氧化性的影响,探究卤素离子的还原性。相同浓度的KCl、KBr和KI溶液,能与MnO2反应所需的最低c(H+)由大到小的顺序是_______,从原子结构角度说明理由______________。
(3)根据(1)中结论推测:酸性条件下,加入某种化合物可以提高溴的氧化性,将Mn2+氧化为MnO2。经实验证实了推测,该化合物是_______。
(4)Ag分别与1mol·L1的盐酸、氢溴酸和氢碘酸混合,Ag只与氢碘酸发生置换反应,试解释原因:_______。
(5)总结:物质氧化性和还原性变化的一般规律是_______。
参考答案
第I卷(选择题)(共42分)
题号 1 2 3 4 5 6 7
答案 D A A B A D B
题号 8 9 10 11 12 13 14
答案 C C B A A D C
第二部分 非选择题(共58分)
15.(共10分)
(1)-2 (1分)
(2)Cu2Te+6H2SO4=2CuSO4+1TeO2+4SO2+6H2O (2分)
(3)H2SO4 (1分)
(4)Ag2SO4(s) Ag+(aq) + SO(aq),加入NaCl后Cl-与Ag+结合生成更难溶的AgCl,使c(Ag+)降低,进而减少了银进入溶液中. (2分)
(5)加热浓缩 (1分) 冷却结晶 (1分)
(6)TeO+4e-+3H2O=Te+6OH- (2分)
16.(共13分)
(1)稀盐酸(或HCl) (1分) KSCN溶液 (1分)
Cl2+2Fe2+=2Fe3++2Cl-(2分)、Fe3++3SCN-=Fe(SCN)3 (2分)
(2)不合理(1分) 氯水氧化性强,不会还原Fe3+ (2分) 向褪色后的溶液中加入FeCl3溶液,仍不变红色或者向褪色后的溶液中加入KSCN溶液,变红色 (2分)
(3)维生素C具有还原性,可将Fe3+还原为Fe2+(2分)
17.(共9分)
(1)Cl2+H2O HCl+HClO(2分)
(2)Cl2(1分) Ag++Cl-=AgCl↓ (2分)
(3)①氯水中的次氯酸有漂白性,使溶液由红色变为无色 (2分)
②溶液变红(1分) 溶液仍为无色 (1分)
18.(共9分)
(1)第三周期ⅥA族 (2分)
(2)a、b、d (2分)
(3) (1分) 核电荷数S
(4)A中品红溶液褪色说明有SO2生成,C中产出白色沉淀而B中无明显变化,证明SO2 (+4价)在C中转化为 (+6价) (2分)
19.(共17分)
(1)① MnO2+4H+ +2Cl- Mn2++Cl2↑ + 2H2O (2分)
② 2Cl--2e- =Cl2↑ (2分)
③Cl-还原性减弱或Cl2 的氧化性增强 (2分)
④KCl固体(或浓/饱和溶液) (1分) MnSO4固体(或浓/饱和溶液) (1分)
(2)KCl>KBr>KI (1分)
Cl、Br、I位于第VIIA族,从上到下电子层数逐渐增加,原子半径逐渐增大,得电子能力逐渐减弱,阴离子的还原性逐渐增强 (2分)
(3)AgNO3 或Ag2SO4(2分)
(4)比较AgX的溶解度,AgI 溶解度最小,Ag++I-= AgI↓使得Ag还原性增强的最多,使得2Ag+2H+=2Ag++ H2↑反应得以发生(2分)
(5)氧化剂(还原剂)的浓度越大,其氧化性(还原性)越强,还原产物(还原产物)的浓度越大,氧化剂(还原剂)的氧化性(还原性)越小;还原反应中,反应物浓度越大或生成物浓度越小,氧化剂氧化性越强。(2分) 1 / 3
同课章节目录
