5.2如何正确书写化学方程式基础过关--2021-2022学年九年级化学人教版上册(含解析)
文档属性
| 名称 | 5.2如何正确书写化学方程式基础过关--2021-2022学年九年级化学人教版上册(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 102.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-01 22:21:30 | ||
图片预览




文档简介
第五单元化学方程式课题2如何正确书写化学方程式基础过关九年级化学上册(人教版)
练习
一、单选题,共11小题
1.下列现象不能用质量守恒定律解释的是
A.木材燃烧,余下灰烬的质量小于原木材质量 B.铜丝在火焰上灼烧,灼烧后的“铜丝”质量增加
C.加热高锰酸钾,剩余固体质量减少 D.将一定质量的水冷凝后结成冰,质量不变
2.下列化学方程式书写正确的是
A. B.
C. D.
3.油中含有噻吩(用X表示),噻吩具有令人不愉快的气味,其燃烧时发生反应的化学方程式表示为:X+6O24CO2+SO2+2H2O,则噻吩的化学式为
A.CH4SO B.C4H4S C.C4H6S D.C4H8S
4.“二甘醇”在人体内可发生如下反应:C4H10O3+4O2=2X+3H2O。X的化学式为
A.C4H4O8 B.C2H4O4 C.C2H2O2 D.C2H2O4
5.抗击疫情,从我做起。84消毒液的制备原理是将氯气通入氢氧化钠溶液中,发生反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+X。用稀释过的84消毒液拖地后,房间内会有淡淡的氯气的刺激性气味,氯气有毒,应注意通风。下列有关说法不正确的是
A.X是H2O B.NaClO中Cl显+1价
C.NaClO是氧化物 D.氯气分子在不停地运动
6.工业上由粗硅生产纯硅的工艺流程如图所示,下列说法错误的是
A.步骤Ⅰ中发生的反应类型是化合反应
B.步骤Ⅱ利用物质熔点不同分离到得到纯净的SiCl4
C.步骤Ⅲ中需要隔绝空气,可能的原因是防止氢气爆炸
D.生产中,若有71t Cl2参与反应,理论上得到Si 的质量为28t(不考虑损耗)
7.关于化学方程式CH4+2O22H2O+CO2的描述中正确的是
A.甲烷加氧气在点燃的条件下等于二氧化碳加水
B.1个甲烷和2个氧气在点燃的条件下生成2个水和1个二氧化碳
C.1个甲烷分子和2个氧分子在点燃的条件下生成2个水分子和1个二氧化碳分子
D.1g甲烷和2g氧气在点燃的条件下生成2g水和1g二氧化碳
8.某化学反应的微观示意图如下(反应条件已省略),根据该图得出的结论正确的是
A.该反应属于分解反应 B.化学反应前后分子种类没有发生变化
C.四种物质中只有丁属于氧化物 D.参加反应的甲和生成的丁的分子个数比为2:3
9.下列关于化学反应的说法中,正确的是
A.反应前后质量守恒、体积守恒、分子数目守恒 B.反应物的质量总和等于生成物的质量总和
C.反应前后原子数目没有变,原子质量有变化 D.反应后生成了新物质,不是生成了新元素
10.下列化学方程式书写正确的是
A.4Fe+3O22Fe2O3 B.Cu+2HCl=CuCl2+H2
C.2H2O2H2+O2 D.4P+5O22P2O5
11.下列化学方程式书写及其反应类型正确的是
A. 分解反应
B. 化合反应
C. 还原反应
D. 化合反应
二、非选择题,共5小题
12.化学方程式
①_______;②_______;③_______;④_______;⑤_______。
13.根据已学知识判断下列反应方程式是否正确。如有错误,请改正。
(1)3Fe+2O2 ↑Fe3O4,______;
(2)Mg+O2MgO2,______;
(3)CH4+O2CO2 ↑+ H2O,______。
14.按要求完成下列反应的化学方程式。
(1)氢化钠是一种白色固体,化学式是NaH,它与水反应生成氢氧化钠和氢气。该反应的化学方程式是______
(2)高级汽车中常配置一种汽车安全气囊,内部贮存有硝酸铵。当汽车高速行驶中受到猛烈撞击时,硝酸铵迅速分解产生大量一氧化二氮气体和另一种氧化物充满气囊,隔在乘员和挡风玻璃、方向盘之间,防止乘员受伤。写出硝酸铵受撞击后发生分解的化学方程式______
15.化学无处不在,用恰当的化学用语填空。
(1)铵根离子__________。
(2)硫酸中的阴离子_______。
(3)碱溶液中都含有的阴离子____。
(4)发酵粉主要成分的化学式___。
(5)生成NaCl的中和反应的化学方程式___________。
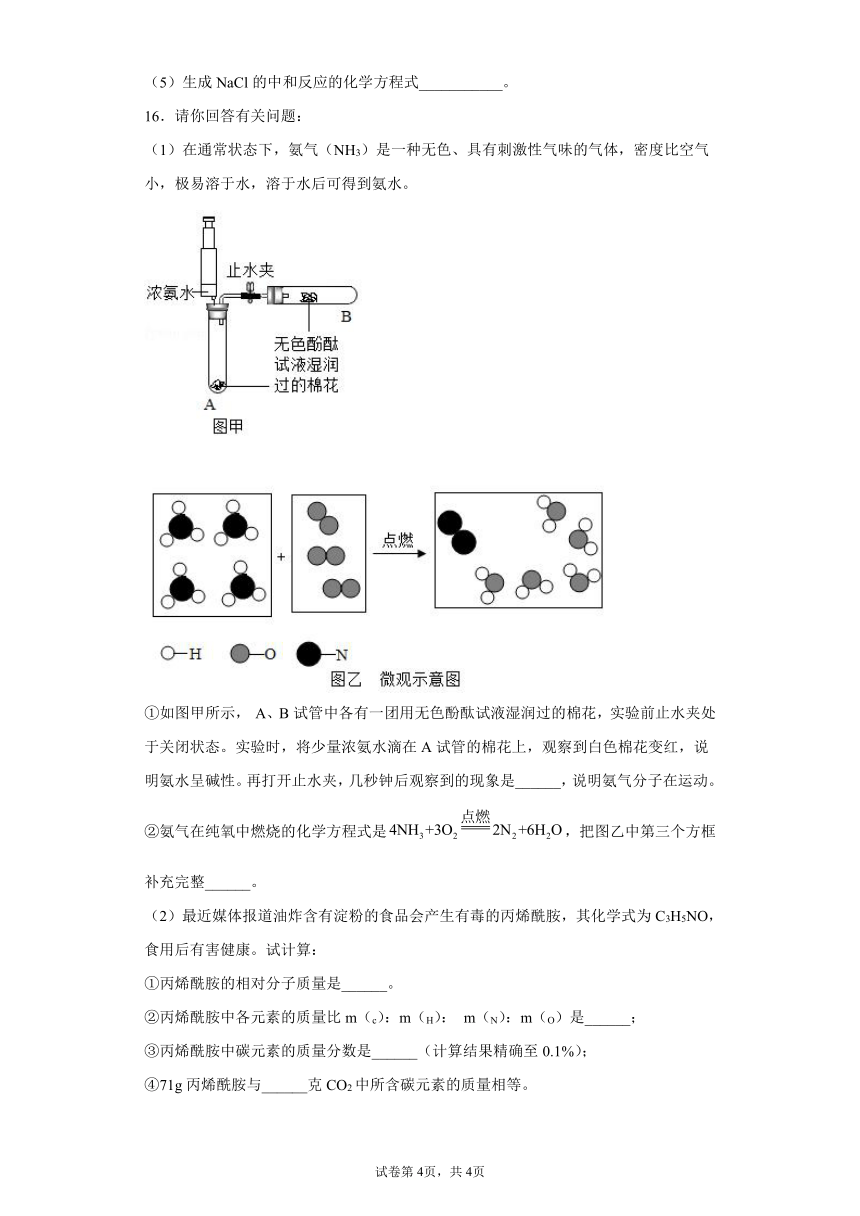
16.请你回答有关问题:
(1)在通常状态下,氨气(NH3)是一种无色、具有刺激性气味的气体,密度比空气小,极易溶于水,溶于水后可得到氨水。
①如图甲所示, A、B试管中各有一团用无色酚酞试液湿润过的棉花,实验前止水夹处于关闭状态。实验时,将少量浓氨水滴在A试管的棉花上,观察到白色棉花变红,说明氨水呈碱性。再打开止水夹,几秒钟后观察到的现象是______,说明氨气分子在运动。
②氨气在纯氧中燃烧的化学方程式是,把图乙中第三个方框补充完整______。
(2)最近媒体报道油炸含有淀粉的食品会产生有毒的丙烯酰胺,其化学式为C3H5NO,食用后有害健康。试计算:
①丙烯酰胺的相对分子质量是______。
②丙烯酰胺中各元素的质量比m(c):m(H): m(N):m(O)是______;
③丙烯酰胺中碳元素的质量分数是______(计算结果精确至0.1%);
④71g丙烯酰胺与______克CO2中所含碳元素的质量相等。
试卷第2页,共2页
试卷第1页,共1页
参考答案
1.D
【详解】
A、木材燃烧,余下灰烬的质量小于原木材质量,是因为生成的二氧化碳逸散到了空气中,该选项遵循质量守恒定律;
B、铜丝在火焰上灼烧,灼烧后的“铜丝”质量增加,是因为铜和空气中的氧气反应生成了氧化铜,该选项遵循质量守恒定律;
C、加热高锰酸钾,剩余固体质量减少,是因为反应生成的氧气逸出,该选项遵循质量守恒定律;
D、水冷凝后结成冰的过程没有发生化学变化,不能用质量守恒定律解释。
故选:D。
2.C
【详解】
A、反应物有固体时,反应生成的固体不需标注“↓”,该化学方程式书写错误;
B、铁在氧气中燃烧生成四氧化三铁,不生成氧化铁,该化学方程式书写错误;
C、过氧化氢在二氧化锰催化作用下分解生成水和氧气,该化学方程式书写正确;
D、反应物有气体时,反应生成的气体不需标注“↑”,该化学方程式书写错误。
故选:C。
3.B
【详解】
根据质量守恒定律:化学反应前后原子的数目不变,种类不变;反应后的碳、氧、硫、氢原子的个数分别为4,12,1,4,那反应前碳、氧、硫、氢原子的个数分别为4,12,1,4,则每个X分子中含有4个碳原子,1个硫原子,4个氢原子构成,所以X化学式为:C4H4S,故选B。
4.D
【详解】
根据质量守恒定律,化学反应前后,原子的种类和数目不变,反应物中含C、H、O的个数分别是4、10、11,生成物中含C、H、O的个数分别是0、6、3,故生成物中还应含4个C、4个H、8个O,故X的化学式为:C2H2O4。
故选D。
5.C
【详解】
A、根据质量守恒定律,化学反应前后,原子的种类和数目不变,反应物中含Cl、Na、O、H的个数分别是2、2、2、2,生成物中含Na、Cl、O、H的个数分别是2、2、1、0,故生成物中还应含1个O、2个H,故X的化学式为H2O,不符合题意;
B、NaClO中钠元素显+1价,氧元素显-2价,设氯元素的化合价为x,根据化合物中,正、负化合价的代数和为零,可得:(+1)+x+(-2)=0,x=+1,不符合题意;
C、NaClO由Na、Cl、O三种元素组成,不属于氧化物,符合题意;
D、氯气分子在不停地运动,故用稀释过的84消毒液拖地后,房间内会有淡淡的氯气的刺激性气味,不符合题意。
故选C。
6.B
【详解】
A、步骤Ⅰ中发生的反应为硅和氯气生成氯化硅,符合多变一特点,类型是化合反应,正确;
B、步骤Ⅱ利用物质沸点不同,蒸馏分离到得到纯净的SiCl4,错误;
C、氢气具有可燃性,步骤Ⅲ中需要隔绝空气,可能的原因是防止氢气爆炸,正确;
D、化学反应前后元素种类质量不变;SiCl4中硅、氯元素质量比为28:71,若有71t Cl2参与反应,理论上得到Si 的质量为28t(不考虑损耗),正确。
故选B。
7.C
【详解】
A、在反应中“+”读作“和”,“═”读应作“生成”,故选项读法错误。
B、从微观上,该反应可读作:点燃条件下,甲烷和氧气反应生成水和二氧化碳,故选项读法错误。
C、从微观上,1个甲烷分子和2个氧分子在点燃的条件下生成2个水分子和1个二氧化碳分子,故选项读法正确。
D、该反应可读作:每16份质量的甲烷和64份质量的氧气在点燃条件下恰好反应生成36份质量的水和44份质量的二氧化碳,故选项读法错误。
故选:C。
8.D
【分析】
由图可知,反应为氨气和氧气生成一氧化氮和水,;
【详解】
A. 该反应不是一变多的反应,不属于分解反应,错误;
B. 化学反应前后生成了新物质,分子种类发生了变化,错误;
C. 氧化物是含有两种元素一种为氧元素的化合物,四种物质中一氧化氮、水属于氧化物,错误;
D. 参加反应的甲和生成的丁的分子个数比为4:6=2:3,正确。
故选D。
9.D
【详解】
A、化学反应前后质量守恒,但体积和分子数目不一定守恒,选项不正确;
B、参加化学反应的物质质量总和等于生成物的质量总和,选项不正确;
C、化学反应前后原子数目没有变,原子质量也没有变化,选择不正确;
D、化学反应前后元素种类不变,反应后生成了新物质,不是生成了新元素,选项正确;
故选D。
10.D
【详解】
A、化学方程式为:3Fe+2O2Fe3O4,A错误。
B、铜和盐酸不反应,B错误。
C、化学方程式为:2H2O2H2↑+O2↑,C错误。
D、红磷燃烧,生成五氧化二磷,化学方程式正确。
故选:D。
11.D
【详解】
A、方程式中未标注气体符号,且反应条件错误,正确的化学方程式为:,该反应属于分解反应,错误;
B、该反应反应物有两种,生成物有两种,不符合化合反应“多变一”的特征,错误;
C、该反应的配平错误,正确的化学方程式为,该反应中碳、铜元素的化合价发生变化,既发生了氧化反应,也发生了还原反应,错误;
D、镁的点燃生成氧化镁,化学方程式为,该反应符合“多变一”属于化合反应,正确。
故选D。
12.化学式 反应物 生成物 反应条件 质量比
【详解】
定义:化学方程式式用化学式来表示化学反应的式子;
意义:化学方程式体现了①反应物、反应条件、生成物;②参与反应的微粒个数关系;③参与反应的各物质的质量关系。
故填:化学式、反应物、生成物、反应条件、质量比。
13.
(1)3Fe+2O2Fe3O4
(2)2Mg+O22MgO
(3)CH4 + 2O2CO2 + 2H2O
【分析】
(1)
气体状态符号使用错误,正确的为3Fe+2O2Fe3O4。
(2)
氧化镁化学式错误,正确的为2Mg+O22MgO。
(3)
气体状态符号使用错误、且没有配平错误,正确的为CH4 + 2O2CO2 + 2H2O。
14.
(1)NaH+H2O=NaOH+H2↑
(2)NH4NO3N2O↑+2H2O
【分析】
(1)
氢化钠和水反应生成氢氧化钠和氢气,反应的化学方程式:NaH+H2O=NaOH+H2↑;
(2)
由题意,当汽车高速行驶中受到猛烈撞击时,硝酸铵迅速分解产生的大量一氧化二氮(N2O)气体和水蒸气,反应的化学方程式为:NH4NO3N2O↑+2H2O。
15.
(1)
(2)
(3)OH-
(4)NaHCO3
(5)NaOH+HCl═NaCl+H2O
【分析】
(1)
书写离子符号时,先在相应的元素符号的右上角写出离子所带电荷的数目,再写出电荷的电性,电荷数为1时,1省略不写,1个铵根离子带1个单位的正电荷,故铵根离子的符号写为。
(2)
硫酸中的阴离子是硫酸根离子,书写离子符号时,先在相应的元素符号的右上角写出离子所带电荷的数目,再写出电荷的电性,1个硫酸根离子带2个单位的负电荷,故硫酸根离子的符号写为。
(3)
碱溶液中都含有的阴离子是氢氧根离子,书写离子符号时,先在相应的元素符号的右上角写出离子所带电荷的数目,再写出电荷的电性,电荷数为1时,1省略不写,1个氢氧根离子带1个单位的负电荷,故氢氧根离子的符号写为OH-。
(4)
发酵粉主要成分是碳酸氢钠,碳酸氢钠由钠离子与碳酸氢根离子构成,其中钠元素的化合价为+1价,碳酸氢根的化合价为-1价,根据化合物中各元素的化合价的代数和为零,碳酸氢钠的化学式写为NaHCO3,故填NaHCO3。
(5)
生成NaCl的中和反应是氢氧化钠与盐酸反应生成氯化钠和水,故反应的化学方程式写为:NaOH+HCl═NaCl+H2O。
16.
(1) B试管中白色棉花变红
(2) 71 36:5:14:16 50.7% 132
【分析】
(1)
①浓氨水具有挥发性,挥发出的氨分子不断运动,当运动到B试管中的棉花上时,氨气溶于水形成氨水,氨水显碱性,能使无色酚酞试液变红,故几分钟后观察到:B试管中白色棉花变红;
②由化学方程式可知,4个氨分子和3个氧分子在点燃的条件下反应生成2个氮分子和6个水分子,故图乙中第三个方框还缺少1个氮分子、1个水分子,将图补充完整为: ;
(2)
①丙烯酰胺的相对分子质量是:12×3+5+14+16=71;
②丙烯酰胺中各元素的质量比m(C):m(H): m(N):m(O)是:(12×3):5:14:16=36:5:14:16;
③丙烯酰胺中碳元素的质量分数是:;
④解:设与71g丙烯酰胺中碳元素的质量相等的二氧化碳的质量为x,则:, x=132g。答案第1页,共2页
答案第1页,共2页
练习
一、单选题,共11小题
1.下列现象不能用质量守恒定律解释的是
A.木材燃烧,余下灰烬的质量小于原木材质量 B.铜丝在火焰上灼烧,灼烧后的“铜丝”质量增加
C.加热高锰酸钾,剩余固体质量减少 D.将一定质量的水冷凝后结成冰,质量不变
2.下列化学方程式书写正确的是
A. B.
C. D.
3.油中含有噻吩(用X表示),噻吩具有令人不愉快的气味,其燃烧时发生反应的化学方程式表示为:X+6O24CO2+SO2+2H2O,则噻吩的化学式为
A.CH4SO B.C4H4S C.C4H6S D.C4H8S
4.“二甘醇”在人体内可发生如下反应:C4H10O3+4O2=2X+3H2O。X的化学式为
A.C4H4O8 B.C2H4O4 C.C2H2O2 D.C2H2O4
5.抗击疫情,从我做起。84消毒液的制备原理是将氯气通入氢氧化钠溶液中,发生反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+X。用稀释过的84消毒液拖地后,房间内会有淡淡的氯气的刺激性气味,氯气有毒,应注意通风。下列有关说法不正确的是
A.X是H2O B.NaClO中Cl显+1价
C.NaClO是氧化物 D.氯气分子在不停地运动
6.工业上由粗硅生产纯硅的工艺流程如图所示,下列说法错误的是
A.步骤Ⅰ中发生的反应类型是化合反应
B.步骤Ⅱ利用物质熔点不同分离到得到纯净的SiCl4
C.步骤Ⅲ中需要隔绝空气,可能的原因是防止氢气爆炸
D.生产中,若有71t Cl2参与反应,理论上得到Si 的质量为28t(不考虑损耗)
7.关于化学方程式CH4+2O22H2O+CO2的描述中正确的是
A.甲烷加氧气在点燃的条件下等于二氧化碳加水
B.1个甲烷和2个氧气在点燃的条件下生成2个水和1个二氧化碳
C.1个甲烷分子和2个氧分子在点燃的条件下生成2个水分子和1个二氧化碳分子
D.1g甲烷和2g氧气在点燃的条件下生成2g水和1g二氧化碳
8.某化学反应的微观示意图如下(反应条件已省略),根据该图得出的结论正确的是
A.该反应属于分解反应 B.化学反应前后分子种类没有发生变化
C.四种物质中只有丁属于氧化物 D.参加反应的甲和生成的丁的分子个数比为2:3
9.下列关于化学反应的说法中,正确的是
A.反应前后质量守恒、体积守恒、分子数目守恒 B.反应物的质量总和等于生成物的质量总和
C.反应前后原子数目没有变,原子质量有变化 D.反应后生成了新物质,不是生成了新元素
10.下列化学方程式书写正确的是
A.4Fe+3O22Fe2O3 B.Cu+2HCl=CuCl2+H2
C.2H2O2H2+O2 D.4P+5O22P2O5
11.下列化学方程式书写及其反应类型正确的是
A. 分解反应
B. 化合反应
C. 还原反应
D. 化合反应
二、非选择题,共5小题
12.化学方程式
①_______;②_______;③_______;④_______;⑤_______。
13.根据已学知识判断下列反应方程式是否正确。如有错误,请改正。
(1)3Fe+2O2 ↑Fe3O4,______;
(2)Mg+O2MgO2,______;
(3)CH4+O2CO2 ↑+ H2O,______。
14.按要求完成下列反应的化学方程式。
(1)氢化钠是一种白色固体,化学式是NaH,它与水反应生成氢氧化钠和氢气。该反应的化学方程式是______
(2)高级汽车中常配置一种汽车安全气囊,内部贮存有硝酸铵。当汽车高速行驶中受到猛烈撞击时,硝酸铵迅速分解产生大量一氧化二氮气体和另一种氧化物充满气囊,隔在乘员和挡风玻璃、方向盘之间,防止乘员受伤。写出硝酸铵受撞击后发生分解的化学方程式______
15.化学无处不在,用恰当的化学用语填空。
(1)铵根离子__________。
(2)硫酸中的阴离子_______。
(3)碱溶液中都含有的阴离子____。
(4)发酵粉主要成分的化学式___。
(5)生成NaCl的中和反应的化学方程式___________。
16.请你回答有关问题:
(1)在通常状态下,氨气(NH3)是一种无色、具有刺激性气味的气体,密度比空气小,极易溶于水,溶于水后可得到氨水。
①如图甲所示, A、B试管中各有一团用无色酚酞试液湿润过的棉花,实验前止水夹处于关闭状态。实验时,将少量浓氨水滴在A试管的棉花上,观察到白色棉花变红,说明氨水呈碱性。再打开止水夹,几秒钟后观察到的现象是______,说明氨气分子在运动。
②氨气在纯氧中燃烧的化学方程式是,把图乙中第三个方框补充完整______。
(2)最近媒体报道油炸含有淀粉的食品会产生有毒的丙烯酰胺,其化学式为C3H5NO,食用后有害健康。试计算:
①丙烯酰胺的相对分子质量是______。
②丙烯酰胺中各元素的质量比m(c):m(H): m(N):m(O)是______;
③丙烯酰胺中碳元素的质量分数是______(计算结果精确至0.1%);
④71g丙烯酰胺与______克CO2中所含碳元素的质量相等。
试卷第2页,共2页
试卷第1页,共1页
参考答案
1.D
【详解】
A、木材燃烧,余下灰烬的质量小于原木材质量,是因为生成的二氧化碳逸散到了空气中,该选项遵循质量守恒定律;
B、铜丝在火焰上灼烧,灼烧后的“铜丝”质量增加,是因为铜和空气中的氧气反应生成了氧化铜,该选项遵循质量守恒定律;
C、加热高锰酸钾,剩余固体质量减少,是因为反应生成的氧气逸出,该选项遵循质量守恒定律;
D、水冷凝后结成冰的过程没有发生化学变化,不能用质量守恒定律解释。
故选:D。
2.C
【详解】
A、反应物有固体时,反应生成的固体不需标注“↓”,该化学方程式书写错误;
B、铁在氧气中燃烧生成四氧化三铁,不生成氧化铁,该化学方程式书写错误;
C、过氧化氢在二氧化锰催化作用下分解生成水和氧气,该化学方程式书写正确;
D、反应物有气体时,反应生成的气体不需标注“↑”,该化学方程式书写错误。
故选:C。
3.B
【详解】
根据质量守恒定律:化学反应前后原子的数目不变,种类不变;反应后的碳、氧、硫、氢原子的个数分别为4,12,1,4,那反应前碳、氧、硫、氢原子的个数分别为4,12,1,4,则每个X分子中含有4个碳原子,1个硫原子,4个氢原子构成,所以X化学式为:C4H4S,故选B。
4.D
【详解】
根据质量守恒定律,化学反应前后,原子的种类和数目不变,反应物中含C、H、O的个数分别是4、10、11,生成物中含C、H、O的个数分别是0、6、3,故生成物中还应含4个C、4个H、8个O,故X的化学式为:C2H2O4。
故选D。
5.C
【详解】
A、根据质量守恒定律,化学反应前后,原子的种类和数目不变,反应物中含Cl、Na、O、H的个数分别是2、2、2、2,生成物中含Na、Cl、O、H的个数分别是2、2、1、0,故生成物中还应含1个O、2个H,故X的化学式为H2O,不符合题意;
B、NaClO中钠元素显+1价,氧元素显-2价,设氯元素的化合价为x,根据化合物中,正、负化合价的代数和为零,可得:(+1)+x+(-2)=0,x=+1,不符合题意;
C、NaClO由Na、Cl、O三种元素组成,不属于氧化物,符合题意;
D、氯气分子在不停地运动,故用稀释过的84消毒液拖地后,房间内会有淡淡的氯气的刺激性气味,不符合题意。
故选C。
6.B
【详解】
A、步骤Ⅰ中发生的反应为硅和氯气生成氯化硅,符合多变一特点,类型是化合反应,正确;
B、步骤Ⅱ利用物质沸点不同,蒸馏分离到得到纯净的SiCl4,错误;
C、氢气具有可燃性,步骤Ⅲ中需要隔绝空气,可能的原因是防止氢气爆炸,正确;
D、化学反应前后元素种类质量不变;SiCl4中硅、氯元素质量比为28:71,若有71t Cl2参与反应,理论上得到Si 的质量为28t(不考虑损耗),正确。
故选B。
7.C
【详解】
A、在反应中“+”读作“和”,“═”读应作“生成”,故选项读法错误。
B、从微观上,该反应可读作:点燃条件下,甲烷和氧气反应生成水和二氧化碳,故选项读法错误。
C、从微观上,1个甲烷分子和2个氧分子在点燃的条件下生成2个水分子和1个二氧化碳分子,故选项读法正确。
D、该反应可读作:每16份质量的甲烷和64份质量的氧气在点燃条件下恰好反应生成36份质量的水和44份质量的二氧化碳,故选项读法错误。
故选:C。
8.D
【分析】
由图可知,反应为氨气和氧气生成一氧化氮和水,;
【详解】
A. 该反应不是一变多的反应,不属于分解反应,错误;
B. 化学反应前后生成了新物质,分子种类发生了变化,错误;
C. 氧化物是含有两种元素一种为氧元素的化合物,四种物质中一氧化氮、水属于氧化物,错误;
D. 参加反应的甲和生成的丁的分子个数比为4:6=2:3,正确。
故选D。
9.D
【详解】
A、化学反应前后质量守恒,但体积和分子数目不一定守恒,选项不正确;
B、参加化学反应的物质质量总和等于生成物的质量总和,选项不正确;
C、化学反应前后原子数目没有变,原子质量也没有变化,选择不正确;
D、化学反应前后元素种类不变,反应后生成了新物质,不是生成了新元素,选项正确;
故选D。
10.D
【详解】
A、化学方程式为:3Fe+2O2Fe3O4,A错误。
B、铜和盐酸不反应,B错误。
C、化学方程式为:2H2O2H2↑+O2↑,C错误。
D、红磷燃烧,生成五氧化二磷,化学方程式正确。
故选:D。
11.D
【详解】
A、方程式中未标注气体符号,且反应条件错误,正确的化学方程式为:,该反应属于分解反应,错误;
B、该反应反应物有两种,生成物有两种,不符合化合反应“多变一”的特征,错误;
C、该反应的配平错误,正确的化学方程式为,该反应中碳、铜元素的化合价发生变化,既发生了氧化反应,也发生了还原反应,错误;
D、镁的点燃生成氧化镁,化学方程式为,该反应符合“多变一”属于化合反应,正确。
故选D。
12.化学式 反应物 生成物 反应条件 质量比
【详解】
定义:化学方程式式用化学式来表示化学反应的式子;
意义:化学方程式体现了①反应物、反应条件、生成物;②参与反应的微粒个数关系;③参与反应的各物质的质量关系。
故填:化学式、反应物、生成物、反应条件、质量比。
13.
(1)3Fe+2O2Fe3O4
(2)2Mg+O22MgO
(3)CH4 + 2O2CO2 + 2H2O
【分析】
(1)
气体状态符号使用错误,正确的为3Fe+2O2Fe3O4。
(2)
氧化镁化学式错误,正确的为2Mg+O22MgO。
(3)
气体状态符号使用错误、且没有配平错误,正确的为CH4 + 2O2CO2 + 2H2O。
14.
(1)NaH+H2O=NaOH+H2↑
(2)NH4NO3N2O↑+2H2O
【分析】
(1)
氢化钠和水反应生成氢氧化钠和氢气,反应的化学方程式:NaH+H2O=NaOH+H2↑;
(2)
由题意,当汽车高速行驶中受到猛烈撞击时,硝酸铵迅速分解产生的大量一氧化二氮(N2O)气体和水蒸气,反应的化学方程式为:NH4NO3N2O↑+2H2O。
15.
(1)
(2)
(3)OH-
(4)NaHCO3
(5)NaOH+HCl═NaCl+H2O
【分析】
(1)
书写离子符号时,先在相应的元素符号的右上角写出离子所带电荷的数目,再写出电荷的电性,电荷数为1时,1省略不写,1个铵根离子带1个单位的正电荷,故铵根离子的符号写为。
(2)
硫酸中的阴离子是硫酸根离子,书写离子符号时,先在相应的元素符号的右上角写出离子所带电荷的数目,再写出电荷的电性,1个硫酸根离子带2个单位的负电荷,故硫酸根离子的符号写为。
(3)
碱溶液中都含有的阴离子是氢氧根离子,书写离子符号时,先在相应的元素符号的右上角写出离子所带电荷的数目,再写出电荷的电性,电荷数为1时,1省略不写,1个氢氧根离子带1个单位的负电荷,故氢氧根离子的符号写为OH-。
(4)
发酵粉主要成分是碳酸氢钠,碳酸氢钠由钠离子与碳酸氢根离子构成,其中钠元素的化合价为+1价,碳酸氢根的化合价为-1价,根据化合物中各元素的化合价的代数和为零,碳酸氢钠的化学式写为NaHCO3,故填NaHCO3。
(5)
生成NaCl的中和反应是氢氧化钠与盐酸反应生成氯化钠和水,故反应的化学方程式写为:NaOH+HCl═NaCl+H2O。
16.
(1) B试管中白色棉花变红
(2) 71 36:5:14:16 50.7% 132
【分析】
(1)
①浓氨水具有挥发性,挥发出的氨分子不断运动,当运动到B试管中的棉花上时,氨气溶于水形成氨水,氨水显碱性,能使无色酚酞试液变红,故几分钟后观察到:B试管中白色棉花变红;
②由化学方程式可知,4个氨分子和3个氧分子在点燃的条件下反应生成2个氮分子和6个水分子,故图乙中第三个方框还缺少1个氮分子、1个水分子,将图补充完整为: ;
(2)
①丙烯酰胺的相对分子质量是:12×3+5+14+16=71;
②丙烯酰胺中各元素的质量比m(C):m(H): m(N):m(O)是:(12×3):5:14:16=36:5:14:16;
③丙烯酰胺中碳元素的质量分数是:;
④解:设与71g丙烯酰胺中碳元素的质量相等的二氧化碳的质量为x,则:, x=132g。答案第1页,共2页
答案第1页,共2页
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
