山东省济南市莱芜区凤城高级中学2021-2022学年高二上学期期中考试化学试卷(Word版含答案)
文档属性
| 名称 | 山东省济南市莱芜区凤城高级中学2021-2022学年高二上学期期中考试化学试卷(Word版含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 994.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-05 13:43:52 | ||
图片预览



文档简介
凤城高级中学2021-2022学年度第一学期期中考试
高二化学试题
考试时间:75分钟 满分:100分
可能用到的相对原子质量:H1 C 12 N14 O16 Na23 Cl 35.5 Ga70
第Ⅰ卷(45分)
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与生活密切相关。下列说法错误的是
A.打开啤酒倒入杯中立即产生大量气泡,压强减小促使碳酸分解为CO2而大量逸出
B.絮凝剂有助于去除生活废水中的悬浮物, CaSO4 2H2O, KAl(SO4)2 12H2O均可作为絮凝剂
C.用高压氧舱治疗CO中毒利用了勒夏特列原理
D.草木灰和氨态氮肥不能混施
2.已知反应CO(g)+H2O(g)CO2(g)+H2(g) ΔH<0。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是
A.升高温度,K减小 B.减小压强,n(CO2)增加
C.更换高效催化剂,α(CO)增大 D.充入一定量的氮气,n(H2)减小
3. NA代表阿伏加德罗常数的值,下列叙述正确的是
A.Cu与浓硝酸反应生成9.2g NO2和N2O4混合气体时,转移电子数为0.2NA
B.60 g乙酸与足量乙醇发生酯化反应,充分反应后断裂的C-O键数目为NA
C.在1L 0.1 mol/L的Na2CO3溶液中,阴离子总数小于0.1 NA
D.标准状况下22.4LCl2完全溶于水,所得溶液中含氯微粒的总数为2NA
4.如图所示为接触法制硫酸的设备和工艺流程,接触室发生反应的热化学方程式表示为:
2SO2(g)+O2(g) 2SO3(g)△H= -196.6kJ·mol—1。下列说法不正确的是
A.黄铁矿进入沸腾炉之前需要进行粉碎,是为了增大反应物的接触面积,加快反应速率,并且可以提高原料的转化率
B.沸腾炉流出的气体必须经过净化,并补充适量空气,再进入接触室
C.工业生产要求高效,为加快反应速率,接触氧化应使用催化剂并尽可能提高体系温度
D.工业制硫酸的尾气大量排放至空气中会形成酸雨
5.下列说法不正确的是
A.已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol,假设1 mol冰中有2 mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键
B.已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol,则HCl和NH3·H2O反应生成1molH2O(1)时放出热量大于57.3 kJ
C.己知:正丁烷(g)=异丁烷(g) △ H<0,则异丁烷比正丁烷稳定
D.可以通过测定C(石墨,s)和CO(g)的燃烧热间接计算C(石墨,s)+O2(g)= CO(g)的反应热
6. 25℃时,下列溶液的关系式正确的是
A.在等体积的 ① 0.05mol/L的Ba(OH)2溶液,②pH=10的Na2S溶液中,发生电离的水的物质的量之比是1:10
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. pH=2的H2SO3溶液与pH=12的NaOH溶液任意比例混合:
c(Na+)+c(H+)=c(OH-)+c(HSO3-)
D. pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
7.下列指定反应的离子方程式正确的是
A. 将FeCl3溶液加入NH4HCO3溶液中: 2Fe3++6 HCO3-=Fe2(CO3)3↓+3CO2↑+3H2O
B. 向NaAlO2溶液中加入NaHCO3溶液:HCO3-+AlO2-+H2O=CO2↑+Al(OH)3↓
C. Cl2通入FeI2溶液中,可能存在反应:4Cl2+6I-+2Fe2+=2Fe3++3I2+8Cl-
D.同浓度同体积的NH4HSO4溶液与NaOH溶液混合:NH4++OH-=NH3·H2O
8.已知反应: 2NO(g)+Br2(g) 2NOBr(g) ΔH=-a kJ·mol-1(a>0),其反应机理如下
①NO(g)+Br2(g) NOBr2(g) 快
②NO(g)+NOBr2(g) 2NOBr(g) 慢
下列有关该反应的说法正确的是
A.该反应的速率主要取决于①的快慢
B.NOBr2是该反应的催化剂
C.正反应的活化能比逆反应的活化能小a kJ·mol-1
D.增大 Br2(g)浓度能增大活化分子百分数, 加快反应速率
9.某同学通过实验研究铜盐溶液颜色的变化。下列说法不正确的是
A.由①②可知,②中溶液呈蓝色是Cu2+与水分子作用的结果
B.由④可知,Cu2+与Cl 可能会结合产生黄色物质
C.由③④可知,Cl 的浓度对铜盐溶液的颜色有影响
D.由②③④可知,CuCl2溶液一定为绿色
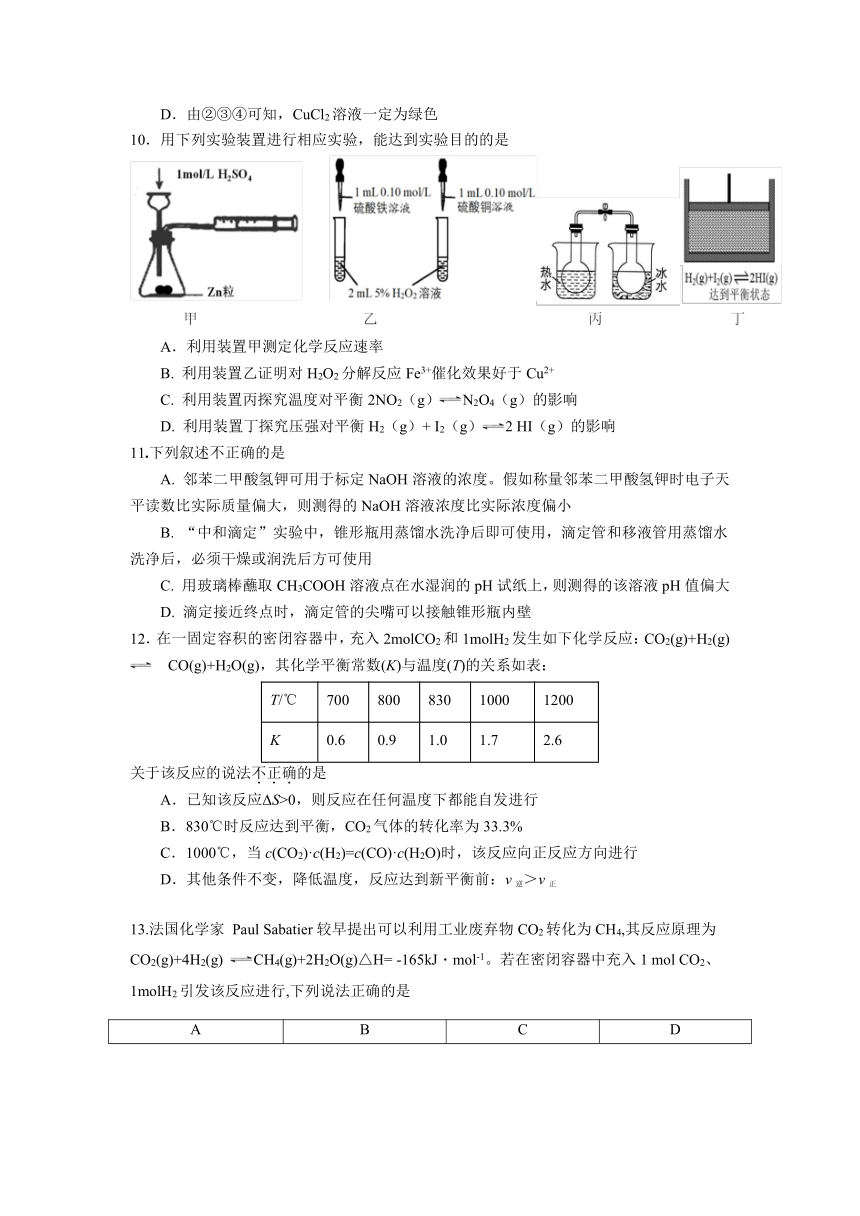
10.用下列实验装置进行相应实验,能达到实验目的的是
A.利用装置甲测定化学反应速率
B. 利用装置乙证明对H2O2分解反应Fe3+催化效果好于Cu2+
C. 利用装置丙探究温度对平衡2NO2(g)N2O4(g)的影响
D. 利用装置丁探究压强对平衡H2(g)+ I2(g)2 HI(g)的影响
11.下列叙述不正确的是
A. 邻苯二甲酸氢钾可用于标定NaOH溶液的浓度。假如称量邻苯二甲酸氢钾时电子天平读数比实际质量偏大,则测得的NaOH溶液浓度比实际浓度偏小
B. “中和滴定”实验中,锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,必须干燥或润洗后方可使用
C. 用玻璃棒蘸取CH3COOH溶液点在水湿润的pH试纸上,则测得的该溶液pH值偏大
D. 滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁
12.在一固定容积的密闭容器中,充入2molCO2和1molH2发生如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数(K)与温度(T)的关系如表:
T/℃ 700 800 830 1000 1200
K 0.6 0.9 1.0 1.7 2.6
关于该反应的说法不正确的是
A.已知该反应ΔS>0,则反应在任何温度下都能自发进行
B.830℃时反应达到平衡,CO2气体的转化率为33.3%
C.1000℃,当c(CO2)·c(H2)=c(CO)·c(H2O)时,该反应向正反应方向进行
D.其他条件不变,降低温度,反应达到新平衡前:v逆>v正
13.法国化学家 Paul Sabatier较早提出可以利用工业废弃物CO2转化为CH4,其反应原理为CO2(g)+4H2(g) CH4(g)+2H2O(g)△H= -165kJ mol-1。若在密闭容器中充入1 mol CO2、1molH2引发该反应进行,下列说法正确的是
A B C D
恒温恒容下,混合气体中CH4与CO2的体积分数变化 恒温恒压条件平衡后,t1时改变条件可能是充入少量N2 升高温度,平衡常数Kc的变化趋势 CO2平衡转化率随压强的变化趋势
14. 部分弱电解质的电离平衡常数如下表:
弱电解质 HCOOH HCN NH3·H2O H2CO3
电离平衡常数(25 ℃) Ka=1.8×10-4 Ka=4.9×10-10 Kb=1.8×10-5 Ka1=4.5×10-7Ka2=4.7×10-11
25 ℃时,下列说法错误的是
A.浓度均为0.1mol·L-1的HCN和NaCN混合溶液中:c(HCN)>c(CN-)
B.0.1 mol/L的HCOONH4溶液中存在以下关系式:c(HCOO-)>c(NH)>c(H+)>c(OH-)
C.pH=3的盐酸与pH=11的氨水混合,若溶液显中性,则混合前两者的体积大小:V(盐酸)>V(氨水)
D.少量CO2通入NaCN溶液中发生反应:2CN-+CO2+H2O=CO32-+2HCN
15.常温下,用如图1所示装置,分别向25 mL 0.3 mol·L 1 Na2CO3溶液和25 mL 0.3 mol·L 1 NaHCO3溶液中逐滴滴加0.3 mol·L 1稀盐酸,用压强传感器测得压强随盐酸体积的变化曲线如图2所示,下列说法正确的是
A.X曲线为Na2CO3溶液的滴定曲线
B.b点溶液的pH大于c点溶液的pH
C.a点溶液中:c(HCO3-)>c(CO32-)>c(H2CO3)
D.b、d两点水的电离程度相等
第Ⅱ卷(55分)
二、填空题(本题包括4个小题,共55分)
16.(14分)
氢气在富氧条件下催化还原 NOx(H2-SCR)反应在低温时仍具有高活性和选择性,近年来一直备受研究学者关注。回答下列问题:
(1)已知催化剂铑(Rh)表面 H2催化还原NO的详细反应机理如下表所示,其他条件一定时,决定 H2催化还原NO反应速率的基元反应为 , 基元反应H2+Rh(s)+Rh(s) H(s)+H(s)的焓变ΔH= kJ/mol-1.
(2)浸渍法合成的 Pt/Al-M-10-A催化剂对H2还原NO反应的影响如上图所示,由图可知该催化剂对反应产物具有 ,该性质受 的影响。
(3)将H2、NO、O2按体积比3:2:1充入恒温恒压(200℃、100 kPa容器中,发生反应:
4H2(g)+2NO(g) +O 2(g)N2(g)+4H2O(g),达平衡时,N2的体积分数为0.1。平衡时,NO的转化率为 平衡常数Kp= (kPa)-2(以平衡分压表示,平衡分压=平衡总压×物质的量分数)。
(4)利用CH4催化还原NO的反应:CH4(g)+ 4NO(g)CO2 + 2N2(g)+ 2H2O(g),向一个装有催化剂的体积不变密闭容器中通入一定量的CH4和NO发生反应,测得反应速率和温度的关系如图甲所示,BC段反应速率降低的原因可能是
若该反应在一定温度下达到平衡后,将容器压缩,容器内CH4的平衡转化率为a,测定结果如图乙所示,试分析a随压强增大,开始不变,一定程度后逐渐增大的原因是
17. (14分)学习小组在实验室中利用下图所示装置制备SO2并进行相关性质的探究。
回答下列问题:
(1)仪器Q的名称为 ;
(2)装置a中反应的化学方程式为 。
(3)装置e中紫色溶液变浅至褪色可证明SO2具有 。
(4)实验开始后,发现装置d中的溶液迅速变黄,继续通入SO2,装置d中出现乳黄色浑浊。该小组同学查阅资料得知,存在可逆反应:SO2+4I-+4H+S↓+2I2+2H2O.
探究I:探究浓度对上述可逆反应的影响
有同学认为除SO2的浓度外,其他离子的浓度对该可逆反应也有影响。完成实验设计进行验证(SO2体积已折算为标准状况下体积)。
限选试剂:0.1 mol·L-1KI溶液、1.0mol·L-1KI溶液、2.0mol·L-1KI溶液、蒸馏水、浓硝酸、浓盐酸
影响因素 编号 操作 现象
c(I- ) i 取50 mL①_ 于锥形瓶中,向其中通入20 mL SO2 溶液变为浅黄色
ii 取50 mL 1.0 mol·L-1KI溶液于锥形瓶中,向其中通入20 mL SO2 溶液迅速变黄
c(H+) ⅲ 取50 mL1.0 mol·L-1KI溶液和5 mL蒸馏水于锥形瓶中,向其中通入20 mL SO2 溶液迅速变黄
iv 取50 mL 1.0 mol·L-1KI溶液和5 mL②_ 于锥形瓶中,向其中通入20 mL SO2 溶液迅速变黄,且出现乳黄色浑浊
探究II:探究SO2在KI溶液体系中的反应产物
有同学提出上述可逆反应生成的I2可与SO2发生反应:SO2+I2+2H2O=SO42-+2I-+4H+.为进一步探究体系中的产物,完成下列实验方案。
方案 操作 预期现象 结论
i 取适量装置d中浊液,向其中滴加几滴③ 溶液(填试剂名称),振荡 无明显变化 浊液中无l2
ii 将装置d中浊液进行分离 得淡黄色固体和澄清溶液
取适量分离后的澄清溶液于试管中,④ 出现白色沉淀 产物中含有SO42-
⑤综上可知,SO2在KI溶液中发生了歧化反应,其反应的离子方程式为 。
18.(14分)CIGS靶材是一种主要含铜、镓(Ga)、铟(In)、硒(Se)的合金,由于其良好的电学传导和光学透明性能,被广泛运用在薄膜太阳能电池领域。实验室设计从废弃CIGS中回收稀散金属铟和镓的氯化物(性质类似于AlCl3)的流程图:
已知:
I.“溶解”步骤所得溶液中含有Cu2+、In3+、Ga3+和H2SeO3。
II.“减压蒸馏”步骤中得到InCl3·xH2O和GaCl3·yH2O固体混合物。
回答下列问题:
(1)镓位于元素周期表第四周期IIIA族,则其原子结构示意图为 。
(2)“溶解”过程中生成Ga3+的离子方程式为 和2Ga+6H+=2Ga3++3H2↑;溶解温度控制在30℃左右,温度不宜过高的原因是 。利用王水也能溶解CIGS,试分析以王水代替HCl和H2O2的缺点是 (答出一点即可)。
(3)SOCl2与水反应,液面上有白雾形成,并生成一种能使品红溶液褪色的气体,SOCl2与水反应的方程式为: ,则“加热回流”步骤中加入SOCl2的目的除了脱水外,还有 。
(4)取m g CIGS靶材(其中镓的质量分数为a%),按上述流程进行实验,最终得到纯度为b%的GaCl3固体n g,则镓元素的回收率为______ 。(用含m、n、a、b的代数式表示)。
19.(13分)合成氨技术的创立开辟了人工固氮的重要途径,通常用以铁为主的催化剂在400~500℃和10~30MPa的条件下,由氮气和氢气直接合成氨。
(1)“哈伯法”合成氨的反应: △H,相关键能数据如下表:
①△H=_________kJ mol-1。
②在恒温恒容密闭容器中进行的工业合成氨反应,下列能表示达到平衡状态的是________(填序号)。
A.单位时间内断开3a个H—H键的同时形成6a个N—H 键
B.混合气体的平均相对分子质量不再发生变化
C.混合气体的密度不再发生变化
D.反应容器中N2、NH3的物质的量的比值不再发生变化
③工业生产必须对原料气进行净化的目的是
④向密闭容器中按1:3体积比通入N2和H2,反应达平衡时NH3的体积分数为25.0%,则N2的平衡转化率α(N2)=_________。
(2)“球磨法”是在温和的条件下(45℃和1bar,1 bar≈100kPa)合成氨,氨的最终体积分数可高达82.5%。
该法分为两个步骤(如下左图):第一步,铁粉在球磨过程中被反复剧烈碰撞而活化,产生高密度的缺陷,氮分子被吸附在这些缺陷上([Fe(N*)]),有助于氮分子的解离。第二步,N*发生加氢反应得到NHx*(x=1~3),剧烈碰撞中,NHx*从催化剂表面脱附得到产物氨。
①“球磨法”与“哈伯法”相比较,下列说法中正确的是_________(选填标号)。
A.催化剂(Fe)缺陷密度越高,N2的吸附率越高
B.“哈伯法”采用高温主要用于解离氮氮三键,而“球磨法”不用解离氮氮三键
C.“球磨法”中“剧烈碰撞”仅仅为了产生“活化缺陷”
D.“球磨法”不采用高压,是因为低压产率已经较高,加压会增大成本
②机械碰撞有助于催化剂缺陷的形成,而摩擦生热会使体系温度升高。如上右图是N2吸附量、体系温度随球磨转速变化曲线,则应选择的最佳转速约_______转/min。
高二化学期中考试试题参考答案
1-15 BAACB DCCDC AAADC
16.(14分)
(1)N(s)+N(s)= N2 + Rh(s) + Rh(s) (2分,写为N(s) +N(s)=>N2+ Rh(s) + Rh(s)不扣分)
-65.2(2分)
(2)选择性(1分)温度(1 分)
(3)50% (2分) 0.04 (2分)
(4)随着温度升高催化剂活性明显降低(2分)
反应前后气体体积相等,其他条件一定时,加压平衡不移动,a不变,压强增大到一定程度后水蒸气液化.继续加压,平衡正向移动,a逐渐增大(2 分)
17. (14 分)
(1)圆底烧瓶(2分)
(2) (2分)
(3) 还原性(1分)
(4)①0.1 mol. L-1KI溶液(2分)
②浓盐酸(2 分)
③淀粉(1 分)
④加入足量稀盐酸,再加入适量BaCl2溶液(2 分,不加盐酸不影响得分)
⑤ (2分,“KI”和“↓”不作为扣分点)
18.(14分)(1) (2分)
(2) 2Ga+3H2O2+6H+=2Ga3++6H2O (2分)
温度过高H2O2容易分解 (2分)
生成的氮氧化合物导致污染 (2分)
(3)SOCl2+H2O=SO2↑+2HCl (2分)
与水反应生成HCl,抑制GaCl3和InCl3的水解 (2分)
(4)×100%或×100% (2分)
19.(13分)
(1)①―90.8 (3分) ②BD(2分) ③为了防止混有的杂质使催化剂中毒(2分)
④40% (2分)
(2)①AD (2分) ②400 (2分)
高二化学试题
考试时间:75分钟 满分:100分
可能用到的相对原子质量:H1 C 12 N14 O16 Na23 Cl 35.5 Ga70
第Ⅰ卷(45分)
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与生活密切相关。下列说法错误的是
A.打开啤酒倒入杯中立即产生大量气泡,压强减小促使碳酸分解为CO2而大量逸出
B.絮凝剂有助于去除生活废水中的悬浮物, CaSO4 2H2O, KAl(SO4)2 12H2O均可作为絮凝剂
C.用高压氧舱治疗CO中毒利用了勒夏特列原理
D.草木灰和氨态氮肥不能混施
2.已知反应CO(g)+H2O(g)CO2(g)+H2(g) ΔH<0。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是
A.升高温度,K减小 B.减小压强,n(CO2)增加
C.更换高效催化剂,α(CO)增大 D.充入一定量的氮气,n(H2)减小
3. NA代表阿伏加德罗常数的值,下列叙述正确的是
A.Cu与浓硝酸反应生成9.2g NO2和N2O4混合气体时,转移电子数为0.2NA
B.60 g乙酸与足量乙醇发生酯化反应,充分反应后断裂的C-O键数目为NA
C.在1L 0.1 mol/L的Na2CO3溶液中,阴离子总数小于0.1 NA
D.标准状况下22.4LCl2完全溶于水,所得溶液中含氯微粒的总数为2NA
4.如图所示为接触法制硫酸的设备和工艺流程,接触室发生反应的热化学方程式表示为:
2SO2(g)+O2(g) 2SO3(g)△H= -196.6kJ·mol—1。下列说法不正确的是
A.黄铁矿进入沸腾炉之前需要进行粉碎,是为了增大反应物的接触面积,加快反应速率,并且可以提高原料的转化率
B.沸腾炉流出的气体必须经过净化,并补充适量空气,再进入接触室
C.工业生产要求高效,为加快反应速率,接触氧化应使用催化剂并尽可能提高体系温度
D.工业制硫酸的尾气大量排放至空气中会形成酸雨
5.下列说法不正确的是
A.已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol,假设1 mol冰中有2 mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键
B.已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol,则HCl和NH3·H2O反应生成1molH2O(1)时放出热量大于57.3 kJ
C.己知:正丁烷(g)=异丁烷(g) △ H<0,则异丁烷比正丁烷稳定
D.可以通过测定C(石墨,s)和CO(g)的燃烧热间接计算C(石墨,s)+O2(g)= CO(g)的反应热
6. 25℃时,下列溶液的关系式正确的是
A.在等体积的 ① 0.05mol/L的Ba(OH)2溶液,②pH=10的Na2S溶液中,发生电离的水的物质的量之比是1:10
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. pH=2的H2SO3溶液与pH=12的NaOH溶液任意比例混合:
c(Na+)+c(H+)=c(OH-)+c(HSO3-)
D. pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
7.下列指定反应的离子方程式正确的是
A. 将FeCl3溶液加入NH4HCO3溶液中: 2Fe3++6 HCO3-=Fe2(CO3)3↓+3CO2↑+3H2O
B. 向NaAlO2溶液中加入NaHCO3溶液:HCO3-+AlO2-+H2O=CO2↑+Al(OH)3↓
C. Cl2通入FeI2溶液中,可能存在反应:4Cl2+6I-+2Fe2+=2Fe3++3I2+8Cl-
D.同浓度同体积的NH4HSO4溶液与NaOH溶液混合:NH4++OH-=NH3·H2O
8.已知反应: 2NO(g)+Br2(g) 2NOBr(g) ΔH=-a kJ·mol-1(a>0),其反应机理如下
①NO(g)+Br2(g) NOBr2(g) 快
②NO(g)+NOBr2(g) 2NOBr(g) 慢
下列有关该反应的说法正确的是
A.该反应的速率主要取决于①的快慢
B.NOBr2是该反应的催化剂
C.正反应的活化能比逆反应的活化能小a kJ·mol-1
D.增大 Br2(g)浓度能增大活化分子百分数, 加快反应速率
9.某同学通过实验研究铜盐溶液颜色的变化。下列说法不正确的是
A.由①②可知,②中溶液呈蓝色是Cu2+与水分子作用的结果
B.由④可知,Cu2+与Cl 可能会结合产生黄色物质
C.由③④可知,Cl 的浓度对铜盐溶液的颜色有影响
D.由②③④可知,CuCl2溶液一定为绿色
10.用下列实验装置进行相应实验,能达到实验目的的是
A.利用装置甲测定化学反应速率
B. 利用装置乙证明对H2O2分解反应Fe3+催化效果好于Cu2+
C. 利用装置丙探究温度对平衡2NO2(g)N2O4(g)的影响
D. 利用装置丁探究压强对平衡H2(g)+ I2(g)2 HI(g)的影响
11.下列叙述不正确的是
A. 邻苯二甲酸氢钾可用于标定NaOH溶液的浓度。假如称量邻苯二甲酸氢钾时电子天平读数比实际质量偏大,则测得的NaOH溶液浓度比实际浓度偏小
B. “中和滴定”实验中,锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,必须干燥或润洗后方可使用
C. 用玻璃棒蘸取CH3COOH溶液点在水湿润的pH试纸上,则测得的该溶液pH值偏大
D. 滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁
12.在一固定容积的密闭容器中,充入2molCO2和1molH2发生如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数(K)与温度(T)的关系如表:
T/℃ 700 800 830 1000 1200
K 0.6 0.9 1.0 1.7 2.6
关于该反应的说法不正确的是
A.已知该反应ΔS>0,则反应在任何温度下都能自发进行
B.830℃时反应达到平衡,CO2气体的转化率为33.3%
C.1000℃,当c(CO2)·c(H2)=c(CO)·c(H2O)时,该反应向正反应方向进行
D.其他条件不变,降低温度,反应达到新平衡前:v逆>v正
13.法国化学家 Paul Sabatier较早提出可以利用工业废弃物CO2转化为CH4,其反应原理为CO2(g)+4H2(g) CH4(g)+2H2O(g)△H= -165kJ mol-1。若在密闭容器中充入1 mol CO2、1molH2引发该反应进行,下列说法正确的是
A B C D
恒温恒容下,混合气体中CH4与CO2的体积分数变化 恒温恒压条件平衡后,t1时改变条件可能是充入少量N2 升高温度,平衡常数Kc的变化趋势 CO2平衡转化率随压强的变化趋势
14. 部分弱电解质的电离平衡常数如下表:
弱电解质 HCOOH HCN NH3·H2O H2CO3
电离平衡常数(25 ℃) Ka=1.8×10-4 Ka=4.9×10-10 Kb=1.8×10-5 Ka1=4.5×10-7Ka2=4.7×10-11
25 ℃时,下列说法错误的是
A.浓度均为0.1mol·L-1的HCN和NaCN混合溶液中:c(HCN)>c(CN-)
B.0.1 mol/L的HCOONH4溶液中存在以下关系式:c(HCOO-)>c(NH)>c(H+)>c(OH-)
C.pH=3的盐酸与pH=11的氨水混合,若溶液显中性,则混合前两者的体积大小:V(盐酸)>V(氨水)
D.少量CO2通入NaCN溶液中发生反应:2CN-+CO2+H2O=CO32-+2HCN
15.常温下,用如图1所示装置,分别向25 mL 0.3 mol·L 1 Na2CO3溶液和25 mL 0.3 mol·L 1 NaHCO3溶液中逐滴滴加0.3 mol·L 1稀盐酸,用压强传感器测得压强随盐酸体积的变化曲线如图2所示,下列说法正确的是
A.X曲线为Na2CO3溶液的滴定曲线
B.b点溶液的pH大于c点溶液的pH
C.a点溶液中:c(HCO3-)>c(CO32-)>c(H2CO3)
D.b、d两点水的电离程度相等
第Ⅱ卷(55分)
二、填空题(本题包括4个小题,共55分)
16.(14分)
氢气在富氧条件下催化还原 NOx(H2-SCR)反应在低温时仍具有高活性和选择性,近年来一直备受研究学者关注。回答下列问题:
(1)已知催化剂铑(Rh)表面 H2催化还原NO的详细反应机理如下表所示,其他条件一定时,决定 H2催化还原NO反应速率的基元反应为 , 基元反应H2+Rh(s)+Rh(s) H(s)+H(s)的焓变ΔH= kJ/mol-1.
(2)浸渍法合成的 Pt/Al-M-10-A催化剂对H2还原NO反应的影响如上图所示,由图可知该催化剂对反应产物具有 ,该性质受 的影响。
(3)将H2、NO、O2按体积比3:2:1充入恒温恒压(200℃、100 kPa容器中,发生反应:
4H2(g)+2NO(g) +O 2(g)N2(g)+4H2O(g),达平衡时,N2的体积分数为0.1。平衡时,NO的转化率为 平衡常数Kp= (kPa)-2(以平衡分压表示,平衡分压=平衡总压×物质的量分数)。
(4)利用CH4催化还原NO的反应:CH4(g)+ 4NO(g)CO2 + 2N2(g)+ 2H2O(g),向一个装有催化剂的体积不变密闭容器中通入一定量的CH4和NO发生反应,测得反应速率和温度的关系如图甲所示,BC段反应速率降低的原因可能是
若该反应在一定温度下达到平衡后,将容器压缩,容器内CH4的平衡转化率为a,测定结果如图乙所示,试分析a随压强增大,开始不变,一定程度后逐渐增大的原因是
17. (14分)学习小组在实验室中利用下图所示装置制备SO2并进行相关性质的探究。
回答下列问题:
(1)仪器Q的名称为 ;
(2)装置a中反应的化学方程式为 。
(3)装置e中紫色溶液变浅至褪色可证明SO2具有 。
(4)实验开始后,发现装置d中的溶液迅速变黄,继续通入SO2,装置d中出现乳黄色浑浊。该小组同学查阅资料得知,存在可逆反应:SO2+4I-+4H+S↓+2I2+2H2O.
探究I:探究浓度对上述可逆反应的影响
有同学认为除SO2的浓度外,其他离子的浓度对该可逆反应也有影响。完成实验设计进行验证(SO2体积已折算为标准状况下体积)。
限选试剂:0.1 mol·L-1KI溶液、1.0mol·L-1KI溶液、2.0mol·L-1KI溶液、蒸馏水、浓硝酸、浓盐酸
影响因素 编号 操作 现象
c(I- ) i 取50 mL①_ 于锥形瓶中,向其中通入20 mL SO2 溶液变为浅黄色
ii 取50 mL 1.0 mol·L-1KI溶液于锥形瓶中,向其中通入20 mL SO2 溶液迅速变黄
c(H+) ⅲ 取50 mL1.0 mol·L-1KI溶液和5 mL蒸馏水于锥形瓶中,向其中通入20 mL SO2 溶液迅速变黄
iv 取50 mL 1.0 mol·L-1KI溶液和5 mL②_ 于锥形瓶中,向其中通入20 mL SO2 溶液迅速变黄,且出现乳黄色浑浊
探究II:探究SO2在KI溶液体系中的反应产物
有同学提出上述可逆反应生成的I2可与SO2发生反应:SO2+I2+2H2O=SO42-+2I-+4H+.为进一步探究体系中的产物,完成下列实验方案。
方案 操作 预期现象 结论
i 取适量装置d中浊液,向其中滴加几滴③ 溶液(填试剂名称),振荡 无明显变化 浊液中无l2
ii 将装置d中浊液进行分离 得淡黄色固体和澄清溶液
取适量分离后的澄清溶液于试管中,④ 出现白色沉淀 产物中含有SO42-
⑤综上可知,SO2在KI溶液中发生了歧化反应,其反应的离子方程式为 。
18.(14分)CIGS靶材是一种主要含铜、镓(Ga)、铟(In)、硒(Se)的合金,由于其良好的电学传导和光学透明性能,被广泛运用在薄膜太阳能电池领域。实验室设计从废弃CIGS中回收稀散金属铟和镓的氯化物(性质类似于AlCl3)的流程图:
已知:
I.“溶解”步骤所得溶液中含有Cu2+、In3+、Ga3+和H2SeO3。
II.“减压蒸馏”步骤中得到InCl3·xH2O和GaCl3·yH2O固体混合物。
回答下列问题:
(1)镓位于元素周期表第四周期IIIA族,则其原子结构示意图为 。
(2)“溶解”过程中生成Ga3+的离子方程式为 和2Ga+6H+=2Ga3++3H2↑;溶解温度控制在30℃左右,温度不宜过高的原因是 。利用王水也能溶解CIGS,试分析以王水代替HCl和H2O2的缺点是 (答出一点即可)。
(3)SOCl2与水反应,液面上有白雾形成,并生成一种能使品红溶液褪色的气体,SOCl2与水反应的方程式为: ,则“加热回流”步骤中加入SOCl2的目的除了脱水外,还有 。
(4)取m g CIGS靶材(其中镓的质量分数为a%),按上述流程进行实验,最终得到纯度为b%的GaCl3固体n g,则镓元素的回收率为______ 。(用含m、n、a、b的代数式表示)。
19.(13分)合成氨技术的创立开辟了人工固氮的重要途径,通常用以铁为主的催化剂在400~500℃和10~30MPa的条件下,由氮气和氢气直接合成氨。
(1)“哈伯法”合成氨的反应: △H,相关键能数据如下表:
①△H=_________kJ mol-1。
②在恒温恒容密闭容器中进行的工业合成氨反应,下列能表示达到平衡状态的是________(填序号)。
A.单位时间内断开3a个H—H键的同时形成6a个N—H 键
B.混合气体的平均相对分子质量不再发生变化
C.混合气体的密度不再发生变化
D.反应容器中N2、NH3的物质的量的比值不再发生变化
③工业生产必须对原料气进行净化的目的是
④向密闭容器中按1:3体积比通入N2和H2,反应达平衡时NH3的体积分数为25.0%,则N2的平衡转化率α(N2)=_________。
(2)“球磨法”是在温和的条件下(45℃和1bar,1 bar≈100kPa)合成氨,氨的最终体积分数可高达82.5%。
该法分为两个步骤(如下左图):第一步,铁粉在球磨过程中被反复剧烈碰撞而活化,产生高密度的缺陷,氮分子被吸附在这些缺陷上([Fe(N*)]),有助于氮分子的解离。第二步,N*发生加氢反应得到NHx*(x=1~3),剧烈碰撞中,NHx*从催化剂表面脱附得到产物氨。
①“球磨法”与“哈伯法”相比较,下列说法中正确的是_________(选填标号)。
A.催化剂(Fe)缺陷密度越高,N2的吸附率越高
B.“哈伯法”采用高温主要用于解离氮氮三键,而“球磨法”不用解离氮氮三键
C.“球磨法”中“剧烈碰撞”仅仅为了产生“活化缺陷”
D.“球磨法”不采用高压,是因为低压产率已经较高,加压会增大成本
②机械碰撞有助于催化剂缺陷的形成,而摩擦生热会使体系温度升高。如上右图是N2吸附量、体系温度随球磨转速变化曲线,则应选择的最佳转速约_______转/min。
高二化学期中考试试题参考答案
1-15 BAACB DCCDC AAADC
16.(14分)
(1)N(s)+N(s)= N2 + Rh(s) + Rh(s) (2分,写为N(s) +N(s)=>N2+ Rh(s) + Rh(s)不扣分)
-65.2(2分)
(2)选择性(1分)温度(1 分)
(3)50% (2分) 0.04 (2分)
(4)随着温度升高催化剂活性明显降低(2分)
反应前后气体体积相等,其他条件一定时,加压平衡不移动,a不变,压强增大到一定程度后水蒸气液化.继续加压,平衡正向移动,a逐渐增大(2 分)
17. (14 分)
(1)圆底烧瓶(2分)
(2) (2分)
(3) 还原性(1分)
(4)①0.1 mol. L-1KI溶液(2分)
②浓盐酸(2 分)
③淀粉(1 分)
④加入足量稀盐酸,再加入适量BaCl2溶液(2 分,不加盐酸不影响得分)
⑤ (2分,“KI”和“↓”不作为扣分点)
18.(14分)(1) (2分)
(2) 2Ga+3H2O2+6H+=2Ga3++6H2O (2分)
温度过高H2O2容易分解 (2分)
生成的氮氧化合物导致污染 (2分)
(3)SOCl2+H2O=SO2↑+2HCl (2分)
与水反应生成HCl,抑制GaCl3和InCl3的水解 (2分)
(4)×100%或×100% (2分)
19.(13分)
(1)①―90.8 (3分) ②BD(2分) ③为了防止混有的杂质使催化剂中毒(2分)
④40% (2分)
(2)①AD (2分) ②400 (2分)
同课章节目录
