第四章认 第2节化学反应中的质量关系课后练习能力提升--燃烧课后练习能力提升—2021-2022学年九年级化学沪教版(全国)上册(word版 含解析)
文档属性
| 名称 | 第四章认 第2节化学反应中的质量关系课后练习能力提升--燃烧课后练习能力提升—2021-2022学年九年级化学沪教版(全国)上册(word版 含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 84.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-02 13:20:41 | ||
图片预览



文档简介
第四章认识化学变化第2节化学反应中的质量关系课后练习能力提升九年级化学上册(科粤版2012)
练习
一、单选题,共12小题
1.小湘同学在学完《自然界的水》后,就一些疑间请教了四位同学,其中说法不正确的是
A.小一同学:硬水通过煮沸或蒸馏的方法可以得到软水,硬水加热过程中涉及到化学变化
B.小立同学:过滤的速度慢是因为玻璃棒伸到了漏斗的底部,导致堵塞滤纸
C.小信同学:电解水的实验中,在水中加入硫酸钠或氢氧化钠以增强水的导电性
D.小牛同学:水通电后生成的氢气和氧气的质量比为1:8
2.中药当归、白芷中富含的紫花前胡醇(化学式为C14H14O4),能增强人体免疫力。下列关于紫花前胡醇叙迷错误的是
A.其中氢元素的质量分数最小 B.一个分子由32个原子构成
C.在空气中燃烧可能生成CO2 D.C、H、O元素质量比为7:7:2
3.图是某个化学反应的微观模拟示意图.从图中获得信息不正确的
A.反应前后原子的个数不变 B.该反应为分解反应
C.化学反应中分子可分为原子 D.反应前是混合物,反应后是纯净物
4.将一定质量的a、b、c、d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得各物质的质量如表:
物质 a b c d
反应前的质量/g 6.4 14.0 3.2 1.0
反应一段时间后的质量/g 10.0 7.2 X 1.0
下列有关说法正确的是
A.a和b是反应物 B.X=3.2
C.该反应属于分解反应 D.d一定是催化剂
5.下列说法不能用质量守恒定律解释的是
A.镁带在空气中燃烧生成物的质量比镁带大
B.煤炭在空气中燃烧质量减轻
C.同温同压下,1L氢气与1L氯气在点燃的条件下完全反应生成2L氯化氢气体
D.完全电解20g水得到的氢气和氧气的质量之和仍然是20g
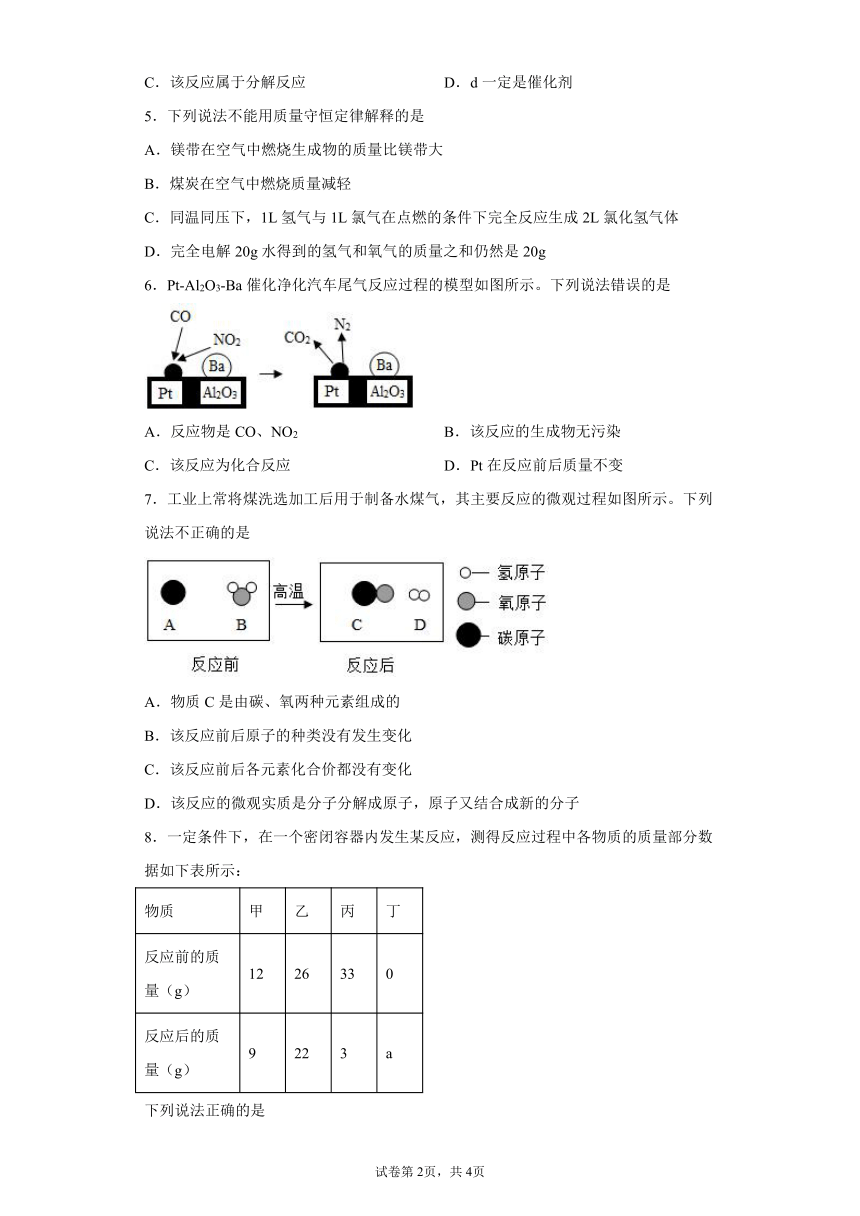
6.Pt-Al2O3-Ba催化净化汽车尾气反应过程的模型如图所示。下列说法错误的是
A.反应物是CO、NO2 B.该反应的生成物无污染
C.该反应为化合反应 D.Pt在反应前后质量不变
7.工业上常将煤洗选加工后用于制备水煤气,其主要反应的微观过程如图所示。下列说法不正确的是
A.物质C是由碳、氧两种元素组成的
B.该反应前后原子的种类没有发生变化
C.该反应前后各元素化合价都没有变化
D.该反应的微观实质是分子分解成原子,原子又结合成新的分子
8.一定条件下,在一个密闭容器内发生某反应,测得反应过程中各物质的质量部分数据如下表所示:
物质 甲 乙 丙 丁
反应前的质量(g) 12 26 33 0
反应后的质量(g) 9 22 3 a
下列说法正确的是
A.a等于10 B.该反应为分解反应
C.丙一定为催化剂 D.丁一定是化合物
9.密闭在一个密闭容器中M、N、Q、P四种物质,在一定条件下发生化学反应,一段时间,测得有关数据如下表,则关于此反应认识不正确的是
物质 M N Q P
反应前质量(g) 18 1 2 32
反应后质量(g) x 26 2 12
A.该变化的基本反应类型是化合反应 B.反应后物质M的质量为13g
C.反应中N、P的质量比为4:5 D.物质Q可能是该反应的催化剂
10.下列推理正确的是
A.化学变化常伴随着发光发热的现象,所以有发光发热现象的一定是化学变化
B.氧化反应一定是化合反应
C.某气体不能使带火星的木条复燃,该气体中一定不含有氧气
D.在燃烧匙中灼烧面粉,有黑色物质残留,所以面粉中一定含有碳元素
11.工业上用CH4和CO2制取合成气,微观示意图如下。有关说法错误的是
A.Ni基双金属催化剂可重复使用 B.反应前后元素的化合价均改变
C.反应前后原子种类和数目不变 D.该反应的最终生成物有两种
12.下列推理正确的是
A.化学变化常伴随发热、发光现象,所以伴随发热、发光现象的变化一定是化学变化
B.二氧化碳能使燃着的木条熄灭,则能使燃着的木条熄灭的气体一定是二氧化碳
C.某物质燃烧生成CO2和H2O,则该物质一定含C、H、O三种元素
D.化合物是含有不同元素的纯净物,所以含有不同种元素的纯净物一定是化合物
二、非选择题,共5小题
13.在化学反应中,由于原子的种类、______和质量都没有发生变化,所以所有的化学反应都遵守质量守恒定律。
14.一定质量甲、乙、丙、丁4种物质放在密闭容器里反应,质量变化如下、
物质 甲 乙 丙 丁
反应前质量/g 4 2 3 2
反应后质量/g 1.2 X 2.4 5.4
该反应是______反应(基本反应类型),X=______。
15.植物的光合作用可表示为: ,则淀粉中一定含_____元素,可能含______元素
16.化学用语是学习化学的基本工具,请用化学符号填空:
(1)2个亚铁离子______;
(2)3个硫酸根离子______;
(3)保持氢气化学性质的最小粒子的化学式______;
(4)地壳中含量最高的金属元素与非金属元素形成的化合物是______;
(5)气体X在氧气中燃烧生成氮气和水,X分子中一定含有的原子是______(填符号)。
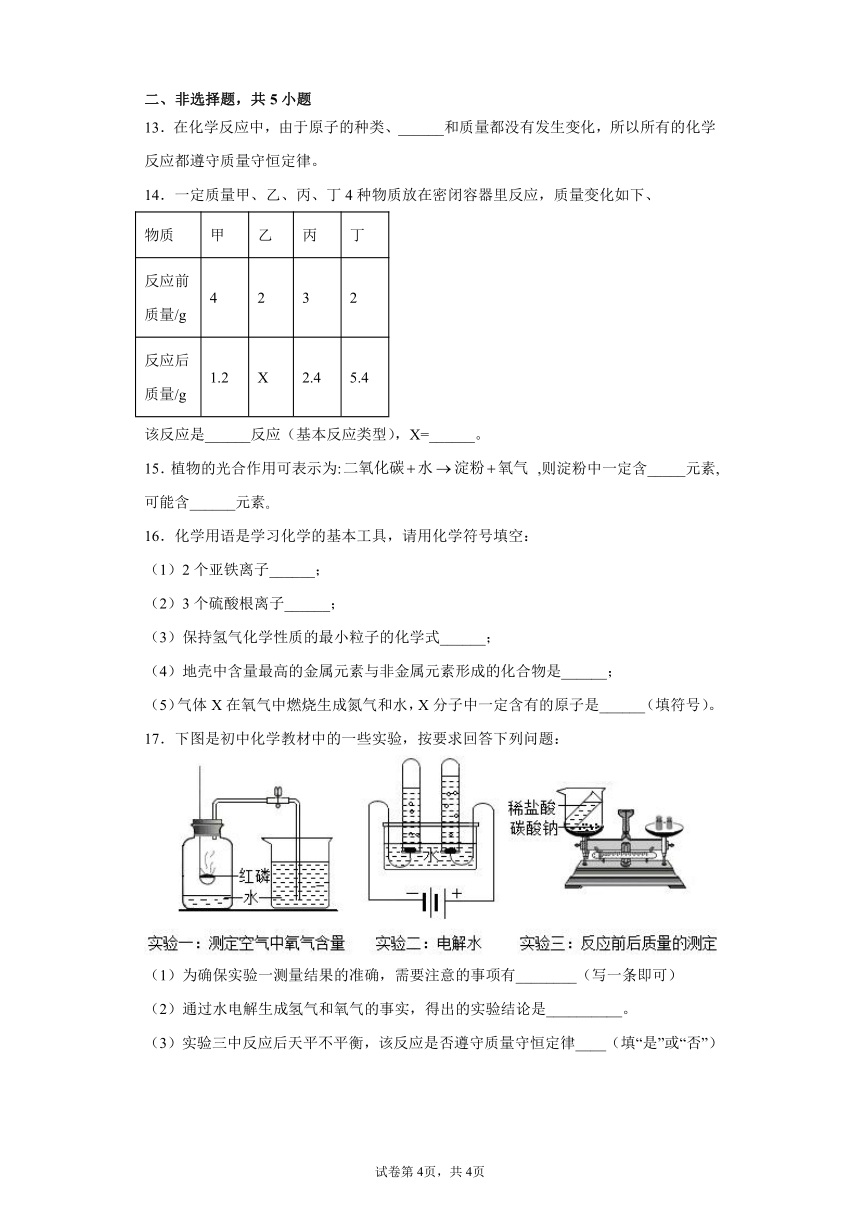
17.下图是初中化学教材中的一些实验,按要求回答下列问题:
(1)为确保实验一测量结果的准确,需要注意的事项有________(写一条即可)
(2)通过水电解生成氢气和氧气的事实,得出的实验结论是__________。
(3)实验三中反应后天平不平衡,该反应是否遵守质量守恒定律____(填“是”或“否”)
试卷第2页,共2页
试卷第1页,共1页
参考答案
1.B
【详解】
A、硬水通过煮沸或蒸馏的方法可以将熟知的部分或全部可溶性钙镁化合物转化为难溶性固体从水中沉降下来,得到软水,硬水加热过程中,可溶性钙镁化合物转化为难溶性固体,有新物质生成,属于化学变化,选项正确;
B、过滤的速度慢是因为浊液中的难溶性固体颗粒堵塞滤纸上的滤孔,导致过滤速率减慢,选项错误;
C、电解水的实验中,在水中加入硫酸钠或氢氧化钠以增强水的导电性,选项正确;
D、水中氢元素与氧元素的质量比为1:8,由质量守恒定律可知,水通电后生成的氢气和氧气的质量比也为1:8,选项正确,故选B。
2.D
【详解】
A、紫花前胡醇C、H、O元素质量比为(12×14):(1×14):(16×4)=84:7:32,比较可知,氢元素的质量分数最小,故A叙述正确;
B、由化学式可知,一个分子有14个碳原子、14个氢原子、4个氧原子,可知一个分子由32个原子构成,故B叙述正确;
C、紫花前胡醇中含有碳元素,由质量守恒定律可知,在空气中燃烧可能生成CO2,故C叙述正确;
D、紫花前胡醇中,C、H、O元素质量比为(12×14):(1×14):(16×4)=84:7:32≠7:7:2,故D叙述错误。
故选D。
3.B
【分析】
化学反应的本质:第一步分子裂解为原子,第二步原子重新结合为新的分子。
【详解】
A、根据质量守恒定律中原子守恒可知,反应前后原子的个数不变,选项正确,故不选。
B、由图可知该反应由两种单质生成一种化合物,符合多变一的规律,所以为化合反应。选项错误,故选。
C、化学费反应的本质分子分裂为原子,原子重新组合成新分子,所以选项说法正确,故不选。
D、反应有两种单质,所以为混合物,生成物为一种化合物,所以为纯净物。选项说法正确,故不选。
故选:B。
【点睛】
本题考查化学变化的微观示意图,纯净物、混合物的简单判断。
4.C
【分析】
反应前后物质总质量不变,所以X=6.4+14.0+3.2+1.0-10.0-7.2-1.0=6.6。a、c反应后质量增加是生成物,b反应后质量减少,是反应物。d质量不变可能是催化剂也可能不参加反应。
【详解】
A、a、c反应后质量增加是生成物,b反应后质量减少,是反应物。错误。
B、X=6.6,错误。
C、该反应是一种物质生成两种物质的反应,是分解反应。正确。
D、d可能是催化剂,也可能是不参加反应的杂质,错误。
故选C。
5.C
【详解】
A、镁带在空气中燃烧生成氧化镁,氧化镁的质量等于镁带质量与参加反应氧气的质量之和,所以生成物的质量比镁带大,选项能用质量守恒定律解释;
B、煤炭在空气中燃烧质量减轻,是因为生成二氧化碳气体逸散到空气中,剩余固体质量变小,选项能用质量守恒定律解释;
C、质量守恒定律是相对于反应中各物质的质量而言,不是体积之间的关系,选项不能用质量守恒定律解释;
D、根据质量守恒定律,参加反应的各物质的质量总和等于反应后生成的各物质的质量总和,所以完全电解20g水得到的氢气和氧气的质量之和仍然是20g,能用质量守恒定律解释。
故选C。
6.C
【分析】
化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变。
【详解】
A、该反应是一定条件下一氧化碳和二氧化氮反应生成二氧化碳和氮气,反应物是CO、NO2,该选项说法正确;
B、该反应的最大贡献是将有毒气体处理为无污染气体,即把一氧化碳和二氧化氮等有毒气体转化成无毒物质二氧化碳和氮气,该选项说法正确;
C、一定条件下一氧化碳和二氧化氮反应生成二氧化碳和氮气,生成物有两种,不是化合反应,该选项说法不正确;
D、Pt是催化剂,反应前后质量不变,故选项说法正确,
故选:.C。
7.C
【详解】
A、物质C是一氧化碳,一氧化是由碳、氧两种元素组成的,故A正确;
B、由微粒的变化可知,该反应前后原子的种类没有发生变化,故B正确;
C、反应是碳和水蒸气在高温下反应生成了一氧化碳和氢气,碳元素的化合价由0变为+2价,氢元素由+1价变为0,反应前后有元素化合价的变化,故C不正确;
D、该反应的微观实质是分子分解成原子,原子又结合成新的分子,故D正确。
故选:C。
8.D
【分析】
根据质量守恒定律,则有12+26+33+0=9+22+3+a,得a=37,反应后质量增多的物质是生成物,质量减少的物质是反应物,差量是生成的质量或参加反应的质量。甲反应后质量减少,是反应物,参加反应的质量为12g-9g=3g,乙反应后质量减少,是反应物,参加反应的质量为26g-22g=4g,丙反应后质量减少,是反应物,参加反应的质量为33g-3g=30g,丁的质量增加,丁是生成物,生成的质量为37g;
【详解】
A、根据分析可知,a=37,选项不正确;
B、由分析可知,甲、乙、丙为反应物,丁为生成物,符合“多变一”的特点,属于化合反应,选项不正确;
C、丙反应后质量减少,是反应物,不是催化剂,选项不正确;
D、该反应为化合反应,生成物是丁,根据质量守恒定律,反应前后元素种类不变,所以丁一定是化合物,选项正确。
故选D。
9.C
【详解】
A、由图可知,反应后密闭容器中M物质的质量=18g+1g+2g+32g 26g 2g 12g=13g,则反应后物质M与P的质量减少,属于反应物,物质N的质量增加,属于生成物,物质Q的质量不变,即该反应是两种物质生成一种物质的反应,符合化合反应的特点,属于化合反应,选项正确;
B、由质量守恒定律可知,反应后密闭容器中M物质的质量=18g+1g+2g+32g 26g 2g 12g=13g,选项正确;
C、反应中N、P的质量比=(26g 1g):(32g 12g)=5:4,选项错误;
D、物质Q的质量在反应前后保持不变,则物质Q可能是该反应的催化剂,也可能是不参与反应的杂质,选项正确;
故选C。
10.D
【详解】
A、化学变化常伴随着发光发热的现象,但是有发光发热现象的不一定是化学变化,如电灯通电时,发光放热,只是能量的转变,无新物质生成,属于物理变化,不符合题意;
B、氧化反应不一定是化合反应,如甲烷燃烧生成二氧化碳和水,是物质与氧气的反应,属于氧化反应,但是生成物有两种,不属于化合反应,不符合题意;
C、某气体不能使带火星的木条复燃,该气体中不一定不含有氧气,如空气中含氧气,但是空气不能使带火星的木条复燃,不符合题意;
D、在燃烧匙中灼烧面粉,有黑色物质残留,说明生成了碳,根据质量守恒定律,化学反应前后,元素的种类不变,生成物中含碳元素,故面粉中一定含有碳元素,符合题意。
故选D。
11.B
【详解】
A、Ni基双金属在反应中作为催化剂,催化剂在反应前后质量和化学性质不发生变化,可重复使用,故选项正确;
B、该反应为,反应后碳元素的化合价由+4价变为+2价,氧元素的化合价在反应前后都是-2价,未发生变化,氢元素的化合价由+1价变为0价,故选项错误;
C、根据质量守恒定律反应前后原子种类和数目不变,故选项正确;
D、该反应的最终生成物为一氧化碳和氢气混合气体,故选项正确。
故选:B。
12.D
【分析】
化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变。
【详解】
A、化学变化常伴随发热、发光现象,但伴随发热、发光现象的变化不一定是化学变化,比如灯泡通电发光发热,不是化学变化,该选项说法不正确;
B、使燃着的木条熄灭的不一定是二氧化碳,例如氮气、稀有气体等气体都能使燃烧的木条熄灭,该选项说法不正确;
C、某物质完全燃烧,生成物只有CO2和H2O,说明该物质中含有碳元素和氢元素,无法确定是否含有氧元素,这是因为该物质燃烧时氧气参加了反应,该选项说法不正确;
D、化合物是含有不同元素的纯净物,所以含有不同种元素的纯净物一定是化合物,该选项说法正确。
故选:D。
【点睛】
13.数目
【详解】
质量守恒定律从微观上解释:化学反应前后,原子的种类、数目、质量没有改变,所以反应前后的物质的总质量不变,故填写:数目。
【点睛】
本题考察了学生对课本相关概念的记忆和掌握。
14.化合 2
【详解】
根据质量守恒定律,4+2+3+2=1.2+X+2.4+5.4,则X=2;乙物质反应前后质量不变,可能是催化剂;甲、丙质量减小为反应物,丙质量变大为生成物,反应符合多变一特点,属于化合反应。
15.碳、氢 氧
【详解】
二氧化碳和水含有碳、氢、氧元素,根据质量守恒反应前后元素种类不变,故淀粉和氧气含有碳、氢、氧元素,氧气中含有氧元素,故淀粉中一定含有碳、氢元素,可能含有氧元素,故填:碳、氢;氧。
16.
(1)2Fe2+
(2)
(3)H2
(4)Al2O3
(5)N、H
【分析】
(1)
离子的表示方法:在该离子元素符号的右上角标上该离子所带的正负电荷数,数字在前,正负号在后,带一个电荷时,1通常省略,多个离子,就是在元素符号前面加上相应的数字;故2个亚铁离子表示为:2Fe2+;
(2)
离子的表示方法:在该离子元素符号的右上角标上该离子所带的正负电荷数,数字在前,正负号在后,带一个电荷时,1通常省略,多个离子,就是在元素符号前面加上相应的数字;故3个硫酸根离子表示为:;
(3)
氢气由氢分子构成,保持氢气化学性质的最小粒子是氢分子,分子用化学式表示,故表示为:H2;
(4)
地壳中含量最高的金属元素是铝元素,含量最高的非金属元素是氧元素,它们形成的化合物为氧化铝,氧化铝中铝元素显+3价,氧元素显-2价,化学式为:Al2O3;
(5)
气体X在氧气中燃烧生成氮气和水,根据质量守恒定律,化学反应前后,元素的种类不变,反应物中含氧元素,生成物中含N、H、O元素,故反应物中还应含N、H元素,故X分子中一定含有的原子是:N、H。
17.
(1)红磷的量要充足,或装置气密性良好,或装置冷却至室温后再打开止水夹
(2)水由氢元素与氧元素组成
(3)是
【解析】
(1)
测空气中氧气含量的该实验中,红磷的量要充足,能够将装置中的氧气完全耗尽,装置气密性好,不漏气,避免装置外的气体进入装置内,导致实验结果偏小,红磷燃烧停止后,装置冷却至室温后再打开止水夹,防止气体受热瓶中,导致进入瓶中水的体积偏小,测出的结果偏小,故填红磷的量要充足,或装置气密性良好,或装置冷却至室温后再打开止水夹。
(2)
水电解后生成氢气与氧气,氢气由氢元素组成,氧气由氧元素组成,由质量守恒定律可知,化学反应前后元素的种类不变,所以可以推知,水由氢元素与氧元素组成,故填水由氢元素与氧元素组成。
(3)
实验中碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳,生成的二氧化碳逸散到空气中,反应前烧杯中的物质的总质量等于反应后烧杯中物质的质量与逸散到空气中的二氧化碳的质量和,即虽然实验三中反应后天平不平衡,但该反应遵守质量守恒定律,故填是。答案第1页,共2页
答案第1页,共2页
练习
一、单选题,共12小题
1.小湘同学在学完《自然界的水》后,就一些疑间请教了四位同学,其中说法不正确的是
A.小一同学:硬水通过煮沸或蒸馏的方法可以得到软水,硬水加热过程中涉及到化学变化
B.小立同学:过滤的速度慢是因为玻璃棒伸到了漏斗的底部,导致堵塞滤纸
C.小信同学:电解水的实验中,在水中加入硫酸钠或氢氧化钠以增强水的导电性
D.小牛同学:水通电后生成的氢气和氧气的质量比为1:8
2.中药当归、白芷中富含的紫花前胡醇(化学式为C14H14O4),能增强人体免疫力。下列关于紫花前胡醇叙迷错误的是
A.其中氢元素的质量分数最小 B.一个分子由32个原子构成
C.在空气中燃烧可能生成CO2 D.C、H、O元素质量比为7:7:2
3.图是某个化学反应的微观模拟示意图.从图中获得信息不正确的
A.反应前后原子的个数不变 B.该反应为分解反应
C.化学反应中分子可分为原子 D.反应前是混合物,反应后是纯净物
4.将一定质量的a、b、c、d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得各物质的质量如表:
物质 a b c d
反应前的质量/g 6.4 14.0 3.2 1.0
反应一段时间后的质量/g 10.0 7.2 X 1.0
下列有关说法正确的是
A.a和b是反应物 B.X=3.2
C.该反应属于分解反应 D.d一定是催化剂
5.下列说法不能用质量守恒定律解释的是
A.镁带在空气中燃烧生成物的质量比镁带大
B.煤炭在空气中燃烧质量减轻
C.同温同压下,1L氢气与1L氯气在点燃的条件下完全反应生成2L氯化氢气体
D.完全电解20g水得到的氢气和氧气的质量之和仍然是20g
6.Pt-Al2O3-Ba催化净化汽车尾气反应过程的模型如图所示。下列说法错误的是
A.反应物是CO、NO2 B.该反应的生成物无污染
C.该反应为化合反应 D.Pt在反应前后质量不变
7.工业上常将煤洗选加工后用于制备水煤气,其主要反应的微观过程如图所示。下列说法不正确的是
A.物质C是由碳、氧两种元素组成的
B.该反应前后原子的种类没有发生变化
C.该反应前后各元素化合价都没有变化
D.该反应的微观实质是分子分解成原子,原子又结合成新的分子
8.一定条件下,在一个密闭容器内发生某反应,测得反应过程中各物质的质量部分数据如下表所示:
物质 甲 乙 丙 丁
反应前的质量(g) 12 26 33 0
反应后的质量(g) 9 22 3 a
下列说法正确的是
A.a等于10 B.该反应为分解反应
C.丙一定为催化剂 D.丁一定是化合物
9.密闭在一个密闭容器中M、N、Q、P四种物质,在一定条件下发生化学反应,一段时间,测得有关数据如下表,则关于此反应认识不正确的是
物质 M N Q P
反应前质量(g) 18 1 2 32
反应后质量(g) x 26 2 12
A.该变化的基本反应类型是化合反应 B.反应后物质M的质量为13g
C.反应中N、P的质量比为4:5 D.物质Q可能是该反应的催化剂
10.下列推理正确的是
A.化学变化常伴随着发光发热的现象,所以有发光发热现象的一定是化学变化
B.氧化反应一定是化合反应
C.某气体不能使带火星的木条复燃,该气体中一定不含有氧气
D.在燃烧匙中灼烧面粉,有黑色物质残留,所以面粉中一定含有碳元素
11.工业上用CH4和CO2制取合成气,微观示意图如下。有关说法错误的是
A.Ni基双金属催化剂可重复使用 B.反应前后元素的化合价均改变
C.反应前后原子种类和数目不变 D.该反应的最终生成物有两种
12.下列推理正确的是
A.化学变化常伴随发热、发光现象,所以伴随发热、发光现象的变化一定是化学变化
B.二氧化碳能使燃着的木条熄灭,则能使燃着的木条熄灭的气体一定是二氧化碳
C.某物质燃烧生成CO2和H2O,则该物质一定含C、H、O三种元素
D.化合物是含有不同元素的纯净物,所以含有不同种元素的纯净物一定是化合物
二、非选择题,共5小题
13.在化学反应中,由于原子的种类、______和质量都没有发生变化,所以所有的化学反应都遵守质量守恒定律。
14.一定质量甲、乙、丙、丁4种物质放在密闭容器里反应,质量变化如下、
物质 甲 乙 丙 丁
反应前质量/g 4 2 3 2
反应后质量/g 1.2 X 2.4 5.4
该反应是______反应(基本反应类型),X=______。
15.植物的光合作用可表示为: ,则淀粉中一定含_____元素,可能含______元素
16.化学用语是学习化学的基本工具,请用化学符号填空:
(1)2个亚铁离子______;
(2)3个硫酸根离子______;
(3)保持氢气化学性质的最小粒子的化学式______;
(4)地壳中含量最高的金属元素与非金属元素形成的化合物是______;
(5)气体X在氧气中燃烧生成氮气和水,X分子中一定含有的原子是______(填符号)。
17.下图是初中化学教材中的一些实验,按要求回答下列问题:
(1)为确保实验一测量结果的准确,需要注意的事项有________(写一条即可)
(2)通过水电解生成氢气和氧气的事实,得出的实验结论是__________。
(3)实验三中反应后天平不平衡,该反应是否遵守质量守恒定律____(填“是”或“否”)
试卷第2页,共2页
试卷第1页,共1页
参考答案
1.B
【详解】
A、硬水通过煮沸或蒸馏的方法可以将熟知的部分或全部可溶性钙镁化合物转化为难溶性固体从水中沉降下来,得到软水,硬水加热过程中,可溶性钙镁化合物转化为难溶性固体,有新物质生成,属于化学变化,选项正确;
B、过滤的速度慢是因为浊液中的难溶性固体颗粒堵塞滤纸上的滤孔,导致过滤速率减慢,选项错误;
C、电解水的实验中,在水中加入硫酸钠或氢氧化钠以增强水的导电性,选项正确;
D、水中氢元素与氧元素的质量比为1:8,由质量守恒定律可知,水通电后生成的氢气和氧气的质量比也为1:8,选项正确,故选B。
2.D
【详解】
A、紫花前胡醇C、H、O元素质量比为(12×14):(1×14):(16×4)=84:7:32,比较可知,氢元素的质量分数最小,故A叙述正确;
B、由化学式可知,一个分子有14个碳原子、14个氢原子、4个氧原子,可知一个分子由32个原子构成,故B叙述正确;
C、紫花前胡醇中含有碳元素,由质量守恒定律可知,在空气中燃烧可能生成CO2,故C叙述正确;
D、紫花前胡醇中,C、H、O元素质量比为(12×14):(1×14):(16×4)=84:7:32≠7:7:2,故D叙述错误。
故选D。
3.B
【分析】
化学反应的本质:第一步分子裂解为原子,第二步原子重新结合为新的分子。
【详解】
A、根据质量守恒定律中原子守恒可知,反应前后原子的个数不变,选项正确,故不选。
B、由图可知该反应由两种单质生成一种化合物,符合多变一的规律,所以为化合反应。选项错误,故选。
C、化学费反应的本质分子分裂为原子,原子重新组合成新分子,所以选项说法正确,故不选。
D、反应有两种单质,所以为混合物,生成物为一种化合物,所以为纯净物。选项说法正确,故不选。
故选:B。
【点睛】
本题考查化学变化的微观示意图,纯净物、混合物的简单判断。
4.C
【分析】
反应前后物质总质量不变,所以X=6.4+14.0+3.2+1.0-10.0-7.2-1.0=6.6。a、c反应后质量增加是生成物,b反应后质量减少,是反应物。d质量不变可能是催化剂也可能不参加反应。
【详解】
A、a、c反应后质量增加是生成物,b反应后质量减少,是反应物。错误。
B、X=6.6,错误。
C、该反应是一种物质生成两种物质的反应,是分解反应。正确。
D、d可能是催化剂,也可能是不参加反应的杂质,错误。
故选C。
5.C
【详解】
A、镁带在空气中燃烧生成氧化镁,氧化镁的质量等于镁带质量与参加反应氧气的质量之和,所以生成物的质量比镁带大,选项能用质量守恒定律解释;
B、煤炭在空气中燃烧质量减轻,是因为生成二氧化碳气体逸散到空气中,剩余固体质量变小,选项能用质量守恒定律解释;
C、质量守恒定律是相对于反应中各物质的质量而言,不是体积之间的关系,选项不能用质量守恒定律解释;
D、根据质量守恒定律,参加反应的各物质的质量总和等于反应后生成的各物质的质量总和,所以完全电解20g水得到的氢气和氧气的质量之和仍然是20g,能用质量守恒定律解释。
故选C。
6.C
【分析】
化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变。
【详解】
A、该反应是一定条件下一氧化碳和二氧化氮反应生成二氧化碳和氮气,反应物是CO、NO2,该选项说法正确;
B、该反应的最大贡献是将有毒气体处理为无污染气体,即把一氧化碳和二氧化氮等有毒气体转化成无毒物质二氧化碳和氮气,该选项说法正确;
C、一定条件下一氧化碳和二氧化氮反应生成二氧化碳和氮气,生成物有两种,不是化合反应,该选项说法不正确;
D、Pt是催化剂,反应前后质量不变,故选项说法正确,
故选:.C。
7.C
【详解】
A、物质C是一氧化碳,一氧化是由碳、氧两种元素组成的,故A正确;
B、由微粒的变化可知,该反应前后原子的种类没有发生变化,故B正确;
C、反应是碳和水蒸气在高温下反应生成了一氧化碳和氢气,碳元素的化合价由0变为+2价,氢元素由+1价变为0,反应前后有元素化合价的变化,故C不正确;
D、该反应的微观实质是分子分解成原子,原子又结合成新的分子,故D正确。
故选:C。
8.D
【分析】
根据质量守恒定律,则有12+26+33+0=9+22+3+a,得a=37,反应后质量增多的物质是生成物,质量减少的物质是反应物,差量是生成的质量或参加反应的质量。甲反应后质量减少,是反应物,参加反应的质量为12g-9g=3g,乙反应后质量减少,是反应物,参加反应的质量为26g-22g=4g,丙反应后质量减少,是反应物,参加反应的质量为33g-3g=30g,丁的质量增加,丁是生成物,生成的质量为37g;
【详解】
A、根据分析可知,a=37,选项不正确;
B、由分析可知,甲、乙、丙为反应物,丁为生成物,符合“多变一”的特点,属于化合反应,选项不正确;
C、丙反应后质量减少,是反应物,不是催化剂,选项不正确;
D、该反应为化合反应,生成物是丁,根据质量守恒定律,反应前后元素种类不变,所以丁一定是化合物,选项正确。
故选D。
9.C
【详解】
A、由图可知,反应后密闭容器中M物质的质量=18g+1g+2g+32g 26g 2g 12g=13g,则反应后物质M与P的质量减少,属于反应物,物质N的质量增加,属于生成物,物质Q的质量不变,即该反应是两种物质生成一种物质的反应,符合化合反应的特点,属于化合反应,选项正确;
B、由质量守恒定律可知,反应后密闭容器中M物质的质量=18g+1g+2g+32g 26g 2g 12g=13g,选项正确;
C、反应中N、P的质量比=(26g 1g):(32g 12g)=5:4,选项错误;
D、物质Q的质量在反应前后保持不变,则物质Q可能是该反应的催化剂,也可能是不参与反应的杂质,选项正确;
故选C。
10.D
【详解】
A、化学变化常伴随着发光发热的现象,但是有发光发热现象的不一定是化学变化,如电灯通电时,发光放热,只是能量的转变,无新物质生成,属于物理变化,不符合题意;
B、氧化反应不一定是化合反应,如甲烷燃烧生成二氧化碳和水,是物质与氧气的反应,属于氧化反应,但是生成物有两种,不属于化合反应,不符合题意;
C、某气体不能使带火星的木条复燃,该气体中不一定不含有氧气,如空气中含氧气,但是空气不能使带火星的木条复燃,不符合题意;
D、在燃烧匙中灼烧面粉,有黑色物质残留,说明生成了碳,根据质量守恒定律,化学反应前后,元素的种类不变,生成物中含碳元素,故面粉中一定含有碳元素,符合题意。
故选D。
11.B
【详解】
A、Ni基双金属在反应中作为催化剂,催化剂在反应前后质量和化学性质不发生变化,可重复使用,故选项正确;
B、该反应为,反应后碳元素的化合价由+4价变为+2价,氧元素的化合价在反应前后都是-2价,未发生变化,氢元素的化合价由+1价变为0价,故选项错误;
C、根据质量守恒定律反应前后原子种类和数目不变,故选项正确;
D、该反应的最终生成物为一氧化碳和氢气混合气体,故选项正确。
故选:B。
12.D
【分析】
化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变。
【详解】
A、化学变化常伴随发热、发光现象,但伴随发热、发光现象的变化不一定是化学变化,比如灯泡通电发光发热,不是化学变化,该选项说法不正确;
B、使燃着的木条熄灭的不一定是二氧化碳,例如氮气、稀有气体等气体都能使燃烧的木条熄灭,该选项说法不正确;
C、某物质完全燃烧,生成物只有CO2和H2O,说明该物质中含有碳元素和氢元素,无法确定是否含有氧元素,这是因为该物质燃烧时氧气参加了反应,该选项说法不正确;
D、化合物是含有不同元素的纯净物,所以含有不同种元素的纯净物一定是化合物,该选项说法正确。
故选:D。
【点睛】
13.数目
【详解】
质量守恒定律从微观上解释:化学反应前后,原子的种类、数目、质量没有改变,所以反应前后的物质的总质量不变,故填写:数目。
【点睛】
本题考察了学生对课本相关概念的记忆和掌握。
14.化合 2
【详解】
根据质量守恒定律,4+2+3+2=1.2+X+2.4+5.4,则X=2;乙物质反应前后质量不变,可能是催化剂;甲、丙质量减小为反应物,丙质量变大为生成物,反应符合多变一特点,属于化合反应。
15.碳、氢 氧
【详解】
二氧化碳和水含有碳、氢、氧元素,根据质量守恒反应前后元素种类不变,故淀粉和氧气含有碳、氢、氧元素,氧气中含有氧元素,故淀粉中一定含有碳、氢元素,可能含有氧元素,故填:碳、氢;氧。
16.
(1)2Fe2+
(2)
(3)H2
(4)Al2O3
(5)N、H
【分析】
(1)
离子的表示方法:在该离子元素符号的右上角标上该离子所带的正负电荷数,数字在前,正负号在后,带一个电荷时,1通常省略,多个离子,就是在元素符号前面加上相应的数字;故2个亚铁离子表示为:2Fe2+;
(2)
离子的表示方法:在该离子元素符号的右上角标上该离子所带的正负电荷数,数字在前,正负号在后,带一个电荷时,1通常省略,多个离子,就是在元素符号前面加上相应的数字;故3个硫酸根离子表示为:;
(3)
氢气由氢分子构成,保持氢气化学性质的最小粒子是氢分子,分子用化学式表示,故表示为:H2;
(4)
地壳中含量最高的金属元素是铝元素,含量最高的非金属元素是氧元素,它们形成的化合物为氧化铝,氧化铝中铝元素显+3价,氧元素显-2价,化学式为:Al2O3;
(5)
气体X在氧气中燃烧生成氮气和水,根据质量守恒定律,化学反应前后,元素的种类不变,反应物中含氧元素,生成物中含N、H、O元素,故反应物中还应含N、H元素,故X分子中一定含有的原子是:N、H。
17.
(1)红磷的量要充足,或装置气密性良好,或装置冷却至室温后再打开止水夹
(2)水由氢元素与氧元素组成
(3)是
【解析】
(1)
测空气中氧气含量的该实验中,红磷的量要充足,能够将装置中的氧气完全耗尽,装置气密性好,不漏气,避免装置外的气体进入装置内,导致实验结果偏小,红磷燃烧停止后,装置冷却至室温后再打开止水夹,防止气体受热瓶中,导致进入瓶中水的体积偏小,测出的结果偏小,故填红磷的量要充足,或装置气密性良好,或装置冷却至室温后再打开止水夹。
(2)
水电解后生成氢气与氧气,氢气由氢元素组成,氧气由氧元素组成,由质量守恒定律可知,化学反应前后元素的种类不变,所以可以推知,水由氢元素与氧元素组成,故填水由氢元素与氧元素组成。
(3)
实验中碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳,生成的二氧化碳逸散到空气中,反应前烧杯中的物质的总质量等于反应后烧杯中物质的质量与逸散到空气中的二氧化碳的质量和,即虽然实验三中反应后天平不平衡,但该反应遵守质量守恒定律,故填是。答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
