第五单元定量研究化学反应测试题-2021-2022学年九年级化学鲁教版上册(word版 含答案)
文档属性
| 名称 | 第五单元定量研究化学反应测试题-2021-2022学年九年级化学鲁教版上册(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 135.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-02 13:22:47 | ||
图片预览




文档简介
第五单元《定量研究化学反应》测试题
一、单选题
1.火箭推进器中装有液态肼(N2H4)和过氧化氢,当它们混合反应时,放出大量的热量,有关反应方程式为 ,据此判断X的化学式是
A.N2O B.H2 C.H2O D.NH3
2.纯净物M在密闭容器中微热就分解为NH3、H2O和CO2,根据这一实验事实能得出的结论是
A.M可能是碳酸钠 B.M的化学性质很稳定
C.M中有氨气 D.M由四种元素组成
3.在密闭容器中加入甲、乙、丙、丁四种物质,使之充分反应,反应前后测得有关数据如表,下列说法中,不正确的是
物质 甲 乙 丙 丁
反应前质量/g 18 1 2 32
反应后质量/g x 26 2 12
A.此反应类型是分解反应 B.乙是生成物
C.反应中乙、丁的质量比5:4 D.物质丙可能是该反应的催化剂
4.在一个密闭容器中,有甲、乙、丙、丁、戊五种物质,在一定条件下发生反应,测得反应前后各物质的质量变化量如图所示(图中正数表示物质质量的增加量,负数表示物质质量的减少量,0 表示物质质量不变),下列说法正确的是
A.戊一定是该反应的催化剂
B.该反应前后分子的数目一定不变
C.参加反应的乙、丙的质量比一定为 48:23
D.该反应中甲、丁的相对分子质量之比一定为 44:27
5.逻辑推理是化学学习中常用的思维方法,以下推理正确的是
A.Al3+、Cl-的最外层电子数均为8,则最外层电子数为8的粒子都是离子
B.单质都是由一种元素组成的,所以由一种元素组成的物质一定是单质
C.同种元素的微粒含有相同的质子数,但含有相同质子数的微粒不一定属于同种元素
D.过氧化氢可用于制氧气,所以过氧化氢中含有氧分子
6.推理是学习化学的一种方法。以下推理正确的是
A.某物质燃烧有H2O生成,所以该物质一定含有氢元素
B.金属元素有正化合价,因此非金属元素一定没有正化合价
C.离子是带电的粒子,所以带电的粒子一定是离子
D.元素是具有相同质子数的一类原子的总称,所以具有相同质子数的粒子一定属于同种元素
7.分析下面实验内容和结论,正确的一组是
实验内容 实验结论
A 带有火星的木条置于氧气瓶中,木条复燃 氧气有可燃性
B 水通电生成氢气和氧气 水是由氢元素和氧元素组成
C 浑浊的河水经过过滤变澄清 得到的水是纯净物
D 10克氯化钠溶解在90克水中得到100克溶液 该实验符合质量守恒定律
A.A B.B C.C D.D
8.从“宏观”和“微观”认识化学反应,是化学学科的基本思想,如图是氢气在氧气中燃烧的微 观示意图,则下列说法正确的是
A.该反应中生成物为混合物
B.该反应中元素种类发生改变
C.该反应中分子可分,原子不可分
D.该反应中分子、原子数目都没有发生改变
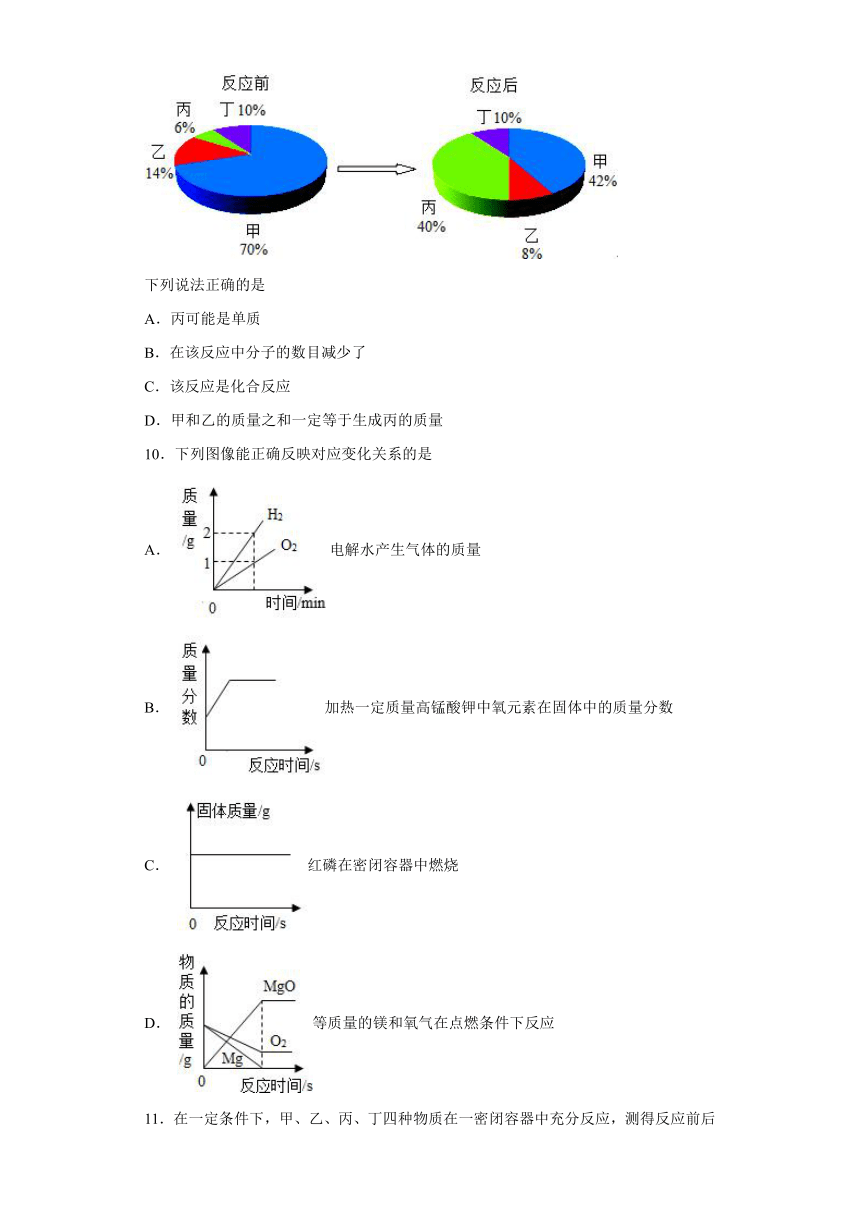
9.在密闭容器中有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量分数如图所示:
下列说法正确的是
A.丙可能是单质
B.在该反应中分子的数目减少了
C.该反应是化合反应
D.甲和乙的质量之和一定等于生成丙的质量
10.下列图像能正确反映对应变化关系的是
A. 电解水产生气体的质量
B. 加热一定质量高锰酸钾中氧元素在固体中的质量分数
C. 红磷在密闭容器中燃烧
D. 等质量的镁和氧气在点燃条件下反应
11.在一定条件下,甲、乙、丙、丁四种物质在一密闭容器中充分反应,测得反应前后各物质的质量如下表所示,关于此反应下列认识正确的是
物质 甲 乙 丙 丁
反应前质量/g 1 20 15 2
反应后质量/g m 29 0 8
A.m的值为1 B.反应中乙、丁的质量比为29:8
C.该反应是化合反应 D.甲一定是该反应的催化剂
12.在一个密闭容器中,有a、b、c、d四种物质,反应前各物质的质量关系如图刻度纸所示(例如:d的质量为2g)。在一定条件下发生反应,反应结束后,再次测得各物质的质量变化,并通过刻度的移动来表示,且记录在同一张刻度纸上:刻度线Ⅰ向右移动6格;刻度线Ⅱ向左移动5格;刻度线Ⅲ向左移动5格。已知:a、d的相对分子质量之比为3:5,下列说法正确的是
A.反应结束后b的质量为11g B.a、b变化的质量比一定为11:6
C.c一定是该反应的催化剂 D.a、d的化学计量数之比为2:1
13.在一定条件下,甲、乙、丙、丁四种物质在一密闭容器中充分反应,测得反应前后各物质的质量如表所示。根据表中信息判断下列说法正确的是
物质 甲 乙 丙 丁
反应前的质量/g 2 30 20 10
反应后的质量/g 2 39 5 m
A.m=6 B.反应过程中生成乙、丁的质量比为3:2
C.甲一定是该反应的催化剂 D.丙可能是化合物
14.如图是一氧化碳与氧气反应的微观示意图,图中“ ”表示氧原子,“ ”表示碳原子。下列说法错误的是
A.反应前后原子数目不变
B.反应前后元素种类不变
C.反应前后分子种类发生了改变
D.该反应属于分解反应
15.有关反应2CO+O22CO2的说法正确的是
A.一氧化碳加氧气在点燃条件下等于二氧化碳
B.反应前后分子的种类和数目均没有发生变化
C.每2个一氧化碳分子和1个氧分子反应生成2个二氧化碳分子
D.每2份质量一氧化碳和1份质量氧气完全反应生成2份质量二氧化碳
二、填空题
16.如图是某些气体的微观示意图,图中“”和“”分别表示不同的原子。
(1)其中表示纯净物的有_______(填序号,后同),能表示氢气和氧气的混合气的是________,能表示氦气和氖气的混合气的是_________,能表示氮气的是_________。
(2)由图③所示物质转化为图①所示物质可表示我们已经学过的一个重要化学变化,该反应的化学方程式为_______。
(3)请用化学用语填空:
①氩气_________。
②2个氯分子________。
③氯酸钾中的阴离子___________。
④标出氧化铁中铁元素的化合价________。
17.每年的3月22日是“世界水日”,水与人类的生产、生活密切相关。
(1)如图是电解水的实验示意图,试管a中的气体是_______。电解水的化学方程式为_________。
(2)为区分软水和硬水将等量的肥皂水分别滴加到盛有等量软水、硬水的试管中,振荡,试管中产生较多泡沫的为_______。生活中常用_______的方法来降低水的硬度。
(3)二氧化氯(ClO2)是一种消毒剂,能对饮用水消毒,可以有效杀灭病毒。将Cl2通入NaClO2溶液中可制得ClO2和一种生活中常见的盐,反应的化学方程式为Cl2+2NaClO2=2X+ClO2,其中X的化学式为_______。
18.小华同学在复习《质量守恒定律》时,回忆了老师做的以下几个演示实验:
已知:
(1)实验1中所用的白磷过量,该实验涉及的化学反应方程式为______。该实验中气球的作用是______。实验后冷却至室温,将锥形瓶倒置于盛满水的水槽中,取下瓶塞,观察到的现象是______。
(2)在实验2结束后,天平指针向右偏,该实验______(填“遵循”与“不遵循”)质量守恒定律,他认为天平不平衡的原因是______。
(3)在实验3中,容器中物质的总质量随时间的变化关系正确的是______(填序号)。
A. B.C. D.
三、推断题
19.A~D是初中化学常见的物质,它们之间有下图所示的转换关系。其中A、B在常温下均为液体且元素组成相同。
试推断:
(1)写出下列物质的化学式:A_______D_______;
(2)写出C转化为B的化学方程式_______。
20.通常情况下,A物质是空气中含量最多的气体,B 是人体生命活动离不开的气体,物质C能在B物质中燃烧,产生蓝紫色火焰,并生成一种有刺激性气味的气体D,物质E不能在空气中燃烧,但能在B物质中剧烈燃烧,并且火星四射,产生一种黑色固体。根据上述内容请回答下列问题:
(1)写出物质A、B、C、E名称______、______、______、______。
(2)写出气体D的化学式是______。
(3)物质C能在B物质中燃烧,和物质E在B物质中燃烧的反应符号表达式为:______。
四、实验题
21.如图,分别表示硫、铁在氧气中燃烧。
(1)A中观察到现象______。
(2)B中反应的反学方程式______。
(3)两瓶中水作用各是什么?______。
22.结合下列实验装置图回答问题:
(1)写出仪器的名称:①_______,②_______。
(2)若用B装置来制取氧气,该反应的化学方程式为____;若装置B中反应很剧烈,据此提出实验安全注意事项是____(选序号)
①控制液体的加入速度 ②用体积较小的锥形瓶 ③加热反应物
(3)氨气极易溶于水,且密度比空气小,实验室常用加热固体硫酸铵和固体熟石灰的混合物来制取氨气,制取氨气的发生装置应选用_______装置,若使用装置F收集氨气,则气体应从_______端(填“a”或“b”)通入。
五、计算题
23.将3.1g红磷放在盛有足量空气的密团容器中燃烧,充分反应后能生成多少g五氧化二磷?(利用化学方程式计算)
24.近日我国把三名航天员送入中国空间站执行任务180天,他们每天要消耗1650升的氧气从何而来?最常见的方法是电解水,用这个方式在地球表面制备氧气是很不经济的,主要是因为太费电能,不过在太空中可以利用太阳能板来获取电能电解水产生大量的氧气。当电解水得到氧气的同时产生氢气,它易燃可能引发安全隐患又如何处理呢?宇航员在太空中吸入氧气后,会换出二氧化碳,然后收集这些二氧化碳和氢气在一定条件下进行反应,生成甲烷(CH4)和水。最后,把甲烷排出空间站,留下水继续使用。
(1)请写出除去氢气的化学方程式:
(2)如果在空间站中电解1L水最多能产生氧气多少g?(水的密度为1000g/L,保留一位小数)
参考答案
1.C 2.D 3.A 4.C 5.C 6.A 7.B 8.C 9.C 10.D 11.A 12.D 13.B 14.D 15.C
16.(1) ①④⑤ ③ ⑥ ④
(2)2H2+O22H2O
(3) Ar 2Cl2 ClO3-
17.(1) 氢气2
(2) 软水 煮沸
(3)NaCl
18.(1) 4P+5O22P2O5 缓冲装置内外的气压,防止发生安全事故 有水进入锥形瓶内
(2) 遵循 生成的气体逸散道空气中去了
(3)B
19.(1) H2O2 H2 (2)
20.(1) 氮气 氧气 硫 铁
(2)SO2
(3)S+O2SO2和Fe+O2Fe3O4
21.(1)发出蓝紫色火焰,生成一种刺激性气体并放热
(2)
(3)A中是吸收有毒SO2气体,防止污染空气;B中是防止熔化物溅落炸裂瓶底
22.(1) 酒精灯 长颈漏斗
(2) ①
(3) A b
23.解:设生成五氧化二磷的质量为x
答:充分反应后生成五氧化二磷的质量为7.1g。
24.(1)
(2)888.9g
解:1L水的质量为1L×1000g/L=1000g,设电解1L水最多能产生氧气的质量为x,则有
答:电解1L水最多能产生氧气的质量为888.9g。
一、单选题
1.火箭推进器中装有液态肼(N2H4)和过氧化氢,当它们混合反应时,放出大量的热量,有关反应方程式为 ,据此判断X的化学式是
A.N2O B.H2 C.H2O D.NH3
2.纯净物M在密闭容器中微热就分解为NH3、H2O和CO2,根据这一实验事实能得出的结论是
A.M可能是碳酸钠 B.M的化学性质很稳定
C.M中有氨气 D.M由四种元素组成
3.在密闭容器中加入甲、乙、丙、丁四种物质,使之充分反应,反应前后测得有关数据如表,下列说法中,不正确的是
物质 甲 乙 丙 丁
反应前质量/g 18 1 2 32
反应后质量/g x 26 2 12
A.此反应类型是分解反应 B.乙是生成物
C.反应中乙、丁的质量比5:4 D.物质丙可能是该反应的催化剂
4.在一个密闭容器中,有甲、乙、丙、丁、戊五种物质,在一定条件下发生反应,测得反应前后各物质的质量变化量如图所示(图中正数表示物质质量的增加量,负数表示物质质量的减少量,0 表示物质质量不变),下列说法正确的是
A.戊一定是该反应的催化剂
B.该反应前后分子的数目一定不变
C.参加反应的乙、丙的质量比一定为 48:23
D.该反应中甲、丁的相对分子质量之比一定为 44:27
5.逻辑推理是化学学习中常用的思维方法,以下推理正确的是
A.Al3+、Cl-的最外层电子数均为8,则最外层电子数为8的粒子都是离子
B.单质都是由一种元素组成的,所以由一种元素组成的物质一定是单质
C.同种元素的微粒含有相同的质子数,但含有相同质子数的微粒不一定属于同种元素
D.过氧化氢可用于制氧气,所以过氧化氢中含有氧分子
6.推理是学习化学的一种方法。以下推理正确的是
A.某物质燃烧有H2O生成,所以该物质一定含有氢元素
B.金属元素有正化合价,因此非金属元素一定没有正化合价
C.离子是带电的粒子,所以带电的粒子一定是离子
D.元素是具有相同质子数的一类原子的总称,所以具有相同质子数的粒子一定属于同种元素
7.分析下面实验内容和结论,正确的一组是
实验内容 实验结论
A 带有火星的木条置于氧气瓶中,木条复燃 氧气有可燃性
B 水通电生成氢气和氧气 水是由氢元素和氧元素组成
C 浑浊的河水经过过滤变澄清 得到的水是纯净物
D 10克氯化钠溶解在90克水中得到100克溶液 该实验符合质量守恒定律
A.A B.B C.C D.D
8.从“宏观”和“微观”认识化学反应,是化学学科的基本思想,如图是氢气在氧气中燃烧的微 观示意图,则下列说法正确的是
A.该反应中生成物为混合物
B.该反应中元素种类发生改变
C.该反应中分子可分,原子不可分
D.该反应中分子、原子数目都没有发生改变
9.在密闭容器中有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量分数如图所示:
下列说法正确的是
A.丙可能是单质
B.在该反应中分子的数目减少了
C.该反应是化合反应
D.甲和乙的质量之和一定等于生成丙的质量
10.下列图像能正确反映对应变化关系的是
A. 电解水产生气体的质量
B. 加热一定质量高锰酸钾中氧元素在固体中的质量分数
C. 红磷在密闭容器中燃烧
D. 等质量的镁和氧气在点燃条件下反应
11.在一定条件下,甲、乙、丙、丁四种物质在一密闭容器中充分反应,测得反应前后各物质的质量如下表所示,关于此反应下列认识正确的是
物质 甲 乙 丙 丁
反应前质量/g 1 20 15 2
反应后质量/g m 29 0 8
A.m的值为1 B.反应中乙、丁的质量比为29:8
C.该反应是化合反应 D.甲一定是该反应的催化剂
12.在一个密闭容器中,有a、b、c、d四种物质,反应前各物质的质量关系如图刻度纸所示(例如:d的质量为2g)。在一定条件下发生反应,反应结束后,再次测得各物质的质量变化,并通过刻度的移动来表示,且记录在同一张刻度纸上:刻度线Ⅰ向右移动6格;刻度线Ⅱ向左移动5格;刻度线Ⅲ向左移动5格。已知:a、d的相对分子质量之比为3:5,下列说法正确的是
A.反应结束后b的质量为11g B.a、b变化的质量比一定为11:6
C.c一定是该反应的催化剂 D.a、d的化学计量数之比为2:1
13.在一定条件下,甲、乙、丙、丁四种物质在一密闭容器中充分反应,测得反应前后各物质的质量如表所示。根据表中信息判断下列说法正确的是
物质 甲 乙 丙 丁
反应前的质量/g 2 30 20 10
反应后的质量/g 2 39 5 m
A.m=6 B.反应过程中生成乙、丁的质量比为3:2
C.甲一定是该反应的催化剂 D.丙可能是化合物
14.如图是一氧化碳与氧气反应的微观示意图,图中“ ”表示氧原子,“ ”表示碳原子。下列说法错误的是
A.反应前后原子数目不变
B.反应前后元素种类不变
C.反应前后分子种类发生了改变
D.该反应属于分解反应
15.有关反应2CO+O22CO2的说法正确的是
A.一氧化碳加氧气在点燃条件下等于二氧化碳
B.反应前后分子的种类和数目均没有发生变化
C.每2个一氧化碳分子和1个氧分子反应生成2个二氧化碳分子
D.每2份质量一氧化碳和1份质量氧气完全反应生成2份质量二氧化碳
二、填空题
16.如图是某些气体的微观示意图,图中“”和“”分别表示不同的原子。
(1)其中表示纯净物的有_______(填序号,后同),能表示氢气和氧气的混合气的是________,能表示氦气和氖气的混合气的是_________,能表示氮气的是_________。
(2)由图③所示物质转化为图①所示物质可表示我们已经学过的一个重要化学变化,该反应的化学方程式为_______。
(3)请用化学用语填空:
①氩气_________。
②2个氯分子________。
③氯酸钾中的阴离子___________。
④标出氧化铁中铁元素的化合价________。
17.每年的3月22日是“世界水日”,水与人类的生产、生活密切相关。
(1)如图是电解水的实验示意图,试管a中的气体是_______。电解水的化学方程式为_________。
(2)为区分软水和硬水将等量的肥皂水分别滴加到盛有等量软水、硬水的试管中,振荡,试管中产生较多泡沫的为_______。生活中常用_______的方法来降低水的硬度。
(3)二氧化氯(ClO2)是一种消毒剂,能对饮用水消毒,可以有效杀灭病毒。将Cl2通入NaClO2溶液中可制得ClO2和一种生活中常见的盐,反应的化学方程式为Cl2+2NaClO2=2X+ClO2,其中X的化学式为_______。
18.小华同学在复习《质量守恒定律》时,回忆了老师做的以下几个演示实验:
已知:
(1)实验1中所用的白磷过量,该实验涉及的化学反应方程式为______。该实验中气球的作用是______。实验后冷却至室温,将锥形瓶倒置于盛满水的水槽中,取下瓶塞,观察到的现象是______。
(2)在实验2结束后,天平指针向右偏,该实验______(填“遵循”与“不遵循”)质量守恒定律,他认为天平不平衡的原因是______。
(3)在实验3中,容器中物质的总质量随时间的变化关系正确的是______(填序号)。
A. B.C. D.
三、推断题
19.A~D是初中化学常见的物质,它们之间有下图所示的转换关系。其中A、B在常温下均为液体且元素组成相同。
试推断:
(1)写出下列物质的化学式:A_______D_______;
(2)写出C转化为B的化学方程式_______。
20.通常情况下,A物质是空气中含量最多的气体,B 是人体生命活动离不开的气体,物质C能在B物质中燃烧,产生蓝紫色火焰,并生成一种有刺激性气味的气体D,物质E不能在空气中燃烧,但能在B物质中剧烈燃烧,并且火星四射,产生一种黑色固体。根据上述内容请回答下列问题:
(1)写出物质A、B、C、E名称______、______、______、______。
(2)写出气体D的化学式是______。
(3)物质C能在B物质中燃烧,和物质E在B物质中燃烧的反应符号表达式为:______。
四、实验题
21.如图,分别表示硫、铁在氧气中燃烧。
(1)A中观察到现象______。
(2)B中反应的反学方程式______。
(3)两瓶中水作用各是什么?______。
22.结合下列实验装置图回答问题:
(1)写出仪器的名称:①_______,②_______。
(2)若用B装置来制取氧气,该反应的化学方程式为____;若装置B中反应很剧烈,据此提出实验安全注意事项是____(选序号)
①控制液体的加入速度 ②用体积较小的锥形瓶 ③加热反应物
(3)氨气极易溶于水,且密度比空气小,实验室常用加热固体硫酸铵和固体熟石灰的混合物来制取氨气,制取氨气的发生装置应选用_______装置,若使用装置F收集氨气,则气体应从_______端(填“a”或“b”)通入。
五、计算题
23.将3.1g红磷放在盛有足量空气的密团容器中燃烧,充分反应后能生成多少g五氧化二磷?(利用化学方程式计算)
24.近日我国把三名航天员送入中国空间站执行任务180天,他们每天要消耗1650升的氧气从何而来?最常见的方法是电解水,用这个方式在地球表面制备氧气是很不经济的,主要是因为太费电能,不过在太空中可以利用太阳能板来获取电能电解水产生大量的氧气。当电解水得到氧气的同时产生氢气,它易燃可能引发安全隐患又如何处理呢?宇航员在太空中吸入氧气后,会换出二氧化碳,然后收集这些二氧化碳和氢气在一定条件下进行反应,生成甲烷(CH4)和水。最后,把甲烷排出空间站,留下水继续使用。
(1)请写出除去氢气的化学方程式:
(2)如果在空间站中电解1L水最多能产生氧气多少g?(水的密度为1000g/L,保留一位小数)
参考答案
1.C 2.D 3.A 4.C 5.C 6.A 7.B 8.C 9.C 10.D 11.A 12.D 13.B 14.D 15.C
16.(1) ①④⑤ ③ ⑥ ④
(2)2H2+O22H2O
(3) Ar 2Cl2 ClO3-
17.(1) 氢气2
(2) 软水 煮沸
(3)NaCl
18.(1) 4P+5O22P2O5 缓冲装置内外的气压,防止发生安全事故 有水进入锥形瓶内
(2) 遵循 生成的气体逸散道空气中去了
(3)B
19.(1) H2O2 H2 (2)
20.(1) 氮气 氧气 硫 铁
(2)SO2
(3)S+O2SO2和Fe+O2Fe3O4
21.(1)发出蓝紫色火焰,生成一种刺激性气体并放热
(2)
(3)A中是吸收有毒SO2气体,防止污染空气;B中是防止熔化物溅落炸裂瓶底
22.(1) 酒精灯 长颈漏斗
(2) ①
(3) A b
23.解:设生成五氧化二磷的质量为x
答:充分反应后生成五氧化二磷的质量为7.1g。
24.(1)
(2)888.9g
解:1L水的质量为1L×1000g/L=1000g,设电解1L水最多能产生氧气的质量为x,则有
答:电解1L水最多能产生氧气的质量为888.9g。
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
