2021-2022学年高二人教版(2019)化学选择性必修2-第三章《晶体结构与性质》测试题
文档属性
| 名称 | 2021-2022学年高二人教版(2019)化学选择性必修2-第三章《晶体结构与性质》测试题 |  | |
| 格式 | docx | ||
| 文件大小 | 552.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-05 19:04:28 | ||
图片预览




文档简介
第三章《晶体结构与性质》测试题
一、单选题(共12题)
1.足球烯(C60)分子形成的晶体是碳的一种单质形态。下列说法错误的是
A.形成该单质的微粒间作用力为范德华力
B.足球烯晶体的熔沸点低于金刚石晶体
C.足球烯、石墨均可作为生产耐高温的润滑剂材料
D.足球烯在苯中的溶解度比在酒精中的溶解度大
2.在阳光照射下,水和氧气在浸泡过溶液的三噻吩()聚合物表面能高效合成过氧化氢,下列说法不正确的是
A.的电子式为: B.为极性分子
C.为离子晶体 D.的结构示意图为
3.下列关于物质结构的说法错误的是
A.甲醛()和光气()分子中的键角
B.基态氮原子有三种能量不同的电子
C.熔点:
D.的空间构型为四面体形
4.一种以苦卤水(主要成分是、)为原料制备无水的工艺流程如下:
下列说法正确的是
A.滤液中大量存在、、
B.“煅烧”后的产物溶于稀盐酸,将所得溶液加热蒸干也可得到无水
C.1个干冰晶胞(见右图)中含14个
D.“高温氯化”时的反应为
5.将Na、Na2O、NaOH、Na2S、Na2SO3分别加热熔化,需要克服相同类型作用力的物质有
A.2种 B.3种 C.4种 D.5种
6.《天工开物》记载:“凡火药以硝石、硫黄为主,草木灰为辅……而后火药成声”。其中涉及的主要反应为:。下列说法正确的是
A.电负性: B.分子中C原子为杂化
C.单质硫属于共价晶体 D.中化学键只有键
7.设NA为阿伏加德罗常数的值。下列说法正确的是
A.36g CaO2中阴离子数目为NA
B.20gH218O中含有的中子数为10NA
C.12g石墨晶体中含有碳碳键的数目为3NA
D.用浓盐酸和KClO3反应制备1mol氯气时,转移的电子数为2NA
8.火星气体及岩石中富含、、、四种元素。经研究:①、、、为原子序数递增的四种短周期元素;②为金属元素,且单质能与热水反应,反应液呈弱碱性;③、为同一主族元素,为地壳中含量最高的元素;④火星岩中含有难溶物,下列判断错误的是
A.位于第三周期ⅣA族B.火星气体中可能含有、
C.、最简氢化物的沸点:D.原子半径:
9.下列说法正确的是
A.物质中存在阳离子时一定存在阴离子
B.PbSO4难溶于水,其水溶液几乎不导电,故PbSO4是弱电解质
C.物质的量浓度相同的两种电解质溶液,导电能力弱的一定是弱电解质
D.电离平衡正移,电解质分子浓度不一定减小,离子浓度不一定增大
10.下列关于氮、磷、砷的单质及化合物的说法正确的是
A.中含有键
B.白磷分子是极性分子,白磷可保存在水中
C.肼的沸点为113.5℃,说明肼分子间可能存在氢键
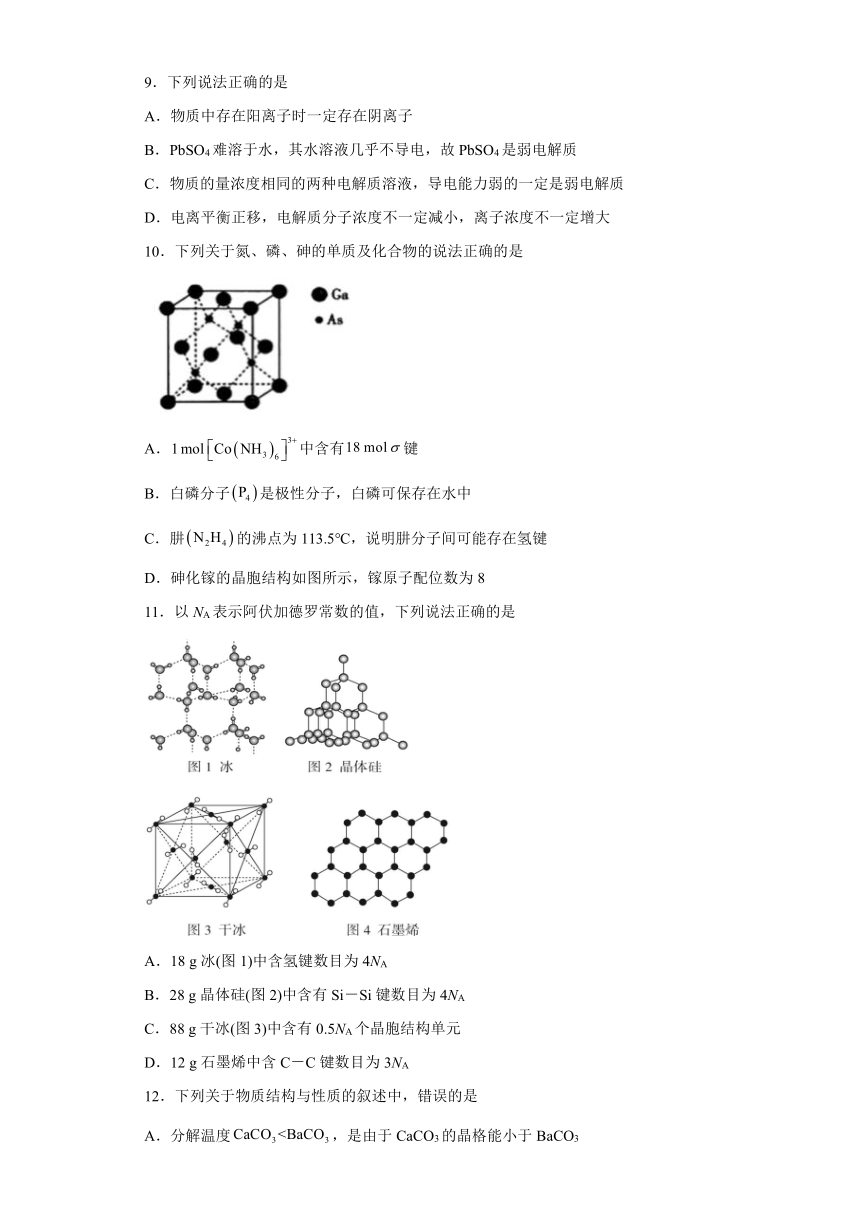
D.砷化镓的晶胞结构如图所示,镓原子配位数为8
11.以NA表示阿伏加德罗常数的值,下列说法正确的是
A.18 g冰(图1)中含氢键数目为4NA
B.28 g晶体硅(图2)中含有Si-Si键数目为4NA
C.88 g干冰(图3)中含有0.5NA个晶胞结构单元
D.12 g石墨烯中含C-C键数目为3NA
12.下列关于物质结构与性质的叙述中,错误的是
A.分解温度,是由于CaCO3的晶格能小于BaCO3
B.对于Cl的含氧酸来说,氯元素化合价越高,酸性越强
C.H-N-H键角:,NH3中N周围存在一对孤对电子
D.金属晶体存在“电子气”,具有良好导电性和导热性
二、非选择题(共10题)
13.下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题。
族 周期 IA 0
1 ① ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2 ② ③ ④
3 ⑤ ⑥ ⑦ ⑧
(1)元素②的原子结构示意图为_____。
(2)元素③、④、⑤、⑥原子半径由大到小为_____。
(3)上述8种元素中,非金属性最强的是_____。
(4)元素②、③形成的气态氢化物稳定性:_____>_____;元素①、③、⑤可形成既含离子键又含极性共价键的化合物,写出其电子式:_____。
(5)元素⑦的最高价氧化物对应的水化物与元素⑤最高价氧化物对应的水化物溶液反应的离子方程式为_____。
(6)从原子结构的角度解释元素③和⑦的非金属性强弱:_________________________。
14.在1到20号元素中,已知五种元素的核电荷数的大小顺序为F>A>B>D>E;A、F具有相同的电子层B、F具有相同的最外层电子数;A与B形成离子化合物A2B,A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10电子分子。
(1)写出D元素形成的单质的结构式______;E、F和B三种元素形成的化合物属于____(填晶体类型);写出B和E形成的化合物的化学式__________。
(2)在标准状况下,1克E的单质在足量的B的单质中完全反应,放出142.9kJ的热量,写出该反应的热化学方程式_______________________。
(3)元素Y的原子质子数比A多9,假如Y形成的强碱式量为M,把质量为mg的该强碱,在一定条件下,完全溶解在水中得到VmL饱和溶液,若此溶液的密度为,则该溶液中OH-离子的物质的量浓度为_______。
15.已知X、Y、Z、L、M、N是元素周期表中前20号的六种元素,它们的原子序数依次增大。X和Y可形成常见化合物YX4,一个YX4分子电子总数为10。L原子的最外层电子数是核外电子总数的3/4。NY2加水生成Y2X2和化合物甲。试回答:
(1)X单质和Z单质在一定条件下可生成化合物乙。
①乙的电子式为________________,化学键类型为________________,晶体类型为________________;
②实验室制取乙的化学方程式为_______________________________________。
(2)由M、Y、L三种元素组成的物质焰色反应显浅紫色,向其溶液中滴入酚酞溶液,溶液显红色,原因是__________________________(用离子方程式表示);若再向溶液中滴入过量的氯化钙溶液,观察到的实验现象是_____________________,原因是____________________________________________________________________。
(3)NY2与水反应生成Y2X2和化合物甲的化学方程式为__________________。
16.继密胺树脂/石墨烯量子点复合微球新型白光发光材料后,2019年8月13日中国科学院福建物质结构研究所合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料并获得了该化合物的LED器件。
(1)基态O原子能量最高的电子,其电子云在空间有_________个延展方向;C原子的基态电子排布式为_____________;
(2)NO3-与互为等电子体,构型为__________;苯-1,4-二硼酸甲基亚氨基二乙酸酯结构如图所示,硼原子和氮原子的杂化方式分别为__________、__________。
(3)可用检验,其对应的酸有两种,分别为硫氰酸(H S C≡N)和异硫氰酸(H N=C=S),这两种酸中沸点较高的是____________,试分析原因:________;热稳定性: _______(填“<”“>”或“=”)。
(4)超高热导率半导体材料——砷化硼(BAs)晶胞结构如图所示(As位于体内,B位于顶点和面心),已知晶胞参数为a pm,阿伏加德罗常数的值为,As原子到B原子最近距离为__________(用含a的式子表示),该晶体的密度是___________________g.cm-3 (列出含a、的计算式即可)。
17.铜在材料科学领域应用广泛。回答下列问题:
(1)基态Cu原子的核外电子有_______种运动状态,其价层电子排布式为_______。
(2)[Cu(H2O)4]SO4·H2O是一种蓝色晶体,焰色反应为绿色。
①H2O中O原子的杂化方式为_______。
②SO的立体构型为_______;与SO互为等电子体的分子有_______(写出一种分子式即可)。
③O、S、H的电负性由大到小的顺序为_______。
④很多金属元素进行焰色试验时火焰有特殊颜色,其微观原因为_______。
⑤[Cu(H2O)4]SO4·H2O的阳离子中存在的化学键类型为_______(填选项字母)。
a.配位键 b.离子键 c.共价键 d.氢键
18.下列各种变化,主要克服了哪种化学键或相互作用,同时说明理由。
(1)碘升华___________;
(2)氯化钠溶于水___________;
(3)氯化氢溶于水___________;
(4)金刚石高温熔化___________。
19.卤素钙钛矿已经被广泛应用于太阳能电池、发光二极体等领域,其中合成二维/三维(2D/3D)的钙钛矿异质结是提升器件稳定性和转换效率的一个策略,近期化学工作者在气相合成的单晶三维钙钛矿CsPbBr3上合成外延生长的水平和垂直的二维钙钛矿(PEA)2PbBr4(PEA+代表)异质结。回答下列问题:
(1)基态Br原子的价电子排布式为___。
(2)PEA+中N的价层电子对数为___,杂化轨道类型为___,PEA+中涉及元素的电负性由大到小的顺序为___,1molPEA+中存在___molσ键。
(3)已知铅卤化合物中存在正四面体构型的[PbCl4]2-、[PbBr4]2-、[PbI4]2-,三者中半径最小的配体为___。已知[Pb2I6]2-中每个Pb均采用四配位模式,则[Pb2I6]2-的结构式为___。
(4)Br2和碱金属单质形成的MBr熔点如表:
MBr NaBr KBr RbBr CsBr
熔点/℃ 747 734 693 636
等量NaBr、KBr、RbBr、CsBr同时开始加热优先导电的是____(填化学式),熔点呈现表中趋势的原因是____。
(5)已知三维立方钙钛矿CsPbBr3中三种离子在晶胞(a)中占据正方体顶点、面心、体心位置,图(b)显示的是三种离子在xz面、yz面、xy面上的位置:
若晶胞边长为apm,阿伏加德罗常数的值为NA,晶体的密度为___g·cm-3 (写出表达式)。
②上述晶胞沿体对角线方向的投影图为___(填标号)。
A. B. C. D.
20.化合物 A是近十年开始采用的锅炉水添加剂。A的相对分子质量90.10,可形成无色晶体,能除去锅炉水中溶解氧,并可使锅炉壁钝化。
(1)A是用碳酸二甲酯和一水合肼在70°C下合成的,收率80%。 画出A的结构式___________。
(2)写出合成A的反应方程式___________。
(3)低于135°C时,A直接与溶解氧反应,生成三种产物。写出化学方程式___________。
(4) 高于135°C时,A先发生水解,水解产物再与氧反应。写出化学方程式___________。
(5)化合物A能使锅炉壁钝化是基于它能将氧化铁转化为致密的四氧化三铁。写出化学方程式___________。
(6)化合物A与许多金属离子形成八面体配合物,例如[Mn(A)3]2+。 结构分析证实该配合物中的A和游离态的A相比,分子中原本等长的两个键不再等长。画出这种配合物的结构简图(氢原子不需画出),讨论异构现象___________。
21.如图所示,为NaCl晶体中Na+或Cl-所处的位置。这两种离子在空间三个互相垂直的方向上都是等距离排列的。
(1)在晶体中,每个Na+的周围与它最接近且距离相等的Na+共有_______个。
(2)晶体中每一个重复的结构单元叫晶胞。在NaCl晶胞中正六面体的顶角上、面上、棱上的Na+或Cl-为该晶胞与其相邻的晶胞所共有,一个晶胞中Cl-的个数等于_______,并列出计算式_______;Na+的个数等于_______,并列出计算式_______
(3)设NaCl的摩尔质量为M g/mol,食盐晶体的密度为ρ g/cm3,阿伏加德罗常数为NA,食盐晶体中两个距离最近的钠离子间的距离为_______cm
22.Fe、Co、Ni是三种重要的金属元素。回答下列问题:
CoO的面心立方晶胞如图所示。设阿伏加德罗常数的值为NA,则CoO晶体的密度为___________g﹒cm-3:三种元素二价氧化物的晶胞类型相同,其熔点由高到低的顺序为___________。
参考答案
1.C 2.A 3.A 4.D 5.C 6.B 7.B 8.D 9.D 10.C 11.C 12.A
13. Na>Al>O>F F H2O NH3 H++OH-=H2O O与S相比,电子层数少,原子核对最外层电子的吸引能力强,故易得到电子,故O的非金属性比S强
14.N≡N 分子晶体 H2O、H2O2 2H2(g)+O2(g)=2H2O(l) =-571.6kJ/mol mol/L
15. 极性共价键 分子晶体 2NH4Cl + Ca(OH)2 2NH3↑+ CaCl2 + 2H2O CO32- + H2OHCO3- + OH- 生成白色沉淀,且溶液红色褪去 加入过量CaCl2后,发生反应Ca2+ + CO32-=CaCO3↓,CO32-浓度减小,使水解平衡向逆反应方向移动,OH-浓度减小,溶液红色褪去 CaC2 + 2H2O→Ca(OH)2 + C2H2↑
16.3 平面正三角形 异硫氰酸(H N=C=S) 异硫氰酸分子中存在N—H键,硫氰酸分子中存在S—H键,N原子的电负性大于S原子,易形成分子间氢键 <
17.29 3d104s1 sp3 正四面体形 CCl4 O>S>H 电子从能量较高的激发态跃迁到能量较低的激发态乃至基态时,将以光的形式释放能量 ac
18.(1)分子间作用力;物理变化,分子没变
(2)离子键;电离成钠离子和氯离子了
(3)共价键;在水分子作用下,电离为H+和Cl-
(4)共价键;金刚石中C原子以共价键结合
19.(1)4s24p5
(2) 4 sp3 N>C>H 21
(3) Cl-
(4) CsBr NaBr、KBr、RbBr、CsBr均为离子晶体,离子所带电荷相同,阳离子半径依次增大,晶格能依次减小,熔点依次降低
(5) 或 A
20.注: C-N-N角必须不是直线。 O=C(OCH3)2 + 2H2NNH2·H2O = O=C(NHNH2)2 + 2CH3OH + 2H2O 。 (N2H3)2CO+ 2O2= 2N2+ CO2 +3H2O (N2H3)2CO + H2O= 2N2H4 + CO2。
N2H4+ O2=N2 + 2H2O (N2H3)2CO + 12Fe2O3= 8Fe3O4+ 2N2+ CO2 + 3H2O
有一对经式、面式异构体(几何异构体) 它们分别有一对对映异构体(手性异构体)
21.12 4 8×+6× 4 12×+1
22. NiO>CoO>FeO
一、单选题(共12题)
1.足球烯(C60)分子形成的晶体是碳的一种单质形态。下列说法错误的是
A.形成该单质的微粒间作用力为范德华力
B.足球烯晶体的熔沸点低于金刚石晶体
C.足球烯、石墨均可作为生产耐高温的润滑剂材料
D.足球烯在苯中的溶解度比在酒精中的溶解度大
2.在阳光照射下,水和氧气在浸泡过溶液的三噻吩()聚合物表面能高效合成过氧化氢,下列说法不正确的是
A.的电子式为: B.为极性分子
C.为离子晶体 D.的结构示意图为
3.下列关于物质结构的说法错误的是
A.甲醛()和光气()分子中的键角
B.基态氮原子有三种能量不同的电子
C.熔点:
D.的空间构型为四面体形
4.一种以苦卤水(主要成分是、)为原料制备无水的工艺流程如下:
下列说法正确的是
A.滤液中大量存在、、
B.“煅烧”后的产物溶于稀盐酸,将所得溶液加热蒸干也可得到无水
C.1个干冰晶胞(见右图)中含14个
D.“高温氯化”时的反应为
5.将Na、Na2O、NaOH、Na2S、Na2SO3分别加热熔化,需要克服相同类型作用力的物质有
A.2种 B.3种 C.4种 D.5种
6.《天工开物》记载:“凡火药以硝石、硫黄为主,草木灰为辅……而后火药成声”。其中涉及的主要反应为:。下列说法正确的是
A.电负性: B.分子中C原子为杂化
C.单质硫属于共价晶体 D.中化学键只有键
7.设NA为阿伏加德罗常数的值。下列说法正确的是
A.36g CaO2中阴离子数目为NA
B.20gH218O中含有的中子数为10NA
C.12g石墨晶体中含有碳碳键的数目为3NA
D.用浓盐酸和KClO3反应制备1mol氯气时,转移的电子数为2NA
8.火星气体及岩石中富含、、、四种元素。经研究:①、、、为原子序数递增的四种短周期元素;②为金属元素,且单质能与热水反应,反应液呈弱碱性;③、为同一主族元素,为地壳中含量最高的元素;④火星岩中含有难溶物,下列判断错误的是
A.位于第三周期ⅣA族B.火星气体中可能含有、
C.、最简氢化物的沸点:D.原子半径:
9.下列说法正确的是
A.物质中存在阳离子时一定存在阴离子
B.PbSO4难溶于水,其水溶液几乎不导电,故PbSO4是弱电解质
C.物质的量浓度相同的两种电解质溶液,导电能力弱的一定是弱电解质
D.电离平衡正移,电解质分子浓度不一定减小,离子浓度不一定增大
10.下列关于氮、磷、砷的单质及化合物的说法正确的是
A.中含有键
B.白磷分子是极性分子,白磷可保存在水中
C.肼的沸点为113.5℃,说明肼分子间可能存在氢键
D.砷化镓的晶胞结构如图所示,镓原子配位数为8
11.以NA表示阿伏加德罗常数的值,下列说法正确的是
A.18 g冰(图1)中含氢键数目为4NA
B.28 g晶体硅(图2)中含有Si-Si键数目为4NA
C.88 g干冰(图3)中含有0.5NA个晶胞结构单元
D.12 g石墨烯中含C-C键数目为3NA
12.下列关于物质结构与性质的叙述中,错误的是
A.分解温度,是由于CaCO3的晶格能小于BaCO3
B.对于Cl的含氧酸来说,氯元素化合价越高,酸性越强
C.H-N-H键角:,NH3中N周围存在一对孤对电子
D.金属晶体存在“电子气”,具有良好导电性和导热性
二、非选择题(共10题)
13.下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题。
族 周期 IA 0
1 ① ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2 ② ③ ④
3 ⑤ ⑥ ⑦ ⑧
(1)元素②的原子结构示意图为_____。
(2)元素③、④、⑤、⑥原子半径由大到小为_____。
(3)上述8种元素中,非金属性最强的是_____。
(4)元素②、③形成的气态氢化物稳定性:_____>_____;元素①、③、⑤可形成既含离子键又含极性共价键的化合物,写出其电子式:_____。
(5)元素⑦的最高价氧化物对应的水化物与元素⑤最高价氧化物对应的水化物溶液反应的离子方程式为_____。
(6)从原子结构的角度解释元素③和⑦的非金属性强弱:_________________________。
14.在1到20号元素中,已知五种元素的核电荷数的大小顺序为F>A>B>D>E;A、F具有相同的电子层B、F具有相同的最外层电子数;A与B形成离子化合物A2B,A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10电子分子。
(1)写出D元素形成的单质的结构式______;E、F和B三种元素形成的化合物属于____(填晶体类型);写出B和E形成的化合物的化学式__________。
(2)在标准状况下,1克E的单质在足量的B的单质中完全反应,放出142.9kJ的热量,写出该反应的热化学方程式_______________________。
(3)元素Y的原子质子数比A多9,假如Y形成的强碱式量为M,把质量为mg的该强碱,在一定条件下,完全溶解在水中得到VmL饱和溶液,若此溶液的密度为,则该溶液中OH-离子的物质的量浓度为_______。
15.已知X、Y、Z、L、M、N是元素周期表中前20号的六种元素,它们的原子序数依次增大。X和Y可形成常见化合物YX4,一个YX4分子电子总数为10。L原子的最外层电子数是核外电子总数的3/4。NY2加水生成Y2X2和化合物甲。试回答:
(1)X单质和Z单质在一定条件下可生成化合物乙。
①乙的电子式为________________,化学键类型为________________,晶体类型为________________;
②实验室制取乙的化学方程式为_______________________________________。
(2)由M、Y、L三种元素组成的物质焰色反应显浅紫色,向其溶液中滴入酚酞溶液,溶液显红色,原因是__________________________(用离子方程式表示);若再向溶液中滴入过量的氯化钙溶液,观察到的实验现象是_____________________,原因是____________________________________________________________________。
(3)NY2与水反应生成Y2X2和化合物甲的化学方程式为__________________。
16.继密胺树脂/石墨烯量子点复合微球新型白光发光材料后,2019年8月13日中国科学院福建物质结构研究所合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料并获得了该化合物的LED器件。
(1)基态O原子能量最高的电子,其电子云在空间有_________个延展方向;C原子的基态电子排布式为_____________;
(2)NO3-与互为等电子体,构型为__________;苯-1,4-二硼酸甲基亚氨基二乙酸酯结构如图所示,硼原子和氮原子的杂化方式分别为__________、__________。
(3)可用检验,其对应的酸有两种,分别为硫氰酸(H S C≡N)和异硫氰酸(H N=C=S),这两种酸中沸点较高的是____________,试分析原因:________;热稳定性: _______(填“<”“>”或“=”)。
(4)超高热导率半导体材料——砷化硼(BAs)晶胞结构如图所示(As位于体内,B位于顶点和面心),已知晶胞参数为a pm,阿伏加德罗常数的值为,As原子到B原子最近距离为__________(用含a的式子表示),该晶体的密度是___________________g.cm-3 (列出含a、的计算式即可)。
17.铜在材料科学领域应用广泛。回答下列问题:
(1)基态Cu原子的核外电子有_______种运动状态,其价层电子排布式为_______。
(2)[Cu(H2O)4]SO4·H2O是一种蓝色晶体,焰色反应为绿色。
①H2O中O原子的杂化方式为_______。
②SO的立体构型为_______;与SO互为等电子体的分子有_______(写出一种分子式即可)。
③O、S、H的电负性由大到小的顺序为_______。
④很多金属元素进行焰色试验时火焰有特殊颜色,其微观原因为_______。
⑤[Cu(H2O)4]SO4·H2O的阳离子中存在的化学键类型为_______(填选项字母)。
a.配位键 b.离子键 c.共价键 d.氢键
18.下列各种变化,主要克服了哪种化学键或相互作用,同时说明理由。
(1)碘升华___________;
(2)氯化钠溶于水___________;
(3)氯化氢溶于水___________;
(4)金刚石高温熔化___________。
19.卤素钙钛矿已经被广泛应用于太阳能电池、发光二极体等领域,其中合成二维/三维(2D/3D)的钙钛矿异质结是提升器件稳定性和转换效率的一个策略,近期化学工作者在气相合成的单晶三维钙钛矿CsPbBr3上合成外延生长的水平和垂直的二维钙钛矿(PEA)2PbBr4(PEA+代表)异质结。回答下列问题:
(1)基态Br原子的价电子排布式为___。
(2)PEA+中N的价层电子对数为___,杂化轨道类型为___,PEA+中涉及元素的电负性由大到小的顺序为___,1molPEA+中存在___molσ键。
(3)已知铅卤化合物中存在正四面体构型的[PbCl4]2-、[PbBr4]2-、[PbI4]2-,三者中半径最小的配体为___。已知[Pb2I6]2-中每个Pb均采用四配位模式,则[Pb2I6]2-的结构式为___。
(4)Br2和碱金属单质形成的MBr熔点如表:
MBr NaBr KBr RbBr CsBr
熔点/℃ 747 734 693 636
等量NaBr、KBr、RbBr、CsBr同时开始加热优先导电的是____(填化学式),熔点呈现表中趋势的原因是____。
(5)已知三维立方钙钛矿CsPbBr3中三种离子在晶胞(a)中占据正方体顶点、面心、体心位置,图(b)显示的是三种离子在xz面、yz面、xy面上的位置:
若晶胞边长为apm,阿伏加德罗常数的值为NA,晶体的密度为___g·cm-3 (写出表达式)。
②上述晶胞沿体对角线方向的投影图为___(填标号)。
A. B. C. D.
20.化合物 A是近十年开始采用的锅炉水添加剂。A的相对分子质量90.10,可形成无色晶体,能除去锅炉水中溶解氧,并可使锅炉壁钝化。
(1)A是用碳酸二甲酯和一水合肼在70°C下合成的,收率80%。 画出A的结构式___________。
(2)写出合成A的反应方程式___________。
(3)低于135°C时,A直接与溶解氧反应,生成三种产物。写出化学方程式___________。
(4) 高于135°C时,A先发生水解,水解产物再与氧反应。写出化学方程式___________。
(5)化合物A能使锅炉壁钝化是基于它能将氧化铁转化为致密的四氧化三铁。写出化学方程式___________。
(6)化合物A与许多金属离子形成八面体配合物,例如[Mn(A)3]2+。 结构分析证实该配合物中的A和游离态的A相比,分子中原本等长的两个键不再等长。画出这种配合物的结构简图(氢原子不需画出),讨论异构现象___________。
21.如图所示,为NaCl晶体中Na+或Cl-所处的位置。这两种离子在空间三个互相垂直的方向上都是等距离排列的。
(1)在晶体中,每个Na+的周围与它最接近且距离相等的Na+共有_______个。
(2)晶体中每一个重复的结构单元叫晶胞。在NaCl晶胞中正六面体的顶角上、面上、棱上的Na+或Cl-为该晶胞与其相邻的晶胞所共有,一个晶胞中Cl-的个数等于_______,并列出计算式_______;Na+的个数等于_______,并列出计算式_______
(3)设NaCl的摩尔质量为M g/mol,食盐晶体的密度为ρ g/cm3,阿伏加德罗常数为NA,食盐晶体中两个距离最近的钠离子间的距离为_______cm
22.Fe、Co、Ni是三种重要的金属元素。回答下列问题:
CoO的面心立方晶胞如图所示。设阿伏加德罗常数的值为NA,则CoO晶体的密度为___________g﹒cm-3:三种元素二价氧化物的晶胞类型相同,其熔点由高到低的顺序为___________。
参考答案
1.C 2.A 3.A 4.D 5.C 6.B 7.B 8.D 9.D 10.C 11.C 12.A
13. Na>Al>O>F F H2O NH3 H++OH-=H2O O与S相比,电子层数少,原子核对最外层电子的吸引能力强,故易得到电子,故O的非金属性比S强
14.N≡N 分子晶体 H2O、H2O2 2H2(g)+O2(g)=2H2O(l) =-571.6kJ/mol mol/L
15. 极性共价键 分子晶体 2NH4Cl + Ca(OH)2 2NH3↑+ CaCl2 + 2H2O CO32- + H2OHCO3- + OH- 生成白色沉淀,且溶液红色褪去 加入过量CaCl2后,发生反应Ca2+ + CO32-=CaCO3↓,CO32-浓度减小,使水解平衡向逆反应方向移动,OH-浓度减小,溶液红色褪去 CaC2 + 2H2O→Ca(OH)2 + C2H2↑
16.3 平面正三角形 异硫氰酸(H N=C=S) 异硫氰酸分子中存在N—H键,硫氰酸分子中存在S—H键,N原子的电负性大于S原子,易形成分子间氢键 <
17.29 3d104s1 sp3 正四面体形 CCl4 O>S>H 电子从能量较高的激发态跃迁到能量较低的激发态乃至基态时,将以光的形式释放能量 ac
18.(1)分子间作用力;物理变化,分子没变
(2)离子键;电离成钠离子和氯离子了
(3)共价键;在水分子作用下,电离为H+和Cl-
(4)共价键;金刚石中C原子以共价键结合
19.(1)4s24p5
(2) 4 sp3 N>C>H 21
(3) Cl-
(4) CsBr NaBr、KBr、RbBr、CsBr均为离子晶体,离子所带电荷相同,阳离子半径依次增大,晶格能依次减小,熔点依次降低
(5) 或 A
20.注: C-N-N角必须不是直线。 O=C(OCH3)2 + 2H2NNH2·H2O = O=C(NHNH2)2 + 2CH3OH + 2H2O 。 (N2H3)2CO+ 2O2= 2N2+ CO2 +3H2O (N2H3)2CO + H2O= 2N2H4 + CO2。
N2H4+ O2=N2 + 2H2O (N2H3)2CO + 12Fe2O3= 8Fe3O4+ 2N2+ CO2 + 3H2O
有一对经式、面式异构体(几何异构体) 它们分别有一对对映异构体(手性异构体)
21.12 4 8×+6× 4 12×+1
22. NiO>CoO>FeO
