铁及其化合物
图片预览









文档简介
(共30张PPT)
第4~5课时 铁及其化合物
课 前 热 身
1下列有关纯铁的描述正确的是( )
A.熔点比生铁低
B.与相同浓度的盐酸反应生成氢气的速率比生铁快.
C.在潮湿空气中比生铁易生锈.
D.在冷的浓硫酸中可钝化.
D
2下列除去杂质的实验方法正确的是
A.除去CO中少量O2:通过灼热的Cu网后再收集气体
B.除去K2CO3固体中少量NaHCO3:置于坩埚中加热
C.除去苯中溶有的少量苯酚:加入适量浓溴水反应后过滤
D.除去FeCl3酸性溶液中少量的FeCl2:加入稍过量双氧水后放置
D
3、下列各物质中,不能由组成它的两种元素的单质直接化合而得到的是( )
A、FeS B、Fe3O4 C、FeCl3 D、FeCl2
D
4.某溶液中有NH4+、Mg2+、Fe2+、Al3+四种阳离子,若向其中加入过量的氢氧化钠并微热搅拌,再加入盐酸,溶液中大量减少的阳离子是( )
A、NH4+ B、Mg2+
C、Fe2+ D、Al3+
A
C
5.05年理综3)A、B两种固体,都由甲、乙两种元素组成。在A、B中,甲、乙两种元素的原子个数比分别为1:1和1:2,高温煅烧A、B时,产物都是C(固体)和D(气体)。由D可制得E(酸)。E和另一种酸组成的混合酸跟甲苯反应可生成三硝基甲苯。C与E的稀溶液反应得到溶液F,往F溶液中加入氢氧化钠溶液,有红褐色沉淀生成,该沉淀经灼烧后转变成C。往F溶液中加入甲元素的单质得到溶液G。试根据以上信息填写下列空白: (1)A的化学式(分子式)是 ; (2)B煅烧生成C和D的化学方程式是 ;甲元素的单质与F溶液反应的离子方程式是 ; (3)往G溶液中加入NaOH溶液发生的现象是 ;
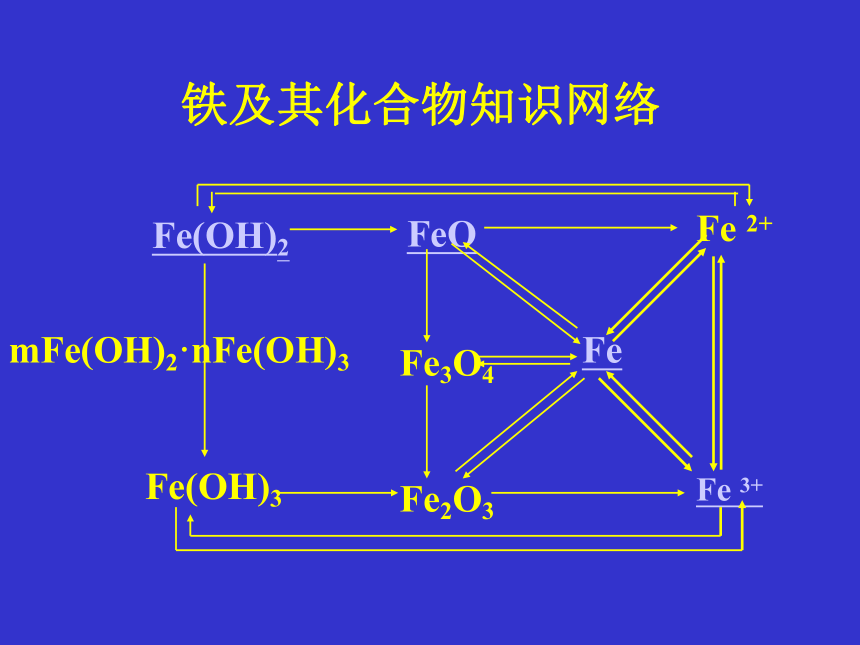
Fe(OH)2
FeO
Fe 2+
Fe(OH)3
Fe3O4
Fe2O3
Fe
Fe 3+
mFe(OH)2·nFe(OH)3
铁及其化合物知识网络
+26
2
8
2
14
1、过渡元素概念
2、原子结构:Fe位于第 周期第 族,属于过渡元素;原子结构示意图
常见离子 。
3、物理性质: (1)纯铁晶体 色,抗蚀能力强;
常用铁含 ,熔点降低,抗蚀力减弱。
(2)具有一般金属的物理通性 。
四
VIII
Fe2+
Fe3+
电和热的良导体、延展性;
C
银白
特性:能被磁体吸引,具铁磁性.
要点·疑点·考点
4、铁的化学性质:
(1)与非金属反应
(2)与水反应
(3)与酸反应
(4)与盐溶液反应
(1)与非金属单质反应
①与O2反应
常温,干燥时与O2不反应
常温,潮湿时空气中电化腐蚀
加热时,3Fe+2O2==Fe3O4
高温
②与Cl2反应
加热才反应,2Fe+3Cl2==2FeCl3 (液氯可用钢瓶)
高温
③与S反应
加热时,Fe+S==FeS
高温
(2)、与水反应:
高温
常温下通常不与水反应
高温时可以反应,方程式:
常温下浓硝酸、浓硫酸使铁发生钝化,在加热条件下铁被氧化;
稀硝酸能使铁迅速发生氧化反应。
(3)与酸反应
a.与非氧化性酸反应,如盐酸、稀硫酸。
b.与氧化性酸反应,如硝酸、浓硫酸。
Fe+2H+==Fe2++H2↑
Fe+NO3-+4H+==Fe3++2H2O +NO ↑
3Fe+2NO3-+8H+==3Fe2++4H2O +2NO ↑
思考:一定质量的铁溶于一定量的稀硝酸中,则铁与稀硝酸中HNO3的物质的量之比为( ) ①1:4②3:8③3:16④2:9
(4)与盐溶液反应
Fe+2FeCl3=3FeCl2
Fe+CuCl2=FeCl2+Cu
Fe
Fe3+
弱氧化剂:I2、S、 Fe3+及金属活动性顺序表中铁后面的金属阳离子
强氧化剂: Cl2、Br2、HNO3、MnO4--、 H2O2、浓H2SO4
Fe3O4
(O2和水在一定条件下)
Fe2+
二、铁的重要化合物
1、铁的氧化物
氧化亚铁
FeO 三氧化二铁 Fe2O3 四氧化三铁 Fe3O4(FeO Fe2O3)
色态
俗称
铁元素价态
溶解性
稳定性
与酸反应
黑色粉末
红棕色粉末
黑色晶体
+2
+3
+2、+3
难溶于水
难溶于水
难溶于水
不稳定
稳定
稳定
FeO+2H+=
Fe2++H2O
Fe2O3+6H+=
2Fe3++3H2O
Fe3O4+8H+=
2Fe3++ Fe2+ +4H2O
铁红
磁性氧化铁
2、铁的氢氧化物
氢氧化亚铁Fe(OH)2 氢氧化铁Fe(OH)3
制法
颜色
溶解性
稳定性
Fe2++2OH-=Fe(OH)2↓ (隔绝空气)
Fe3++3OH-=Fe(OH)3↓
白色
红褐色
难溶于水
难溶于水
受热易分解
极易被空气中氧气氧化成氢氧化铁
4Fe(OH)2+2H2O+O2
=4Fe(OH)3
2Fe(OH)3== Fe2O3+3H2O
△
思考:Fe(OH)2 不稳定易被氧化,那么制备Fe(OH)2 应注意哪些问题?
1、使用新制的FeSO4 2、使用加热煮沸法驱除氧气的氢氧化钠溶液
3、滴管末端伸入液面以下
4、有时可以采用液封(有机溶剂)
5、特殊的装置和方法()
1、Fe(OH)2的制备
方法一:用不含 Fe3+ 的 FeSO4 溶液与用不含 O2 的蒸馏水配制的 NaOH 溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入
(2)除去蒸馏水中溶解的O2常采用 的方法。
(3)生成白色氢氧化亚铁沉淀的操作是用长滴管吸取不含 O2 的 NaOH 溶液,插入FeSO4溶液液面下,再挤出 NaOH 溶液。这样操作的理由是
铁粉和少量H2SO4
加热煮沸
避免带入空气而使Fe(OH)2氧化,从而导致看不到白色沉淀。
重点注意点
ⅰ.电解法
思考:电解制取Fe(OH)2时用什么作电极材料和电解质溶液?
ⅱ:在如图装置中,用 NaOH溶液、铁屑、稀 H2SO4 等试剂制备。
(1)在试管Ⅰ里加入的试剂是:
(2)在试管Ⅱ里加入的试剂是 :
(3)为了制得白色的氢氧化亚铁沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是:
(4)这样生成的氢氧化亚铁沉淀能较长时间保持白色,其理由是
稀H2SO4和Fe
NaOH溶液
容器内只有H2而无空气, Fe(OH)2不易被氧化
打开止水夹,使Ⅰ管开始反应一段时间后再夹紧止水夹
总结:Fe、Fe、Fe之间的转化关系
+2
+3
Fe
Fe
+2
Fe
+3
S I2 Cu2+ Fe3+ H+
Zn Al CO H2
O2 Cl2 Br2 H2O2 HNO 3H2SO4(浓)
Al CO H2 Fe Cu SO2 S2- I- SO32-
O2 Cl2 Br2 HNO3 H2SO4(浓)
Al Zn C CO H2
“铁三角”中重要的离子反应式或化学方程式:
①2Fe2++Cl2=2Fe3++2Cl-
②2Fe2++H2O2+2H+=2Fe3++2H2O
③2Fe3++H2S=2Fe2++S↓+2H+
④ 2Fe3++Cu=2Fe2++Cu2+
⑤2Fe3++SO2+2H2O=2Fe2++4H++SO42-
⑥ 2Fe3++2I-=2Fe2++I2
⑦2Fe3++Fe=3Fe2+
⑧3Fe3O4+8Al=4Al2O3+9Fe
⑨3Fe + 4H2O Fe3O4 + 4H2
⑩Fe2O3 + 3CO 2Fe + 3CO2
二价铁盐与三价铁盐的相互转化
(1)二价铁盐既有氧化性又有还原性,以还原性为主。亚铁盐溶液在保存时,应在溶液中放少量铁粉以防其被氧化,同时滴加少量的相应酸以防其水解。
①硫酸亚铁在空气中变质的化学方程式:12FeSO4+3O2+6H2O=4Fe2(SO4)3+4Fe(OH)3
②硫酸亚铁溶液被次氯酸钠氧化的化学方程式:
6FeSO4+3NaClO+3H2O=2Fe2(SO4)3+2Fe(OH)3↓+3NaCl
二价铁在氧化过程中由于价态升高,需结合更多的阴离子,阴离子的来源主要有两个途径:
一是酸化,二是还原产物。
(2)三价铁盐具有较强的氧化性和水解程度。
①氯化铁腐蚀铜:Cu+2FeCl3=CuCl2+2FeCl2
②氯化铁氧化二氧化硫:
SO2+2FeCl3+H2O=H2SO4+2FeCl2+2HCl
三价铁在还原过程中价态降低,结合阴离子数目减少,多出的阴离子形成酸或其他盐。
③在FeCl3溶液中加入碳酸盐、金属氧化物以及较活泼金属时,常需考虑促进Fe3+水解的反应;且在保存Fe3+的溶液时,需加入相应的酸抑制水解。
思考:在MgCl2溶液中含少量Fe3+,可加入哪种物质后过滤而除去Fe3+?
解题回顾:
对难水解的金属活泼性的强酸盐中含Fe3+时,常可加入相应金属的氧化物、碳酸盐、氢氧化物金属单质等而促进Fe3+离子水解,过滤除去。
三、Fe3+离子的检验
Fe3++SCN-=[Fe(SCN)]2+(血红色)
Fe2+与SCN-反应不显色,故检验Fe3+的
存在可用含SCN-离子的溶液作试剂。
讨论:如何鉴别Fe2+与Fe3+?
1、通过颜色比较
2、通过加碱观察现象
3、加kSCN观察颜色
4、加苯酚观察颜色
直 接 观 色
与KSCN
与苯 酚
显色反应
利用
氧化反应
利 用
与 铜 片
与 淀 粉
KI 试 纸
鉴 别方 法
浅 绿 色
棕 黄 色
血 红 色
不显红色
不显紫色 显 紫 色
无明显现象
Cu被腐蚀 溶液变绿色
试纸不变蓝 试纸变蓝色
白色沉淀迅速变灰绿色最后呈红褐色
立即产生红
褐色沉淀
水解反应
利 用
沉淀反应
利 用
与CO32-、HCO3-
ClO-、HSO3-等反应
白色沉淀迅速变灰
绿色最后呈红褐色
立即产生红
褐色沉淀
Fe2+ 、Fe3+与 碱作用
Fe2+
Fe3+
⑴Fe2+:在酸性条件下不能与氧化性离子大量共存,如硝酸根、高锰酸根、次氯酸根等。也不能与发生复分解反应的离子大量共存。
⑵ Fe3+:不能与还原性离子大量共存。如:I-、S2- 等。也不能与发生复分解反应和双水解反应的离子大量共存。
离子共存问题:
据此推断:
(1)在A、B、C这三种化合物中必定存在x元素的是______.
(2)若x为非金属时,A为_________,B为_______.
(3)若X和Y均为金属时,A为_______, B为__ __.
[练习] x,y,z是三种常见非金属与金属单质,A、B、C是三种常见氧化物(其中只少有一种具有高熔点).相互间存在如下关系:
A C
CO2
MgO
Fe2O3
Al2O3
【例】(2000年全国高考题)久置于空气中的下列物质,因被氧化而呈黄色的是 ( )
A.浓HNO3 B.氯化亚铁溶液 C.溴苯 D.溴化银
B
【解题回顾】
本题考查的是常见的“黄色体系”有以下几种固体:溴化银、碘化银(不溶于水和硝酸,光照分解)、磷酸银(不溶于水但溶于强酸)、硫(不溶于水溶于CS2,可由两种气体生成)、过氧化钠(与水反应产生气体)、三硝基甲苯(炸药,有机物); 外加几种黄色溶液:
浓HNO3(因溶液中有NO2气体)、工业盐酸(含Fe3+离子)、不纯的硝基苯(因溶有NO2)、亚铁盐溶液(因含Fe3+离子)等。
北京05)某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)
(1)装置B中发生反应的化学方程式是 。
(2)装置E中的现象是 。
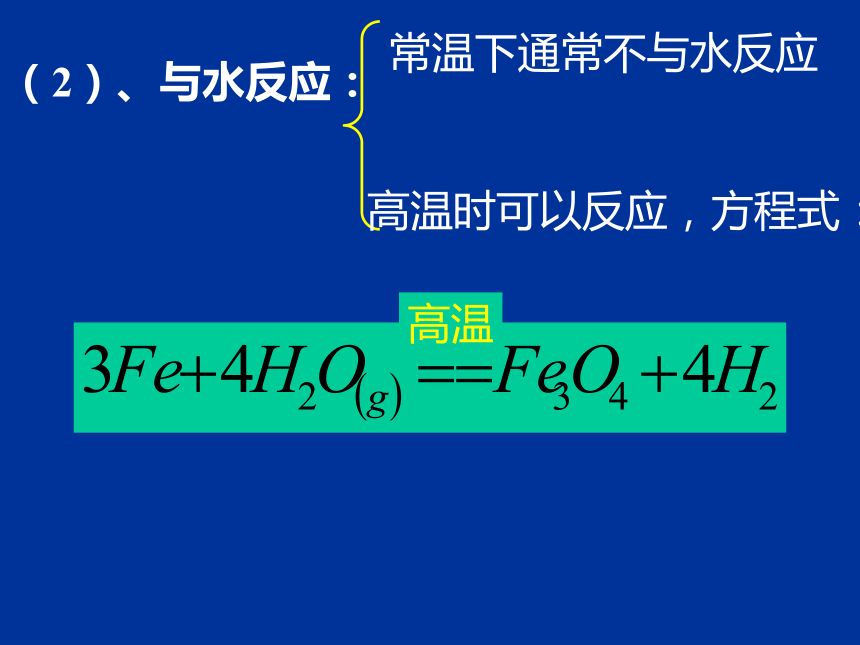
3Fe+4H2O(g) === Fe3O4+4H2
高温
黑色固体变红,右端管壁有水珠
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法:
。
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
滤液 FeCl3溶液 FeCl3·6H2O晶体 ①步骤I中通入Cl2的作用是 。
②步骤II从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括 。
③该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明)
。
Cl2
I
II
取少量滤液,滴入几滴KSCN溶液,观察溶液是否变红色
将Fe2+氧化成Fe3+
加热浓缩。冷却结晶,过滤
3Fe3++3H2O Fe(OH)3+3H+,过量盐酸抑制FeCl3水解
第4~5课时 铁及其化合物
课 前 热 身
1下列有关纯铁的描述正确的是( )
A.熔点比生铁低
B.与相同浓度的盐酸反应生成氢气的速率比生铁快.
C.在潮湿空气中比生铁易生锈.
D.在冷的浓硫酸中可钝化.
D
2下列除去杂质的实验方法正确的是
A.除去CO中少量O2:通过灼热的Cu网后再收集气体
B.除去K2CO3固体中少量NaHCO3:置于坩埚中加热
C.除去苯中溶有的少量苯酚:加入适量浓溴水反应后过滤
D.除去FeCl3酸性溶液中少量的FeCl2:加入稍过量双氧水后放置
D
3、下列各物质中,不能由组成它的两种元素的单质直接化合而得到的是( )
A、FeS B、Fe3O4 C、FeCl3 D、FeCl2
D
4.某溶液中有NH4+、Mg2+、Fe2+、Al3+四种阳离子,若向其中加入过量的氢氧化钠并微热搅拌,再加入盐酸,溶液中大量减少的阳离子是( )
A、NH4+ B、Mg2+
C、Fe2+ D、Al3+
A
C
5.05年理综3)A、B两种固体,都由甲、乙两种元素组成。在A、B中,甲、乙两种元素的原子个数比分别为1:1和1:2,高温煅烧A、B时,产物都是C(固体)和D(气体)。由D可制得E(酸)。E和另一种酸组成的混合酸跟甲苯反应可生成三硝基甲苯。C与E的稀溶液反应得到溶液F,往F溶液中加入氢氧化钠溶液,有红褐色沉淀生成,该沉淀经灼烧后转变成C。往F溶液中加入甲元素的单质得到溶液G。试根据以上信息填写下列空白: (1)A的化学式(分子式)是 ; (2)B煅烧生成C和D的化学方程式是 ;甲元素的单质与F溶液反应的离子方程式是 ; (3)往G溶液中加入NaOH溶液发生的现象是 ;
Fe(OH)2
FeO
Fe 2+
Fe(OH)3
Fe3O4
Fe2O3
Fe
Fe 3+
mFe(OH)2·nFe(OH)3
铁及其化合物知识网络
+26
2
8
2
14
1、过渡元素概念
2、原子结构:Fe位于第 周期第 族,属于过渡元素;原子结构示意图
常见离子 。
3、物理性质: (1)纯铁晶体 色,抗蚀能力强;
常用铁含 ,熔点降低,抗蚀力减弱。
(2)具有一般金属的物理通性 。
四
VIII
Fe2+
Fe3+
电和热的良导体、延展性;
C
银白
特性:能被磁体吸引,具铁磁性.
要点·疑点·考点
4、铁的化学性质:
(1)与非金属反应
(2)与水反应
(3)与酸反应
(4)与盐溶液反应
(1)与非金属单质反应
①与O2反应
常温,干燥时与O2不反应
常温,潮湿时空气中电化腐蚀
加热时,3Fe+2O2==Fe3O4
高温
②与Cl2反应
加热才反应,2Fe+3Cl2==2FeCl3 (液氯可用钢瓶)
高温
③与S反应
加热时,Fe+S==FeS
高温
(2)、与水反应:
高温
常温下通常不与水反应
高温时可以反应,方程式:
常温下浓硝酸、浓硫酸使铁发生钝化,在加热条件下铁被氧化;
稀硝酸能使铁迅速发生氧化反应。
(3)与酸反应
a.与非氧化性酸反应,如盐酸、稀硫酸。
b.与氧化性酸反应,如硝酸、浓硫酸。
Fe+2H+==Fe2++H2↑
Fe+NO3-+4H+==Fe3++2H2O +NO ↑
3Fe+2NO3-+8H+==3Fe2++4H2O +2NO ↑
思考:一定质量的铁溶于一定量的稀硝酸中,则铁与稀硝酸中HNO3的物质的量之比为( ) ①1:4②3:8③3:16④2:9
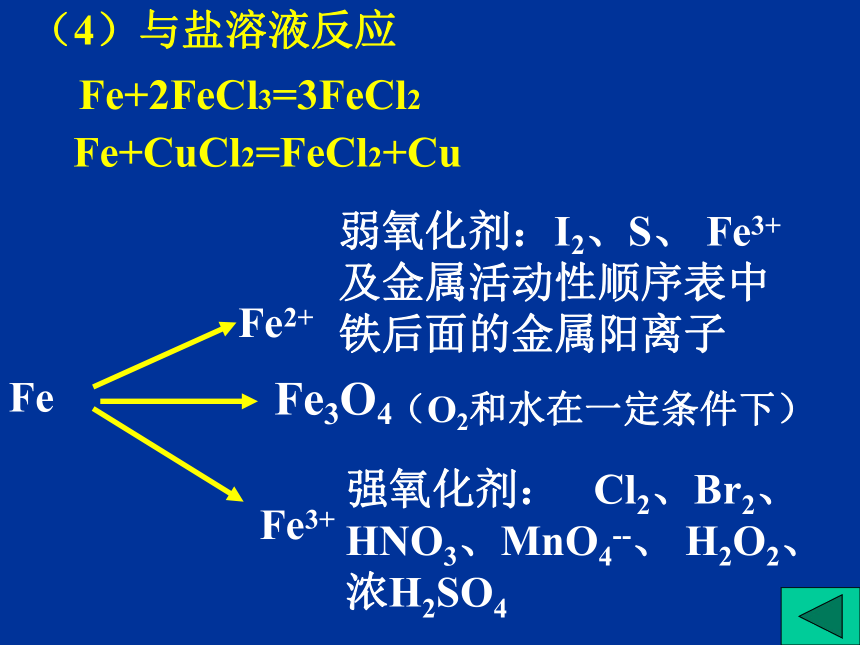
(4)与盐溶液反应
Fe+2FeCl3=3FeCl2
Fe+CuCl2=FeCl2+Cu
Fe
Fe3+
弱氧化剂:I2、S、 Fe3+及金属活动性顺序表中铁后面的金属阳离子
强氧化剂: Cl2、Br2、HNO3、MnO4--、 H2O2、浓H2SO4
Fe3O4
(O2和水在一定条件下)
Fe2+
二、铁的重要化合物
1、铁的氧化物
氧化亚铁
FeO 三氧化二铁 Fe2O3 四氧化三铁 Fe3O4(FeO Fe2O3)
色态
俗称
铁元素价态
溶解性
稳定性
与酸反应
黑色粉末
红棕色粉末
黑色晶体
+2
+3
+2、+3
难溶于水
难溶于水
难溶于水
不稳定
稳定
稳定
FeO+2H+=
Fe2++H2O
Fe2O3+6H+=
2Fe3++3H2O
Fe3O4+8H+=
2Fe3++ Fe2+ +4H2O
铁红
磁性氧化铁
2、铁的氢氧化物
氢氧化亚铁Fe(OH)2 氢氧化铁Fe(OH)3
制法
颜色
溶解性
稳定性
Fe2++2OH-=Fe(OH)2↓ (隔绝空气)
Fe3++3OH-=Fe(OH)3↓
白色
红褐色
难溶于水
难溶于水
受热易分解
极易被空气中氧气氧化成氢氧化铁
4Fe(OH)2+2H2O+O2
=4Fe(OH)3
2Fe(OH)3== Fe2O3+3H2O
△
思考:Fe(OH)2 不稳定易被氧化,那么制备Fe(OH)2 应注意哪些问题?
1、使用新制的FeSO4 2、使用加热煮沸法驱除氧气的氢氧化钠溶液
3、滴管末端伸入液面以下
4、有时可以采用液封(有机溶剂)
5、特殊的装置和方法()
1、Fe(OH)2的制备
方法一:用不含 Fe3+ 的 FeSO4 溶液与用不含 O2 的蒸馏水配制的 NaOH 溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入
(2)除去蒸馏水中溶解的O2常采用 的方法。
(3)生成白色氢氧化亚铁沉淀的操作是用长滴管吸取不含 O2 的 NaOH 溶液,插入FeSO4溶液液面下,再挤出 NaOH 溶液。这样操作的理由是
铁粉和少量H2SO4
加热煮沸
避免带入空气而使Fe(OH)2氧化,从而导致看不到白色沉淀。
重点注意点
ⅰ.电解法
思考:电解制取Fe(OH)2时用什么作电极材料和电解质溶液?
ⅱ:在如图装置中,用 NaOH溶液、铁屑、稀 H2SO4 等试剂制备。
(1)在试管Ⅰ里加入的试剂是:
(2)在试管Ⅱ里加入的试剂是 :
(3)为了制得白色的氢氧化亚铁沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是:
(4)这样生成的氢氧化亚铁沉淀能较长时间保持白色,其理由是
稀H2SO4和Fe
NaOH溶液
容器内只有H2而无空气, Fe(OH)2不易被氧化
打开止水夹,使Ⅰ管开始反应一段时间后再夹紧止水夹
总结:Fe、Fe、Fe之间的转化关系
+2
+3
Fe
Fe
+2
Fe
+3
S I2 Cu2+ Fe3+ H+
Zn Al CO H2
O2 Cl2 Br2 H2O2 HNO 3H2SO4(浓)
Al CO H2 Fe Cu SO2 S2- I- SO32-
O2 Cl2 Br2 HNO3 H2SO4(浓)
Al Zn C CO H2
“铁三角”中重要的离子反应式或化学方程式:
①2Fe2++Cl2=2Fe3++2Cl-
②2Fe2++H2O2+2H+=2Fe3++2H2O
③2Fe3++H2S=2Fe2++S↓+2H+
④ 2Fe3++Cu=2Fe2++Cu2+
⑤2Fe3++SO2+2H2O=2Fe2++4H++SO42-
⑥ 2Fe3++2I-=2Fe2++I2
⑦2Fe3++Fe=3Fe2+
⑧3Fe3O4+8Al=4Al2O3+9Fe
⑨3Fe + 4H2O Fe3O4 + 4H2
⑩Fe2O3 + 3CO 2Fe + 3CO2
二价铁盐与三价铁盐的相互转化
(1)二价铁盐既有氧化性又有还原性,以还原性为主。亚铁盐溶液在保存时,应在溶液中放少量铁粉以防其被氧化,同时滴加少量的相应酸以防其水解。
①硫酸亚铁在空气中变质的化学方程式:12FeSO4+3O2+6H2O=4Fe2(SO4)3+4Fe(OH)3
②硫酸亚铁溶液被次氯酸钠氧化的化学方程式:
6FeSO4+3NaClO+3H2O=2Fe2(SO4)3+2Fe(OH)3↓+3NaCl
二价铁在氧化过程中由于价态升高,需结合更多的阴离子,阴离子的来源主要有两个途径:
一是酸化,二是还原产物。
(2)三价铁盐具有较强的氧化性和水解程度。
①氯化铁腐蚀铜:Cu+2FeCl3=CuCl2+2FeCl2
②氯化铁氧化二氧化硫:
SO2+2FeCl3+H2O=H2SO4+2FeCl2+2HCl
三价铁在还原过程中价态降低,结合阴离子数目减少,多出的阴离子形成酸或其他盐。
③在FeCl3溶液中加入碳酸盐、金属氧化物以及较活泼金属时,常需考虑促进Fe3+水解的反应;且在保存Fe3+的溶液时,需加入相应的酸抑制水解。
思考:在MgCl2溶液中含少量Fe3+,可加入哪种物质后过滤而除去Fe3+?
解题回顾:
对难水解的金属活泼性的强酸盐中含Fe3+时,常可加入相应金属的氧化物、碳酸盐、氢氧化物金属单质等而促进Fe3+离子水解,过滤除去。
三、Fe3+离子的检验
Fe3++SCN-=[Fe(SCN)]2+(血红色)
Fe2+与SCN-反应不显色,故检验Fe3+的
存在可用含SCN-离子的溶液作试剂。
讨论:如何鉴别Fe2+与Fe3+?
1、通过颜色比较
2、通过加碱观察现象
3、加kSCN观察颜色
4、加苯酚观察颜色
直 接 观 色
与KSCN
与苯 酚
显色反应
利用
氧化反应
利 用
与 铜 片
与 淀 粉
KI 试 纸
鉴 别方 法
浅 绿 色
棕 黄 色
血 红 色
不显红色
不显紫色 显 紫 色
无明显现象
Cu被腐蚀 溶液变绿色
试纸不变蓝 试纸变蓝色
白色沉淀迅速变灰绿色最后呈红褐色
立即产生红
褐色沉淀
水解反应
利 用
沉淀反应
利 用
与CO32-、HCO3-
ClO-、HSO3-等反应
白色沉淀迅速变灰
绿色最后呈红褐色
立即产生红
褐色沉淀
Fe2+ 、Fe3+与 碱作用
Fe2+
Fe3+
⑴Fe2+:在酸性条件下不能与氧化性离子大量共存,如硝酸根、高锰酸根、次氯酸根等。也不能与发生复分解反应的离子大量共存。
⑵ Fe3+:不能与还原性离子大量共存。如:I-、S2- 等。也不能与发生复分解反应和双水解反应的离子大量共存。
离子共存问题:
据此推断:
(1)在A、B、C这三种化合物中必定存在x元素的是______.
(2)若x为非金属时,A为_________,B为_______.
(3)若X和Y均为金属时,A为_______, B为__ __.
[练习] x,y,z是三种常见非金属与金属单质,A、B、C是三种常见氧化物(其中只少有一种具有高熔点).相互间存在如下关系:
A C
CO2
MgO
Fe2O3
Al2O3
【例】(2000年全国高考题)久置于空气中的下列物质,因被氧化而呈黄色的是 ( )
A.浓HNO3 B.氯化亚铁溶液 C.溴苯 D.溴化银
B
【解题回顾】
本题考查的是常见的“黄色体系”有以下几种固体:溴化银、碘化银(不溶于水和硝酸,光照分解)、磷酸银(不溶于水但溶于强酸)、硫(不溶于水溶于CS2,可由两种气体生成)、过氧化钠(与水反应产生气体)、三硝基甲苯(炸药,有机物); 外加几种黄色溶液:
浓HNO3(因溶液中有NO2气体)、工业盐酸(含Fe3+离子)、不纯的硝基苯(因溶有NO2)、亚铁盐溶液(因含Fe3+离子)等。
北京05)某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)
(1)装置B中发生反应的化学方程式是 。
(2)装置E中的现象是 。
3Fe+4H2O(g) === Fe3O4+4H2
高温
黑色固体变红,右端管壁有水珠
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法:
。
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
滤液 FeCl3溶液 FeCl3·6H2O晶体 ①步骤I中通入Cl2的作用是 。
②步骤II从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括 。
③该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明)
。
Cl2
I
II
取少量滤液,滴入几滴KSCN溶液,观察溶液是否变红色
将Fe2+氧化成Fe3+
加热浓缩。冷却结晶,过滤
3Fe3++3H2O Fe(OH)3+3H+,过量盐酸抑制FeCl3水解
