离子反应
图片预览






文档简介
(共19张PPT)
第二节 离子反应
(第一课时)
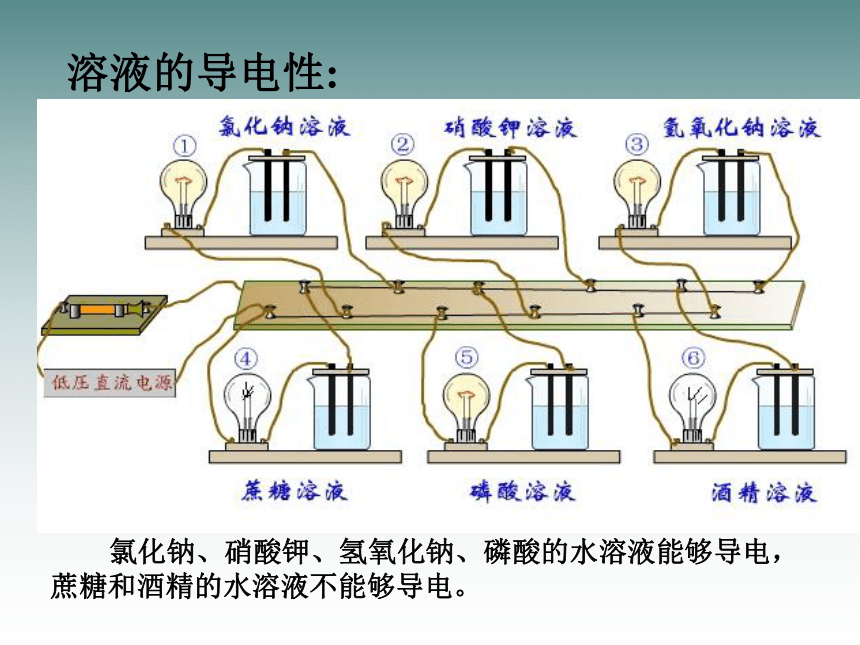
溶液的导电性:
氯化钠、硝酸钾、氢氧化钠、磷酸的水溶液能够导电,蔗糖和酒精的水溶液不能够导电。
电解质:在水溶液里或熔融状态下
能够导电的化合物。
酸、碱、盐在水溶液中的电离
1、电解质和非电解质
非电解质:在水溶液里或熔融状态
下都不能够导电的化合物。
(酸,碱,大多数盐,活泼金属氧化物:
如:Na2O、CaO、MgO ,水)
(蔗糖,酒精等绝大多数有机物
非金属氧化物:SO2、SO3、CO2、CO、P2O5
非酸性气态氢化物:NH3)
结论: 应注意以下几点: (1) 电解质、非电解质都是化合物。单质与混合物即不是电解质也不是非电解质 。
(2) 电解质导电须有外界条件:水溶液或熔融状态。
(3) 电解质应是在一定条件下本身电离而导电的化合物。某些化合物,像SO3、SO2、CO2、NH3,它们的水溶液虽能导电,但不是电解质,而是非电解质。因为它们溶于水,跟水反应生成了电解质,这些电解质能电离而导电,并非这些化合物本身电离所为。
(4)某些难溶于水的化合物。如BaSO4、AgCl等,由 于它们溶解度太小,测不出(或难测)其水溶液的导电性,但它们溶解的部分是完全电离的,或在熔化状态下能完全电离,所以是难溶性电解质。
判断正误:
1、铜能导电,是电解质;Cl2不能导电,故Cl2是非电解质。
2、液态HCl不导电,则液态HCl为非电解质;盐酸能导电,所以盐酸是电解质。
3、硝酸钾晶体不导电,硝酸钾溶液能导电,所以硝酸钾溶液是电解质,硝酸钾晶体是非电解质。
X
X
X
4、把SO3溶于水所得的溶液能导电,所以SO3是电解质。
5、BaSO4难溶于水,所以BaSO4是非电解质。
6、电解质都能够导电,能导电的物质都是电解质。
7、非电解质都不能导电,不能导电的物质不一定是非电解质。
【思考】下列物质中,哪些能导电?哪些
是电解质?哪些是非电解质?
①铜 ②氯化钠固体 ③氢氧化钠溶液
④硫酸 ⑤熔融的碳酸钾 ⑥硫酸钡
⑦蔗糖 ⑧二氧化碳。
能导电:
电解质:
非电解质:
① ③ ⑤
② ④ ⑤ ⑥
⑦ ⑧
NaCl加放到水中
水分子与NaCl晶体作用
NaCl溶解并电离
电解质为什么在水溶液中或熔融状态能导电?以NaCl溶液导电来说明
食盐的电离
Na+
Cl-
定义:电解质在水溶液里或熔融状态下离解成自由移动的离子的过程。
条件:溶于水或熔融状态
结果:产生自由移动的离子
2.电离
思考:醋酸、盐酸都是电解质溶液。在相同条件下,两种物质的导电能力相同吗?
实验:体积相同条件下,0.1mol/L 盐酸和醋酸溶液的导电性情况比较。
3.强电解质和弱电解质
▲强电解质:在水溶液中全部电离成离子的电解质。
如:强酸 HCl 、H2SO4 、HNO3等;
强碱 KOH、NaOH 、 Ca(OH)2 、Ba(OH)2等;
大多数盐类、活泼金属氧化物。
▲弱电解质:在水溶液中部分电离成离子的电解质。
如:弱酸 H2CO3,CH3COOH等;
弱碱 NH3 H2O(可溶性),Cu(OH)2(不溶性)等;
注意:H2O是弱电解质
练一练
下列电解质中哪些属于强电解质,哪些属于弱电解质?
①氢氧化钡 ②水 ③碳酸 ④硝酸
⑤碳酸钙 ⑥硫酸钡 ⑦氯化钠
⑧醋酸 ⑨氢氧化钾 ⑩氢氧化亚铁
强电解质 ① ④ ⑤ ⑥ ⑦ ⑨
弱电解质 ② ③ ⑧ ⑩
强弱电解质的比较:
强电解质 弱电解质
电离程度
同条件下导电性
物质类别
示例
完全
部分
强酸、强碱、多
数盐活泼金属氧
化物
弱酸、弱碱、
水
KCl、NaOH
HCl、MgO
水,碳酸
弱
强
物质
混合物
纯净物
化合物
单质
电解质
非电解质
强电解质
弱电解质
强酸
强碱
多数盐类
活泼金属氧化物
弱酸
弱碱
水
归纳小结:
大部分有机物和非金属氧化物
不是电解质
也不是非电解质
下列物质中:
1、硫酸 2、蔗糖 3、氨气 4、醋酸
5、铜 6、氨水 7、乙醇 8、二氧化碳
9、碳酸 10、氯化铵 11、烧碱 12、氯化钠溶液
属于非电解质的是
属于电解质的是
属于强电解质的是
属于弱电解质的是
能导电但不属于电解质的是
2 3 7 8
1 4 9 10 11
1 10 11
4 9
5 6 12
第二节 离子反应
(第一课时)
溶液的导电性:
氯化钠、硝酸钾、氢氧化钠、磷酸的水溶液能够导电,蔗糖和酒精的水溶液不能够导电。
电解质:在水溶液里或熔融状态下
能够导电的化合物。
酸、碱、盐在水溶液中的电离
1、电解质和非电解质
非电解质:在水溶液里或熔融状态
下都不能够导电的化合物。
(酸,碱,大多数盐,活泼金属氧化物:
如:Na2O、CaO、MgO ,水)
(蔗糖,酒精等绝大多数有机物
非金属氧化物:SO2、SO3、CO2、CO、P2O5
非酸性气态氢化物:NH3)
结论: 应注意以下几点: (1) 电解质、非电解质都是化合物。单质与混合物即不是电解质也不是非电解质 。
(2) 电解质导电须有外界条件:水溶液或熔融状态。
(3) 电解质应是在一定条件下本身电离而导电的化合物。某些化合物,像SO3、SO2、CO2、NH3,它们的水溶液虽能导电,但不是电解质,而是非电解质。因为它们溶于水,跟水反应生成了电解质,这些电解质能电离而导电,并非这些化合物本身电离所为。
(4)某些难溶于水的化合物。如BaSO4、AgCl等,由 于它们溶解度太小,测不出(或难测)其水溶液的导电性,但它们溶解的部分是完全电离的,或在熔化状态下能完全电离,所以是难溶性电解质。
判断正误:
1、铜能导电,是电解质;Cl2不能导电,故Cl2是非电解质。
2、液态HCl不导电,则液态HCl为非电解质;盐酸能导电,所以盐酸是电解质。
3、硝酸钾晶体不导电,硝酸钾溶液能导电,所以硝酸钾溶液是电解质,硝酸钾晶体是非电解质。
X
X
X
4、把SO3溶于水所得的溶液能导电,所以SO3是电解质。
5、BaSO4难溶于水,所以BaSO4是非电解质。
6、电解质都能够导电,能导电的物质都是电解质。
7、非电解质都不能导电,不能导电的物质不一定是非电解质。
【思考】下列物质中,哪些能导电?哪些
是电解质?哪些是非电解质?
①铜 ②氯化钠固体 ③氢氧化钠溶液
④硫酸 ⑤熔融的碳酸钾 ⑥硫酸钡
⑦蔗糖 ⑧二氧化碳。
能导电:
电解质:
非电解质:
① ③ ⑤
② ④ ⑤ ⑥
⑦ ⑧
NaCl加放到水中
水分子与NaCl晶体作用
NaCl溶解并电离
电解质为什么在水溶液中或熔融状态能导电?以NaCl溶液导电来说明
食盐的电离
Na+
Cl-
定义:电解质在水溶液里或熔融状态下离解成自由移动的离子的过程。
条件:溶于水或熔融状态
结果:产生自由移动的离子
2.电离
思考:醋酸、盐酸都是电解质溶液。在相同条件下,两种物质的导电能力相同吗?
实验:体积相同条件下,0.1mol/L 盐酸和醋酸溶液的导电性情况比较。
3.强电解质和弱电解质
▲强电解质:在水溶液中全部电离成离子的电解质。
如:强酸 HCl 、H2SO4 、HNO3等;
强碱 KOH、NaOH 、 Ca(OH)2 、Ba(OH)2等;
大多数盐类、活泼金属氧化物。
▲弱电解质:在水溶液中部分电离成离子的电解质。
如:弱酸 H2CO3,CH3COOH等;
弱碱 NH3 H2O(可溶性),Cu(OH)2(不溶性)等;
注意:H2O是弱电解质
练一练
下列电解质中哪些属于强电解质,哪些属于弱电解质?
①氢氧化钡 ②水 ③碳酸 ④硝酸
⑤碳酸钙 ⑥硫酸钡 ⑦氯化钠
⑧醋酸 ⑨氢氧化钾 ⑩氢氧化亚铁
强电解质 ① ④ ⑤ ⑥ ⑦ ⑨
弱电解质 ② ③ ⑧ ⑩
强弱电解质的比较:
强电解质 弱电解质
电离程度
同条件下导电性
物质类别
示例
完全
部分
强酸、强碱、多
数盐活泼金属氧
化物
弱酸、弱碱、
水
KCl、NaOH
HCl、MgO
水,碳酸
弱
强
物质
混合物
纯净物
化合物
单质
电解质
非电解质
强电解质
弱电解质
强酸
强碱
多数盐类
活泼金属氧化物
弱酸
弱碱
水
归纳小结:
大部分有机物和非金属氧化物
不是电解质
也不是非电解质
下列物质中:
1、硫酸 2、蔗糖 3、氨气 4、醋酸
5、铜 6、氨水 7、乙醇 8、二氧化碳
9、碳酸 10、氯化铵 11、烧碱 12、氯化钠溶液
属于非电解质的是
属于电解质的是
属于强电解质的是
属于弱电解质的是
能导电但不属于电解质的是
2 3 7 8
1 4 9 10 11
1 10 11
4 9
5 6 12
