6.1金刚石、石墨和C60(第二课时)课件--2021-2022学年九年级化学人教版上册(15张PPT)
文档属性
| 名称 | 6.1金刚石、石墨和C60(第二课时)课件--2021-2022学年九年级化学人教版上册(15张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 14.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-03 07:03:50 | ||
图片预览





文档简介
(共15张PPT)
课题1 金刚石、石墨和C60
第六单元 碳和碳的氧化物
新知讲解
王羲之的<<兰亭序>>
古代有名字画历经几百年甚至几千年而依然色泽鲜艳不褪色,你知道其中的原因吗?
新知讲解
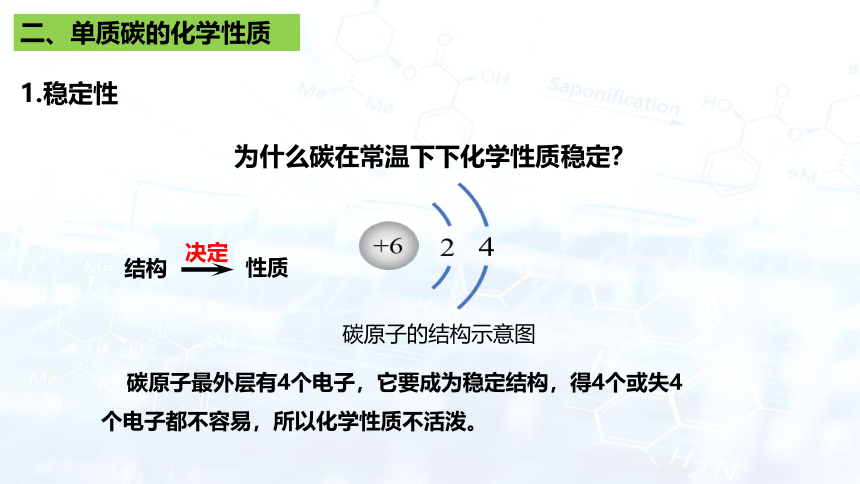
二、单质碳的化学性质
1.稳定性
为什么碳在常温下下化学性质稳定?
性质
结构
决定
碳原子最外层有4个电子,它要成为稳定结构,得4个或失4个电子都不容易,所以化学性质不活泼。
碳原子的结构示意图
新知讲解
实验现象
在空气里:发出红光
在氧气里:剧烈燃烧,发出白光
放出热量,生成无色气体
2.可燃性
回忆木炭在氧气和空气中充分燃烧的现象:
点燃
C+O2 CO2
木炭在氧气中不充分燃烧时,生成一氧化碳
点燃
2C+O2 2CO
(氧气充足,碳充分燃烧)
(氧气不足,碳不充分燃烧)
注意
碳具有可燃性,条件不同,燃烧产物可能也不相同。
结论:
1.当m(C):m(O2)≤3:8时,只生成CO2
2.当m(C):m(O2)≥3:4时,只生成CO
3.当3:8<m(C):m(O2)<3:4时,生成CO2和CO2
C+O2 点燃 CO2
2C+O2 点燃 2CO
12 32
3 8
24 32
3 4
思考:氧气的量具体是多少时,才算充分呢?
新知讲解
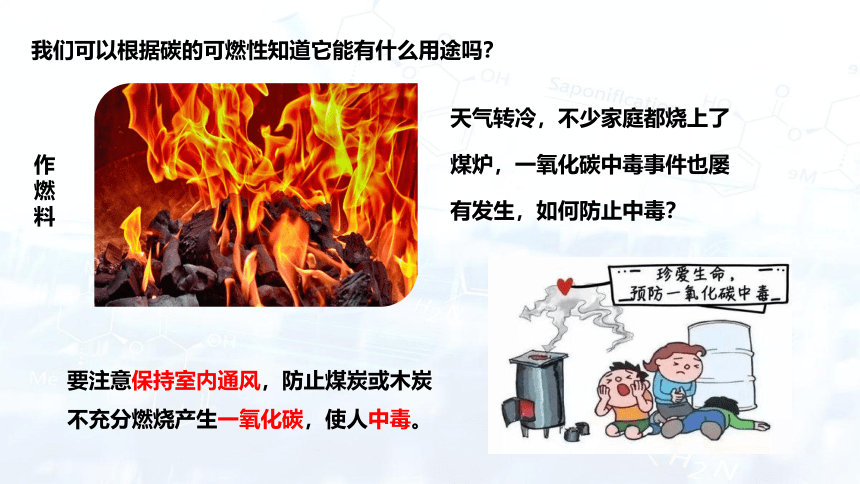
我们可以根据碳的可燃性知道它能有什么用途吗?
作燃料
天气转冷,不少家庭都烧上了煤炉,一氧化碳中毒事件也屡有发生,如何防止中毒?
要注意保持室内通风,防止煤炭或木炭不充分燃烧产生一氧化碳,使人中毒。
新知讲解
3.碳跟某些氧化物的反应(还原性)
把刚烘干的木炭粉末(过量)和氧化铜粉末混合均匀,小心地铺放进试管,将试管固定在铁架台上,导管伸入澄清石灰水中,用酒精灯(可以加网罩以使火焰集中并提高温度,最好使用酒精喷灯)加热混合物几分钟。先撤出导气管,再熄灭酒精灯。待试管冷却后再把试管里粉末倒在纸上。
①气密性检验
②装药
③如图连接固定装置
④点燃酒精灯加热(观察现象)
⑤实验结束:将导管移出小试管,同时停止加热。
操作步骤:
新知讲解
实验现象:
黑色粉末逐渐变成红色;
澄清石灰水变浑浊。
原理(化学方程式):
高温
2CuO+C 2Cu+CO2↑
注意:
1.铁丝网罩的作用:
2.碳研磨成粉末状且过量的目的:
3.能否将石灰水变浑浊作为实验开始的标志?
不能,因为二氧化碳有可能来自于碳与氧气产生的。
4.实验结束的标志是什么?
导管口不再产生气泡。
集中火焰,提高温度。
增大接触面积并保证将氧化铜反应完。
点燃
C+O2 CO2
防止澄清石灰水倒流使试管炸裂。
防止生成的铜被氧气再次氧化。
因为刚开始排出的是试管内的空气。
5.为什么要先撤出导管?
6.为什么要待试管冷却后再把粉末倒出纸上?
7.为什么开始加热时,导管口处有无色气泡逸出,但澄清石灰水不变浑浊?
2Cu+O2 2 CuO
某兴趣小组按照课本实验方法,进行木炭与氧化铜反应实验时,发现很难观察到紫红色铜的生成,却往往有暗红色固体出现。于是小组同学决定对这个实验进行探究和改进。
【提出问题】暗红色的固体是什么?如何选择合适的条件,使木炭还原氧化铜的实验现象更明显?
【查阅资料】查阅铜、碳和氧元素的化合价:铜分别有+1和+2两种化合价,通常情况下,氧的化合价为-2,碳的化合价为+4或-4。
【猜想与假设】
⑴同学们认为这种暗红色固体可能是一种化合物,并猜测它的化学式为 。
⑵同学们还认为,通过改变反应物的状态、质量比,以及反应装置,可以使该实验现象更加明显,减少出现暗红色固体的情况。
Cu2O 、Cu4C或Cu2C
例题
【分析与交流】
⑴第一小组建议用超细炭粉与氧化铜粉末进行实验。
你认为这样建议的原理 。
⑵第二小组建议用图乙装置替代甲装置。与甲相比较,乙装置中将试管直立放置的作用是 。
⑶两个小组通过分析下列三种氧化铜和碳的质量比例,建议选择 (填选项序号)的比例。
A. 32︰3 B. 40︰3 C. 48︰3
你认为他们这样选择的理由是 。
【实验与结论】
化学兴趣小组决定按改进后的方案进行实验,在检验了乙装置的气密性后,往试管中加入已干燥的药品并开始加热,当看到澄清的石灰水刚出现浑浊时, (填“可以”或“不能”)确定氧化铜和炭粉已经开始反应。
增加接触面积,反应更充分
有利于集中加热,获得持续高温
A
反应中炭粉会与试管内的氧气反应而部分消耗,故稍过量的炭粉有利于反应的进行
不能
1.冶炼金属(炼铁)
2.碳还原二氧化碳
砖红色、 黑色
红棕色
碳的还原性的应用
3C+2Fe2O3 高温 4Fe+3CO2↑
C+CO2 高温 2CO
碳的化学性质
可燃性
2CuO+C 2Cu+CO2 ↑
高温
化学性质不活泼
常温下
还原性
C+O2 点燃 CO2
2C+O2 点燃 2CO
C+CO2 高温 2CO
3C+2Fe2O3 高温 4Fe+3CO2↑
这种含氧化合物里的氧被夺去的反应叫作还原反应。
氧化铜失去 变成 , 得到氧变成二氧化碳。
氧
铜
碳
C+2CuO 高温 2Cu+CO2↑
在上述反应里:碳夺走氧化铜中的氧,显还原性。
三、还原反应(不属于基本反应)
规律
还原性
被氧化
化合价升高
供氧
氧化性
化合价降低(铜元素)
氧化铜
氧化剂
被还原
碳
还原剂
夺氧
课题1 金刚石、石墨和C60
第六单元 碳和碳的氧化物
新知讲解
王羲之的<<兰亭序>>
古代有名字画历经几百年甚至几千年而依然色泽鲜艳不褪色,你知道其中的原因吗?
新知讲解
二、单质碳的化学性质
1.稳定性
为什么碳在常温下下化学性质稳定?
性质
结构
决定
碳原子最外层有4个电子,它要成为稳定结构,得4个或失4个电子都不容易,所以化学性质不活泼。
碳原子的结构示意图
新知讲解
实验现象
在空气里:发出红光
在氧气里:剧烈燃烧,发出白光
放出热量,生成无色气体
2.可燃性
回忆木炭在氧气和空气中充分燃烧的现象:
点燃
C+O2 CO2
木炭在氧气中不充分燃烧时,生成一氧化碳
点燃
2C+O2 2CO
(氧气充足,碳充分燃烧)
(氧气不足,碳不充分燃烧)
注意
碳具有可燃性,条件不同,燃烧产物可能也不相同。
结论:
1.当m(C):m(O2)≤3:8时,只生成CO2
2.当m(C):m(O2)≥3:4时,只生成CO
3.当3:8<m(C):m(O2)<3:4时,生成CO2和CO2
C+O2 点燃 CO2
2C+O2 点燃 2CO
12 32
3 8
24 32
3 4
思考:氧气的量具体是多少时,才算充分呢?
新知讲解
我们可以根据碳的可燃性知道它能有什么用途吗?
作燃料
天气转冷,不少家庭都烧上了煤炉,一氧化碳中毒事件也屡有发生,如何防止中毒?
要注意保持室内通风,防止煤炭或木炭不充分燃烧产生一氧化碳,使人中毒。
新知讲解
3.碳跟某些氧化物的反应(还原性)
把刚烘干的木炭粉末(过量)和氧化铜粉末混合均匀,小心地铺放进试管,将试管固定在铁架台上,导管伸入澄清石灰水中,用酒精灯(可以加网罩以使火焰集中并提高温度,最好使用酒精喷灯)加热混合物几分钟。先撤出导气管,再熄灭酒精灯。待试管冷却后再把试管里粉末倒在纸上。
①气密性检验
②装药
③如图连接固定装置
④点燃酒精灯加热(观察现象)
⑤实验结束:将导管移出小试管,同时停止加热。
操作步骤:
新知讲解
实验现象:
黑色粉末逐渐变成红色;
澄清石灰水变浑浊。
原理(化学方程式):
高温
2CuO+C 2Cu+CO2↑
注意:
1.铁丝网罩的作用:
2.碳研磨成粉末状且过量的目的:
3.能否将石灰水变浑浊作为实验开始的标志?
不能,因为二氧化碳有可能来自于碳与氧气产生的。
4.实验结束的标志是什么?
导管口不再产生气泡。
集中火焰,提高温度。
增大接触面积并保证将氧化铜反应完。
点燃
C+O2 CO2
防止澄清石灰水倒流使试管炸裂。
防止生成的铜被氧气再次氧化。
因为刚开始排出的是试管内的空气。
5.为什么要先撤出导管?
6.为什么要待试管冷却后再把粉末倒出纸上?
7.为什么开始加热时,导管口处有无色气泡逸出,但澄清石灰水不变浑浊?
2Cu+O2 2 CuO
某兴趣小组按照课本实验方法,进行木炭与氧化铜反应实验时,发现很难观察到紫红色铜的生成,却往往有暗红色固体出现。于是小组同学决定对这个实验进行探究和改进。
【提出问题】暗红色的固体是什么?如何选择合适的条件,使木炭还原氧化铜的实验现象更明显?
【查阅资料】查阅铜、碳和氧元素的化合价:铜分别有+1和+2两种化合价,通常情况下,氧的化合价为-2,碳的化合价为+4或-4。
【猜想与假设】
⑴同学们认为这种暗红色固体可能是一种化合物,并猜测它的化学式为 。
⑵同学们还认为,通过改变反应物的状态、质量比,以及反应装置,可以使该实验现象更加明显,减少出现暗红色固体的情况。
Cu2O 、Cu4C或Cu2C
例题
【分析与交流】
⑴第一小组建议用超细炭粉与氧化铜粉末进行实验。
你认为这样建议的原理 。
⑵第二小组建议用图乙装置替代甲装置。与甲相比较,乙装置中将试管直立放置的作用是 。
⑶两个小组通过分析下列三种氧化铜和碳的质量比例,建议选择 (填选项序号)的比例。
A. 32︰3 B. 40︰3 C. 48︰3
你认为他们这样选择的理由是 。
【实验与结论】
化学兴趣小组决定按改进后的方案进行实验,在检验了乙装置的气密性后,往试管中加入已干燥的药品并开始加热,当看到澄清的石灰水刚出现浑浊时, (填“可以”或“不能”)确定氧化铜和炭粉已经开始反应。
增加接触面积,反应更充分
有利于集中加热,获得持续高温
A
反应中炭粉会与试管内的氧气反应而部分消耗,故稍过量的炭粉有利于反应的进行
不能
1.冶炼金属(炼铁)
2.碳还原二氧化碳
砖红色、 黑色
红棕色
碳的还原性的应用
3C+2Fe2O3 高温 4Fe+3CO2↑
C+CO2 高温 2CO
碳的化学性质
可燃性
2CuO+C 2Cu+CO2 ↑
高温
化学性质不活泼
常温下
还原性
C+O2 点燃 CO2
2C+O2 点燃 2CO
C+CO2 高温 2CO
3C+2Fe2O3 高温 4Fe+3CO2↑
这种含氧化合物里的氧被夺去的反应叫作还原反应。
氧化铜失去 变成 , 得到氧变成二氧化碳。
氧
铜
碳
C+2CuO 高温 2Cu+CO2↑
在上述反应里:碳夺走氧化铜中的氧,显还原性。
三、还原反应(不属于基本反应)
规律
还原性
被氧化
化合价升高
供氧
氧化性
化合价降低(铜元素)
氧化铜
氧化剂
被还原
碳
还原剂
夺氧
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
