8.2金属的化学性质习题课-2021-2022学年九年级化学人教版上册(29张PPT)
文档属性
| 名称 | 8.2金属的化学性质习题课-2021-2022学年九年级化学人教版上册(29张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 8.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-03 07:02:13 | ||
图片预览







文档简介
(共29张PPT)
课 题 2 金 属 的 化 学 性 质习 题 课
课题2 金属的化学性质
金属与氧气反应
金属与金属化合物溶液反应
金属与酸反应
应用(一):判断置换反应能否发生
1.金属与酸
条件:金属位于____之前
2.金属与盐溶液
条件:①前换后(强置换弱);②盐溶于水
例:Fe+H2SO4 = FeSO4+H2↑
Cu+H2SO4 ≠
例:判断下列反应能否发生
Fe+CuSO4 = FeSO4+Cu
Cu+FeSO4 ≠(Fe > Cu)
Cu+2AgNO3 = Cu(NO3 )2+2Ag
Cu+AgCl ≠(AgCl难溶于水)
1.判断下列物质间能不能发生置换反应
① Fe + CuSO4 ② Zn + Cu(NO3)2
③ Cu + AgCl(不溶) ④ Cu + Mg(NO3)2
⑤ Zn + MgCl2 ⑥ Cu + Hg(NO3)2
2.有X、Y、Z三种金属,若将Z放入X的盐溶液中,Z表面覆盖有X,将Y和Z分别投入稀盐酸中,Y溶解而Z不溶,则三种金属的活动性顺序是( )
A. X>Y>Z B. Y>Z>X
C. Y>X>Z D. X>Z>Y
3. A、B、C三种金属,根据下列反应式中的关系: ① A+B(NO3)2 = A (NO3)2 + B
② C+ B(NO3)2 = C (NO3)2 + B
③ A+ H2SO4 (稀硫酸)= ASO4 + H2↑
④ C+ H2SO4 (稀硫酸) 不反应 试推断三种金属的活动顺序为 ( ) A.A>B>C B. A>C>B C.B>C>A D.C>A>B
4、下列化合物能由金属与酸发生置换反应直接制取的是( )
A.FeCl3 B.ZnCl2
C.HgCl2 D.CuSO4
5.若金属锰(Mn)在金属活动性顺序中位于铝和锌之间,则下列反应不正确的是( )
A.Mn+H2SO4═MnSO4+H2↑ B.Mg+MnSO4═MgSO4+Mn
C.Fe+MnSO4═FeSO4+Mn D.Mn+ CuSO4═MnSO4+Cu
6.X、R表示两种金属,在溶液中发生反应:
X+3RNO3=3R+X(NO3)3。下列说法不正确的是( )
A.该反应是置换反应 B.若X是Al,R是Ag
C.X可能是Fe,R可能是Cu D.X的金属活动性比R强
7、有M、N、R三种金属,将M和N分别浸入稀硫酸中,N溶解,M不溶解,将M浸入R的硝酸盐溶液中,经过一段时间,在M的表面上有R 析出,由此判断M、N、R三种金属的活动性由强到弱的顺序是( )
A、M>N > R B、M > R > N
C、N >M >R D、R > M > N
8、(1)向含有CuCl2、ZnCl2、HCl的溶液中撒入过量的铁粉,反应后溶液中一定含有( )
A.ZnCl2、HCl B.FeCl2、CuCl2 C.CuCl2、HCl D. ZnCl2、FeCl2
(2)在硝酸铜和硝酸银的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体中滴加稀盐酸,没有气泡产生,则滤渣中一定有 ,可能有 ,一定没有 。
1.金属与混合盐溶液反应
例:向Mg(NO3)2、AgNO3、Fe(NO3)2的混合溶液中加入一定量的Zn粉。
分析:
Mg2+ Zn Fe2+ Ag+
① Zn+2AgNO3= Zn(NO3)2+2Ag
② Zn+Fe(NO3)2= Zn(NO3)2+Fe
远距离先发生,谁弱先置换谁
反应①完全结束以后,反应②才会开始
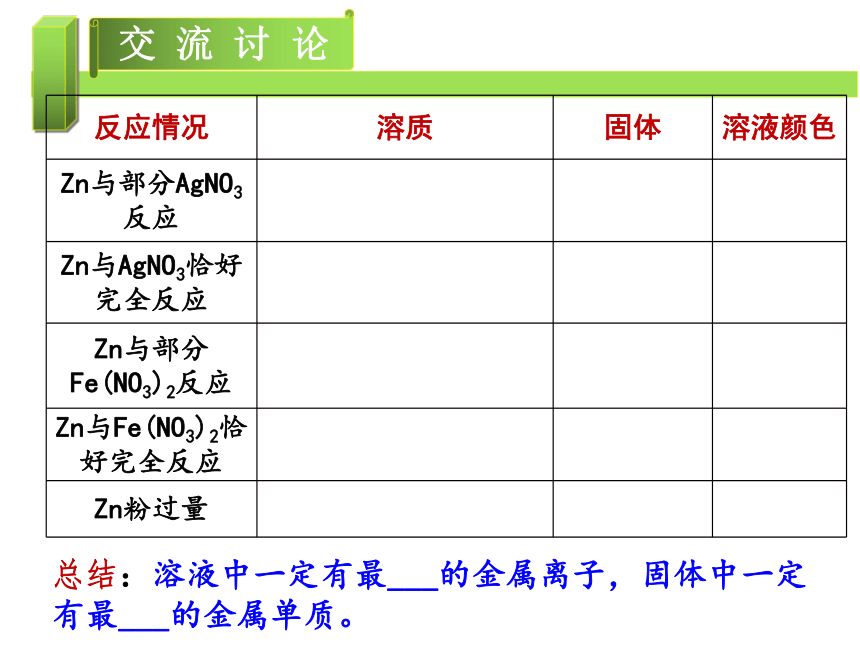
(二) 反应顺序及固体、溶液成分判断
反应情况 溶质 固体 溶液颜色
Zn与部分AgNO3反应
Zn与AgNO3恰好完全反应
Zn与部分Fe(NO3)2反应
Zn与Fe(NO3)2恰好完全反应
Zn粉过量
总结:溶液中一定有最___的金属离子,固体中一定有最___的金属单质。
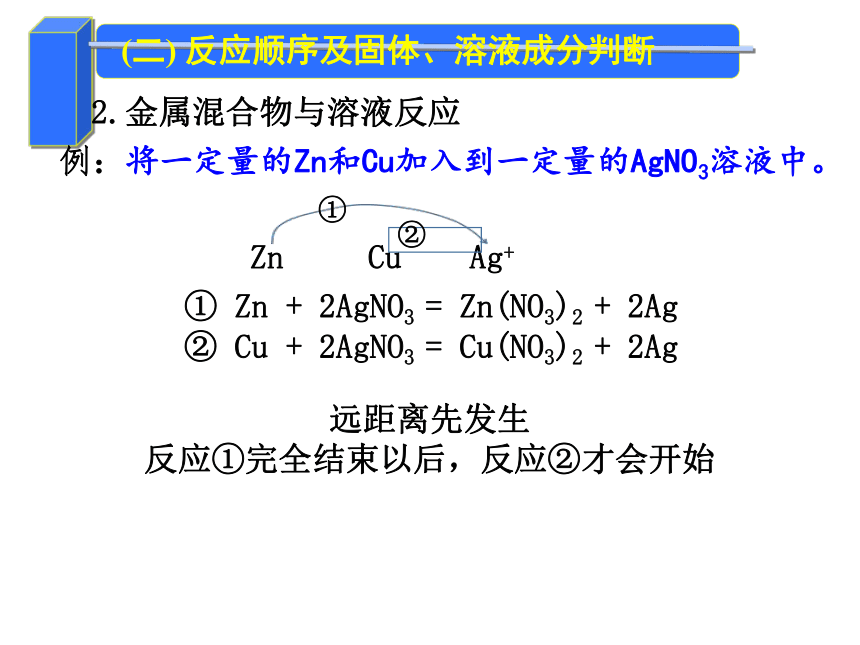
2.金属混合物与溶液反应
例:将一定量的Zn和Cu加入到一定量的AgNO3溶液中。
Zn Cu Ag+
①
②
① Zn + 2AgNO3 = Zn(NO3)2 + 2Ag
② Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
远距离先发生
反应①完全结束以后,反应②才会开始
(二) 反应顺序及固体、溶液成分判断
反应情况 溶质成分 固体成分 溶液颜色
Zn粉过量
Zn粉恰好与AgNO3反应
Zn不足,Cu过量
AgNO3过量
1.向一定量的硝酸银溶液中加入一定量的锌粉和铜粉,充分反应后过滤,得到固体和蓝色滤液,则滤液中一定含有的金属离子有___________,滤渣中的成分是_______________________。
2.在Cu(NO3)2、AgNO3混合溶液中加入一定量的铁粉,充分反应后过滤,向滤渣中滴加稀硫酸时无气泡产生。下列说法正确的是( )
A.滤渣中一定含有Ag和Cu
B.滤渣中一定含有Ag
C.滤液中一定含有Cu(NO3)2
D.滤液中一定没有AgNO3
3.设计实验验证Zn、Cu、Fe三种金属的活动性顺序。
2、用实验证明Zn、Cu、Mg这三种金属的活动性顺序,选用的试剂( )
A.MgCl2溶液 B.ZnSO4溶液 C.CuSO4溶液 D.稀硫酸
1、证明Fe、Cu这两种金属的活动性顺序,你选用的试剂是
,发生反应的化学方程式是 。
(三) 金属活动性顺序的验证方案
1.两种金属 (Zn、Cu)
实验方案 判定依据
金属+盐溶液 ①Zn+CuSO4=Cu+ZnSO4 Zn > Cu
②Cu+ZnSO4≠(易错)
金属 + 酸 ①能否反应 能 > 不能
②反应速率 快 > 慢
※控制变量 1.金属的外形;
2.酸的种类、浓度及用量
B、将两种金属分别与稀盐酸或稀硫酸反应,观 察是否能发生反应,能反应则比较反应的剧 烈程度(速度快慢)
A、将两种金属中的一种金属放进另一种金属化合物的溶液中,看是否发生反应
2.三种金属(Zn、Fe、Cu)
实验方案 判定依据
两金夹一盐 Zn、FeSO4、Cu Zn+FeSO4=Fe+ZnSO4 → Zn > Fe
Cu+FeSO4≠ → Fe > Cu
两盐夹一金 ZnSO4、Fe、CuSO4 Fe+ZnSO4≠ → Zn > Fe
Fe+CuSO4=Cu+FeSO4 → Fe > Cu
必要酸帮忙 ZnSO4、Fe、CuHCl Fe/Cu+ZnSO4≠ → Zn > Fe/Cu
Fe+2HCl=FeCl2+H2↑
Cu+HCl≠
Fe > Cu
证明三种金属的活动性顺序:先排出三种金属的活动顺序
a.将两种金属单质放入中间金属的化合物溶液中 (“两头不变,中间变”)
b.将中间金属的单质放入另两种金属化合物的溶液中 (“两头变,中间不变”)
C、将三种金属分别与稀盐酸或稀硫酸反应
1.验证Zn、Fe、Ag金属的活动性强弱,下列的实际组合实验方案不能达到实验目的是( )
A. FeSO4溶液、Zn、Ag
B. ZnSO4溶液、稀盐酸溶液、Fe、Ag
C. ZnCl2溶液、Ag NO3溶液、Fe
D. ZnSO4溶液、FeSO4溶液、Ag
2.根据已学知识设计实验证明真假黄金,假黄金是铜锌(Cu-Zn)合金,在外观上和真黄金并无多大差别。
方法:
3、同学们一起探究铝、铁、铜三种金属的活动性,小刚同学设计了用铜丝、铁丝、铝丝和稀盐酸,只用一只试管,取一次盐酸的探究方案。请你和他们一起完善下表的探究方案并回答有关问题。(1)填表
① 在试管中取少量盐酸,插入铁丝,充分作用。
② 在①所得的溶液中,插入 ,充分作用。 无明显现象
③ 在②所得的溶液中插入 ,充分作用。
(2)小华同学认为在小刚设计的方案中,只要补充一个实验,就可得出Al>Fe>H>Cu的结论。小华要补充的实验是 ;
Al X Cu
现象 开始时 几乎无气泡产生 产生气泡速度慢 无气泡产生
一段时间后 产生气泡速度快 产生气泡速度慢 无气泡产生
【分析与结论】
(1)实验开始时,铝表面几乎无气泡产生的原因是______________________。
(2)铜表面始终无气泡产生的原因是______________。
(3)三种金属的活动性由强到弱的顺序是___________。
4、某校同学以“比较Al、X、Cu三种金属的活动性”为课 题进行实验探究。
【所用药品】溶质质量分数相同的稀盐酸,大小形状都相
同的Al、X、Cu三种金属。
【实验记录】
5、铬(Cr)为不锈钢主要的添加元素,含量一般在12%以上。铬的表面生成一薄层致密的钝态氧化物保护膜是不锈钢具有耐蚀性主要原因。请回答下列问题:
(1)不锈钢是一种 (填“合金”或“金属”)。
(2)相同温度下,取大小相同、表面光亮的Cr、Mg、Cu三种金属薄片,分别投入等体积等溶质质量分数的足量稀盐酸中(反应中Cr显+2价),现象如下:
金属 Cr Mg Cu
与盐酸反应现象 放出气泡速率缓慢 放出气泡速率较快 无明显现象
①三种金属的活动性由强到弱的顺序是 。
②从上述探究实验可知,Cr 跟CuSO4溶液反应。若反应,请写出反应的化学方程式_________________。
【不同金属与酸反应生成m(H2)比较】
Mg+H2SO4=MgSO4+H2 ↑
Zn+H2SO4 =ZnSO4 +H2 ↑
Fe+H2SO4=FeSO4+H2 ↑
2Al+3H2SO4=Al 2(SO4)3+3H2 ↑
24 2
65 2
54 6
56 2
1g x
计算1g金属和酸反应生成的m(H2):
Al Mg Fe Zn
>
>
>
思 考:m(H2)与金属的化合价和相对原子质量的关系?
P13第8题 金属与酸的反应规律:
总结:
1、等价态、等质量的金属与足量的酸反应生成氢气越多,则金属的相对原子质量越小。
2、等质量的金属分别与足量的酸反应,生成氢气的质量:Al>Mg>Fe>Zn
3、足量的金属分别与等质量等浓度的酸反应,生成氢气的质量:Al=Mg=Fe=Zn
(四)金属与酸的反应规律:
1、(临沂中考)相同质量的M、N两种活泼金属,分别与足量质量分数为8%的盐酸反应(M、N在生成物中均为+2价),生成H2质量和反应时间的关系如右图。下列叙述正确的是 ( )
A.金属的活泼性N>M
B.两个反应生成H2的体积相等
C.相对原子质量N>M
D.两个反应消耗盐酸的质量一定相等
2.等质量的稀硫酸分别与足量的镁、铁、锌三种金属反应,下列图象能正确生成氢气质量与反应时间之间关系的是( )
A
B
C
D
曲线先拐表示时间短反应速率快,金属活动性较强;
3.相同质量的Mg、Fe分别与稀盐酸作用,产生H2的质量m(H2)与加入稀盐酸的体积V(稀盐酸)关系如下图所示,其中正确的是 ( )
A B C D
H2中的氢元素来自于盐酸
足量金属等量酸,产生氢气一样多。
【易错提醒】看清横轴表示的是什么
4、小明同学用6.5 g不纯的锌粉与足量盐酸完全反应,收集到H2的质量0.205 g。已知其中只含有另一种金属杂质。这种金属杂质不可能是下列物质中的
A.铁 B.铝 C.铜 D.镁
▲ 在相同的条件下,金属与氧气反应越容易,金属的活动性越强,反应越剧烈,金属的活动性越强。(金属与氧气反应看难易)
判断金属活动性(活泼程度)的方法一:金属和氧气的反应
判断金属活动性的方法二:金属与盐酸和稀硫酸的反应
一般情况下,能与稀盐酸或稀硫酸反应的金属,其活动性较强,不反应的较弱;反应越剧烈的活动性越强,越缓慢的活动性越弱。(金属与酸反应看快慢)
判断金属活动性的方法三:金属和金属化合物(盐)溶液的反应
如果金属A能把金属B从它化合物(盐)的溶液中置换出来,则证明金属A比金属B的活动性强。(金属与盐溶液反应看有无现象)
金属活动性顺序提供的判断依据:
1、在金属活动性顺序里,金属的位置越靠前,
它的活动性就越强; 反应就越剧烈。
2、在金属活动性顺序里,位于氢前面的金属能
置换出盐酸、稀硫酸中的氢;生成氢气。
3、在金属活动性顺序里,位于前面的金属能把位于后
面的金属从它们化合物的溶液(盐)里置换出来。
常见金属的活动性顺序
K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
钾 钙 钠 镁 铝 锌 铁 锡 铅 氢 铜 汞 银 铂 金
金属活动性由强逐渐减弱
4.置换反应发生规则:前换后,K、Ca、Na除外。
5.金属的活动性相差越大,置换反应越易发生。
6.铁参加的置换反应,生成低价的亚铁化合物。
7.判断活动性顺序方法:快慢有无定顺序
8.置换反应的化学方程式书写技巧:
先找金属排活动性顺序,判断能否反应,
利用前换后规则书写: A+BC=B+AC
9、金属活动性顺序的实验验证方法
(1)两种金属的验证方法
C、将三种金属分别与稀盐酸或稀硫酸反应
B、将两种金属分别与稀盐酸或稀硫酸反应,观 察是否能发生反应,能反应则比较反应的剧 烈程度(速度快慢)
A、将两种金属中的一种金属放进另一种金属化合物的溶液中,看是否发生反应
(2)证明三种金属的活动性顺序:先排出三种金属的活动顺序
a.将两种金属单质放入中间金属的化合物溶液中 (“两头不变,中间变”)
b.将中间金属的单质放入另两种金属化合物的溶液中 (“两头变,中间不变”)
课 题 2 金 属 的 化 学 性 质习 题 课
课题2 金属的化学性质
金属与氧气反应
金属与金属化合物溶液反应
金属与酸反应
应用(一):判断置换反应能否发生
1.金属与酸
条件:金属位于____之前
2.金属与盐溶液
条件:①前换后(强置换弱);②盐溶于水
例:Fe+H2SO4 = FeSO4+H2↑
Cu+H2SO4 ≠
例:判断下列反应能否发生
Fe+CuSO4 = FeSO4+Cu
Cu+FeSO4 ≠(Fe > Cu)
Cu+2AgNO3 = Cu(NO3 )2+2Ag
Cu+AgCl ≠(AgCl难溶于水)
1.判断下列物质间能不能发生置换反应
① Fe + CuSO4 ② Zn + Cu(NO3)2
③ Cu + AgCl(不溶) ④ Cu + Mg(NO3)2
⑤ Zn + MgCl2 ⑥ Cu + Hg(NO3)2
2.有X、Y、Z三种金属,若将Z放入X的盐溶液中,Z表面覆盖有X,将Y和Z分别投入稀盐酸中,Y溶解而Z不溶,则三种金属的活动性顺序是( )
A. X>Y>Z B. Y>Z>X
C. Y>X>Z D. X>Z>Y
3. A、B、C三种金属,根据下列反应式中的关系: ① A+B(NO3)2 = A (NO3)2 + B
② C+ B(NO3)2 = C (NO3)2 + B
③ A+ H2SO4 (稀硫酸)= ASO4 + H2↑
④ C+ H2SO4 (稀硫酸) 不反应 试推断三种金属的活动顺序为 ( ) A.A>B>C B. A>C>B C.B>C>A D.C>A>B
4、下列化合物能由金属与酸发生置换反应直接制取的是( )
A.FeCl3 B.ZnCl2
C.HgCl2 D.CuSO4
5.若金属锰(Mn)在金属活动性顺序中位于铝和锌之间,则下列反应不正确的是( )
A.Mn+H2SO4═MnSO4+H2↑ B.Mg+MnSO4═MgSO4+Mn
C.Fe+MnSO4═FeSO4+Mn D.Mn+ CuSO4═MnSO4+Cu
6.X、R表示两种金属,在溶液中发生反应:
X+3RNO3=3R+X(NO3)3。下列说法不正确的是( )
A.该反应是置换反应 B.若X是Al,R是Ag
C.X可能是Fe,R可能是Cu D.X的金属活动性比R强
7、有M、N、R三种金属,将M和N分别浸入稀硫酸中,N溶解,M不溶解,将M浸入R的硝酸盐溶液中,经过一段时间,在M的表面上有R 析出,由此判断M、N、R三种金属的活动性由强到弱的顺序是( )
A、M>N > R B、M > R > N
C、N >M >R D、R > M > N
8、(1)向含有CuCl2、ZnCl2、HCl的溶液中撒入过量的铁粉,反应后溶液中一定含有( )
A.ZnCl2、HCl B.FeCl2、CuCl2 C.CuCl2、HCl D. ZnCl2、FeCl2
(2)在硝酸铜和硝酸银的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体中滴加稀盐酸,没有气泡产生,则滤渣中一定有 ,可能有 ,一定没有 。
1.金属与混合盐溶液反应
例:向Mg(NO3)2、AgNO3、Fe(NO3)2的混合溶液中加入一定量的Zn粉。
分析:
Mg2+ Zn Fe2+ Ag+
① Zn+2AgNO3= Zn(NO3)2+2Ag
② Zn+Fe(NO3)2= Zn(NO3)2+Fe
远距离先发生,谁弱先置换谁
反应①完全结束以后,反应②才会开始
(二) 反应顺序及固体、溶液成分判断
反应情况 溶质 固体 溶液颜色
Zn与部分AgNO3反应
Zn与AgNO3恰好完全反应
Zn与部分Fe(NO3)2反应
Zn与Fe(NO3)2恰好完全反应
Zn粉过量
总结:溶液中一定有最___的金属离子,固体中一定有最___的金属单质。
2.金属混合物与溶液反应
例:将一定量的Zn和Cu加入到一定量的AgNO3溶液中。
Zn Cu Ag+
①
②
① Zn + 2AgNO3 = Zn(NO3)2 + 2Ag
② Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
远距离先发生
反应①完全结束以后,反应②才会开始
(二) 反应顺序及固体、溶液成分判断
反应情况 溶质成分 固体成分 溶液颜色
Zn粉过量
Zn粉恰好与AgNO3反应
Zn不足,Cu过量
AgNO3过量
1.向一定量的硝酸银溶液中加入一定量的锌粉和铜粉,充分反应后过滤,得到固体和蓝色滤液,则滤液中一定含有的金属离子有___________,滤渣中的成分是_______________________。
2.在Cu(NO3)2、AgNO3混合溶液中加入一定量的铁粉,充分反应后过滤,向滤渣中滴加稀硫酸时无气泡产生。下列说法正确的是( )
A.滤渣中一定含有Ag和Cu
B.滤渣中一定含有Ag
C.滤液中一定含有Cu(NO3)2
D.滤液中一定没有AgNO3
3.设计实验验证Zn、Cu、Fe三种金属的活动性顺序。
2、用实验证明Zn、Cu、Mg这三种金属的活动性顺序,选用的试剂( )
A.MgCl2溶液 B.ZnSO4溶液 C.CuSO4溶液 D.稀硫酸
1、证明Fe、Cu这两种金属的活动性顺序,你选用的试剂是
,发生反应的化学方程式是 。
(三) 金属活动性顺序的验证方案
1.两种金属 (Zn、Cu)
实验方案 判定依据
金属+盐溶液 ①Zn+CuSO4=Cu+ZnSO4 Zn > Cu
②Cu+ZnSO4≠(易错)
金属 + 酸 ①能否反应 能 > 不能
②反应速率 快 > 慢
※控制变量 1.金属的外形;
2.酸的种类、浓度及用量
B、将两种金属分别与稀盐酸或稀硫酸反应,观 察是否能发生反应,能反应则比较反应的剧 烈程度(速度快慢)
A、将两种金属中的一种金属放进另一种金属化合物的溶液中,看是否发生反应
2.三种金属(Zn、Fe、Cu)
实验方案 判定依据
两金夹一盐 Zn、FeSO4、Cu Zn+FeSO4=Fe+ZnSO4 → Zn > Fe
Cu+FeSO4≠ → Fe > Cu
两盐夹一金 ZnSO4、Fe、CuSO4 Fe+ZnSO4≠ → Zn > Fe
Fe+CuSO4=Cu+FeSO4 → Fe > Cu
必要酸帮忙 ZnSO4、Fe、CuHCl Fe/Cu+ZnSO4≠ → Zn > Fe/Cu
Fe+2HCl=FeCl2+H2↑
Cu+HCl≠
Fe > Cu
证明三种金属的活动性顺序:先排出三种金属的活动顺序
a.将两种金属单质放入中间金属的化合物溶液中 (“两头不变,中间变”)
b.将中间金属的单质放入另两种金属化合物的溶液中 (“两头变,中间不变”)
C、将三种金属分别与稀盐酸或稀硫酸反应
1.验证Zn、Fe、Ag金属的活动性强弱,下列的实际组合实验方案不能达到实验目的是( )
A. FeSO4溶液、Zn、Ag
B. ZnSO4溶液、稀盐酸溶液、Fe、Ag
C. ZnCl2溶液、Ag NO3溶液、Fe
D. ZnSO4溶液、FeSO4溶液、Ag
2.根据已学知识设计实验证明真假黄金,假黄金是铜锌(Cu-Zn)合金,在外观上和真黄金并无多大差别。
方法:
3、同学们一起探究铝、铁、铜三种金属的活动性,小刚同学设计了用铜丝、铁丝、铝丝和稀盐酸,只用一只试管,取一次盐酸的探究方案。请你和他们一起完善下表的探究方案并回答有关问题。(1)填表
① 在试管中取少量盐酸,插入铁丝,充分作用。
② 在①所得的溶液中,插入 ,充分作用。 无明显现象
③ 在②所得的溶液中插入 ,充分作用。
(2)小华同学认为在小刚设计的方案中,只要补充一个实验,就可得出Al>Fe>H>Cu的结论。小华要补充的实验是 ;
Al X Cu
现象 开始时 几乎无气泡产生 产生气泡速度慢 无气泡产生
一段时间后 产生气泡速度快 产生气泡速度慢 无气泡产生
【分析与结论】
(1)实验开始时,铝表面几乎无气泡产生的原因是______________________。
(2)铜表面始终无气泡产生的原因是______________。
(3)三种金属的活动性由强到弱的顺序是___________。
4、某校同学以“比较Al、X、Cu三种金属的活动性”为课 题进行实验探究。
【所用药品】溶质质量分数相同的稀盐酸,大小形状都相
同的Al、X、Cu三种金属。
【实验记录】
5、铬(Cr)为不锈钢主要的添加元素,含量一般在12%以上。铬的表面生成一薄层致密的钝态氧化物保护膜是不锈钢具有耐蚀性主要原因。请回答下列问题:
(1)不锈钢是一种 (填“合金”或“金属”)。
(2)相同温度下,取大小相同、表面光亮的Cr、Mg、Cu三种金属薄片,分别投入等体积等溶质质量分数的足量稀盐酸中(反应中Cr显+2价),现象如下:
金属 Cr Mg Cu
与盐酸反应现象 放出气泡速率缓慢 放出气泡速率较快 无明显现象
①三种金属的活动性由强到弱的顺序是 。
②从上述探究实验可知,Cr 跟CuSO4溶液反应。若反应,请写出反应的化学方程式_________________。
【不同金属与酸反应生成m(H2)比较】
Mg+H2SO4=MgSO4+H2 ↑
Zn+H2SO4 =ZnSO4 +H2 ↑
Fe+H2SO4=FeSO4+H2 ↑
2Al+3H2SO4=Al 2(SO4)3+3H2 ↑
24 2
65 2
54 6
56 2
1g x
计算1g金属和酸反应生成的m(H2):
Al Mg Fe Zn
>
>
>
思 考:m(H2)与金属的化合价和相对原子质量的关系?
P13第8题 金属与酸的反应规律:
总结:
1、等价态、等质量的金属与足量的酸反应生成氢气越多,则金属的相对原子质量越小。
2、等质量的金属分别与足量的酸反应,生成氢气的质量:Al>Mg>Fe>Zn
3、足量的金属分别与等质量等浓度的酸反应,生成氢气的质量:Al=Mg=Fe=Zn
(四)金属与酸的反应规律:
1、(临沂中考)相同质量的M、N两种活泼金属,分别与足量质量分数为8%的盐酸反应(M、N在生成物中均为+2价),生成H2质量和反应时间的关系如右图。下列叙述正确的是 ( )
A.金属的活泼性N>M
B.两个反应生成H2的体积相等
C.相对原子质量N>M
D.两个反应消耗盐酸的质量一定相等
2.等质量的稀硫酸分别与足量的镁、铁、锌三种金属反应,下列图象能正确生成氢气质量与反应时间之间关系的是( )
A
B
C
D
曲线先拐表示时间短反应速率快,金属活动性较强;
3.相同质量的Mg、Fe分别与稀盐酸作用,产生H2的质量m(H2)与加入稀盐酸的体积V(稀盐酸)关系如下图所示,其中正确的是 ( )
A B C D
H2中的氢元素来自于盐酸
足量金属等量酸,产生氢气一样多。
【易错提醒】看清横轴表示的是什么
4、小明同学用6.5 g不纯的锌粉与足量盐酸完全反应,收集到H2的质量0.205 g。已知其中只含有另一种金属杂质。这种金属杂质不可能是下列物质中的
A.铁 B.铝 C.铜 D.镁
▲ 在相同的条件下,金属与氧气反应越容易,金属的活动性越强,反应越剧烈,金属的活动性越强。(金属与氧气反应看难易)
判断金属活动性(活泼程度)的方法一:金属和氧气的反应
判断金属活动性的方法二:金属与盐酸和稀硫酸的反应
一般情况下,能与稀盐酸或稀硫酸反应的金属,其活动性较强,不反应的较弱;反应越剧烈的活动性越强,越缓慢的活动性越弱。(金属与酸反应看快慢)
判断金属活动性的方法三:金属和金属化合物(盐)溶液的反应
如果金属A能把金属B从它化合物(盐)的溶液中置换出来,则证明金属A比金属B的活动性强。(金属与盐溶液反应看有无现象)
金属活动性顺序提供的判断依据:
1、在金属活动性顺序里,金属的位置越靠前,
它的活动性就越强; 反应就越剧烈。
2、在金属活动性顺序里,位于氢前面的金属能
置换出盐酸、稀硫酸中的氢;生成氢气。
3、在金属活动性顺序里,位于前面的金属能把位于后
面的金属从它们化合物的溶液(盐)里置换出来。
常见金属的活动性顺序
K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
钾 钙 钠 镁 铝 锌 铁 锡 铅 氢 铜 汞 银 铂 金
金属活动性由强逐渐减弱
4.置换反应发生规则:前换后,K、Ca、Na除外。
5.金属的活动性相差越大,置换反应越易发生。
6.铁参加的置换反应,生成低价的亚铁化合物。
7.判断活动性顺序方法:快慢有无定顺序
8.置换反应的化学方程式书写技巧:
先找金属排活动性顺序,判断能否反应,
利用前换后规则书写: A+BC=B+AC
9、金属活动性顺序的实验验证方法
(1)两种金属的验证方法
C、将三种金属分别与稀盐酸或稀硫酸反应
B、将两种金属分别与稀盐酸或稀硫酸反应,观 察是否能发生反应,能反应则比较反应的剧 烈程度(速度快慢)
A、将两种金属中的一种金属放进另一种金属化合物的溶液中,看是否发生反应
(2)证明三种金属的活动性顺序:先排出三种金属的活动顺序
a.将两种金属单质放入中间金属的化合物溶液中 (“两头不变,中间变”)
b.将中间金属的单质放入另两种金属化合物的溶液中 (“两头变,中间不变”)
同课章节目录
