9.2 溶解度 课件——2021-2022学年人教版九年级下册(46张PPT)
文档属性
| 名称 | 9.2 溶解度 课件——2021-2022学年人教版九年级下册(46张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 4.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-03 15:48:58 | ||
图片预览











文档简介
(共46张PPT)
溶解度
从前有个国王,他的皇宫里有许多的盐,但是,他非常吝啬,从来不分给老百姓吃。老百姓们没有盐吃,有的百姓前去偷运,结果,绝大多数都被砍了头。可是,有一个从皇宫向外面拉水的人,天天都能偷运到盐,分给老百姓。拉水的人把盐放到哪去了呢?他是否能一次运出很多盐?
知识引入
概念:在一定温度下,在一定量溶剂里,不能(还能)再溶解某种溶质的溶液,叫做该条件下这种溶质的饱和(不饱和)溶液
饱和溶液 不饱和溶液
讲溶液饱和或不饱和,一定要指明温度,溶剂质量和溶质
饱和溶液 不饱和溶液
判断方法:
(1)当溶液中有固态溶质时,若固体__________________,
那么该溶液是饱和的,若固体________,那么该溶液是不饱和的;
(2)当溶液中没有固态溶质时,向溶液中加入少量相应的溶质,若溶质__________,则原溶液是饱和的,若溶质__________,则原溶液是不饱和的。
(3)当溶液中有晶体析出时,析出晶体后的溶液一定是饱和溶液。
不再减少
减少
不再溶解
继续溶解
实验饱和溶液与不饱和溶液相互转化的方法
硝酸钾全部溶解
硝酸钾仍有部分未溶解
(1)硝酸钾不再溶解
(2)加热后全部溶解
(3)冷却后又析出固体
实验饱和溶液与不饱和溶液相互转化的方法
不饱和溶液
饱和溶液
降温、蒸发溶剂、加溶质
升温、加溶剂
一般规律:
特殊溶质: Ca(OH)2
不饱和溶液
饱和溶液
升温、蒸发溶剂、加溶质
降温、加溶剂
练习
关于饱和溶液的说法中不正确的是( )
A.饱和溶液就是不再溶解任何溶质的溶液
B.饱和溶液是有条件的,即一定温度,一定量溶剂
C.饱和溶液和不饱和溶液可以相互转化
D.改变温度或者蒸发溶剂一定能使不饱和溶液变成饱和溶液。
A
下列有关饱和溶液的说法是否正确?
①食盐的饱和溶液就是不能再溶解食盐的溶液
②在20 C,不能再溶解食盐的溶液是食盐的饱和溶液
③在100g水中,不能再溶解食盐的溶液是食盐的饱和溶液
④在20 C,在100g水中,不能再溶解食盐的溶液是食盐的饱和溶液
练习
海水晒盐图
知识引入
在海水晒盐的过程中,食盐什么时候开始析出?
1、海水开始蒸发便立即析出食盐
2、海水蒸发到一定程度时,析出食盐
3、海水蒸干的同时析出食盐
……
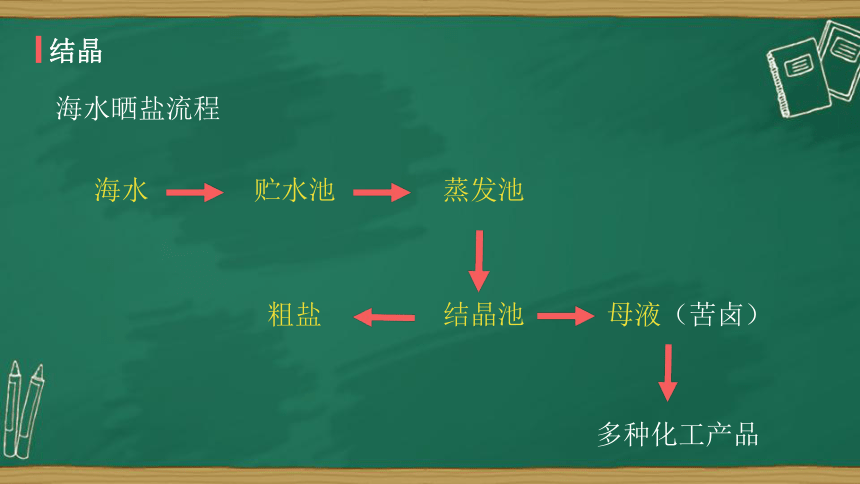
知识引入
结晶
海水晒盐流程
海水
贮水池
蒸发池
粗盐
结晶池
母液(苦卤)
多种化工产品
结晶(分离混合物的方法)
固体物质从它的饱和溶液中以晶体的形式析出的过程叫结晶。
蒸发结晶
海水“晒盐” 是海水经日晒、风吹等,使溶剂不断减少,溶质的质量分数逐渐增大,直至形成饱和溶液,继而析出晶体,这便是蒸发结晶。
冷却热饱和溶液(降温结晶)
热溶液
冷却后
晶体
结晶后所得到的溶液是饱和溶液
物质不能无限制地溶解在一定量的溶剂中,它会受到温度、物质本身在溶剂中的溶解能力等条件的影响。
结晶
从饱和溶液中析出具有规则几何外形的固体叫做晶体
练习
下列关于海水晒盐原理的分析 ,你认为正确的是 ( )
A.利用阳光照射使海水升温得到食盐
B.利用海风降温析出食盐
C.利用阳光和风力使水分蒸发得到食盐
D.利用阳光分解海水得到食盐
C
固体的溶解度
定义:在一定温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
溶解度四要素
条件
标准
状态
单位
一定温度
100克溶剂 (水)
饱和溶液
溶质的质量(克)
固体的溶解度
如:在20℃时,100g水中溶解36g氯化钠达到饱和,我们就说20℃时,氯化钠的溶解度是36g。
又如:60℃时,硝酸钾的溶解度是110克,说明在60℃时,100g水里最多能溶解110g硝酸钾。
固体的溶解度
蔗糖在20℃时的溶解度是203.9g的意义是什么?
在20℃时,100g水中溶解203.9g蔗糖,溶液达到饱和。
在20℃时,100g水中最多可溶解203.9g蔗糖。
20℃时硝酸钾的溶解度是31.6g,这句话的含义是什么?将其关系代入下表:
20℃
31.6g
100g
131.6g
判断下列说法是否正确
(1)在20 C时,100克水中溶解了23克食盐,则食盐在20 C时的溶解度为23克
(2)在20 C时,100克溶液中含有溶质23克,则该物质的溶解度为23克
(3)在100克水中最多能溶解NaCl 36.5克,则氯化钠的溶解度为36.5克
练习
“20℃时,硝酸钾的溶解度是31.6g。”如何理解这句话的涵义
练习
表格法
硝酸钾在不同温度时的溶解度:
13.3
20.9
31.6
45.8
63.9
85.5
110
138
169
202
264
从表中我们可以知道KNO3的溶解度随温度升高而增大
从表中我们可以知道某温度下KNO3的溶解度,例如:20℃时,KNO3的溶解度是20g
溶解度曲线
同种物质在不同温度下的溶解度不同
曲线的交点表示这两种物质在该温度下的溶解度相同
曲线越陡,该物质的溶解度受温度影响越大
溶解度曲线
讨论:固体物质溶解度受温度变化影响情况?
大多数固体物质溶解度随温度升高而增大(甲), 例如:硝酸钠、氯化铵等
少数固体物质溶解度受温度影响不大(乙), 例如:食盐
极少数固体物质溶解度随温度升高反而减小(丙),例如:熟石灰。
溶解度曲线
讨论:结晶方法的选择
蒸发结晶:适用于溶解度受温度影响较小的物质(如:Y/NaCl)
降温结晶(冷却热饱和溶液)适用于溶解度受温度影响较da的物质(如:X/KNO3)
溶解度和溶解性的关系
溶解度和溶解性的关系
0.01g
1g
10g
难(不)溶
微溶
可溶
易溶
A.
B.
C.
D.
练习
A
练习
仔细观察右图,其中X为纯碱的溶解度曲线;Y为食盐的溶解度曲线。请分析盐湖地区为什么可以“冬天捞碱,夏天晒盐”
纯碱的溶解度受温度影响比较大,
食盐溶解度受温度影响较小。冬
天气温较低,纯碱降温结晶析出,而食盐因溶解度较大仍在湖水当中;夏天气温较高,水分大量蒸发,食盐蒸发结晶析出,纯碱因溶解度较大仍在湖水当中。
练习
练习
右图为X、Y两种物质的溶解度曲线,请根据图中内容回答问题:
(1)曲线X、Y的交叉点b表示的含义是( )
(2)从Y的溶液中 获得Y常用
( )法
(3)常温下,M、N两种物质都属于( )
[填易溶、可溶、微溶、难溶]
20℃时X、Y的溶解度相等
易溶
蒸发结晶
如图是甲、乙、丙三种物质的溶解度曲线。下列说法正确的是
( )
A.在t1℃时,三种物质的溶解度由大到
小的顺序是甲>乙>丙
B.在t2℃时,甲、乙两物质的溶解度相等
C.甲、乙、丙三种物质的饱和溶液升温都
会转化为不饱和溶液
D.当甲的饱和溶液中混有少量乙时,可采用降温结晶的方法析出甲
练习
BD
气体的溶解度与什么有关系呢?回答以下问题找出答案。
知识引入
打开汽水盖时,汽水会自动喷出来。这说明气体在水中的溶解度与什么有关?
喝了汽水以后,常常会打嗝。这说明气体的溶解度还与什么有关?
影响气体溶解度的因素
压强:
温度:
气体溶解度一般随压强增大而增大,压强减小而减小。
气体溶解度一般随温度升高而减小,温度降低而增大。
练习
温度升高,气体的溶解度变小
气压减小,气体的溶解度变小
温度升高,气体的溶解度变小
课本练习
使接近饱和的硝酸钾溶液变为饱和溶液的三种方法分别是?
课本练习
在60℃时,硝酸钾的溶解度是110g。这句话的含义是?
课本练习
查溶解度曲线,在表中空白处填上该物质的溶解度?
课本练习
甲、乙、丙三种物质的溶解度曲线如右图所示。回答下列问题:
(1)a3℃时,三种物质溶解度由大到小的
顺序是_________________
(2)a3℃时,______和______的溶解度大小相等
(3)三种物质中,________的溶解度受温度影响最大,________的溶解度受温度影响最小,______的溶解度随温度升高而减小。
课本练习
甲、乙两种物质的溶解度曲线如右图所示。下列说法中正确的是
( )
A、a1℃时甲和乙的饱和溶液,升温到a2℃
时仍是饱和溶液
B、甲和乙的溶解度相等
C、a1℃,甲和乙各30g分别加入到100g水
中,均形成饱和溶液
D、a2℃时,在100g水中加入60g甲,形成
不饱和溶液
课本练习
下图是利用海水提取粗盐的过程:
(1)图中①是__________池(填“蒸发”或“冷却”)。
(2)根据海水晒盐原理,下列说法正确的是( )
A、海水进入贮水池,海水成分基本不变
B、在①中,海水中氯化钠的质量逐渐增加
C、在①中,海水中水的质量逐渐减少
D、析出晶体后的母液是氯化钠的不饱和溶液
课本练习
为什么汗水带有咸味?被汗水浸湿的衣服晾干后,常出现白色斑迹。这是为什么?
课本练习
现有一瓶蒸馏水和一瓶稀氯化钾溶液,可以用什么简单的方法把他们鉴别开?(注意:在实验室里,任何时候都不能尝溶液的味道。)
课本练习
加热冷水,当温度尚未达到沸点时,为什么水中常有气泡冒出?天气闷热时,鱼塘里的鱼为什么总是接近水面游动?
饱和溶液不饱和溶液小结
概念:在一定温度下,在一定量溶剂里,不能(还能)再溶解某种溶质的溶液,叫做该条件下这种溶质的饱和(不饱和)溶液
不饱和溶液
饱和溶液
降温、蒸发溶剂、加溶质
升温、加溶剂
一般规律(大部分固体):
固体溶解度
定义:在一定温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
溶解度的表示方法
表格法:可以知道溶解度的变化趋势以及某温度下固体的溶解度
同种物质在不同温度下的溶解度不同
曲线的交点表示这两种物质在该温度下的溶解度相同
曲线越陡,该物质的溶解度受温度影响越大
溶解度曲线:
气体溶解度
气体溶解度一般随压强增大而增大,温度升高而减小。
溶解度
从前有个国王,他的皇宫里有许多的盐,但是,他非常吝啬,从来不分给老百姓吃。老百姓们没有盐吃,有的百姓前去偷运,结果,绝大多数都被砍了头。可是,有一个从皇宫向外面拉水的人,天天都能偷运到盐,分给老百姓。拉水的人把盐放到哪去了呢?他是否能一次运出很多盐?
知识引入
概念:在一定温度下,在一定量溶剂里,不能(还能)再溶解某种溶质的溶液,叫做该条件下这种溶质的饱和(不饱和)溶液
饱和溶液 不饱和溶液
讲溶液饱和或不饱和,一定要指明温度,溶剂质量和溶质
饱和溶液 不饱和溶液
判断方法:
(1)当溶液中有固态溶质时,若固体__________________,
那么该溶液是饱和的,若固体________,那么该溶液是不饱和的;
(2)当溶液中没有固态溶质时,向溶液中加入少量相应的溶质,若溶质__________,则原溶液是饱和的,若溶质__________,则原溶液是不饱和的。
(3)当溶液中有晶体析出时,析出晶体后的溶液一定是饱和溶液。
不再减少
减少
不再溶解
继续溶解
实验饱和溶液与不饱和溶液相互转化的方法
硝酸钾全部溶解
硝酸钾仍有部分未溶解
(1)硝酸钾不再溶解
(2)加热后全部溶解
(3)冷却后又析出固体
实验饱和溶液与不饱和溶液相互转化的方法
不饱和溶液
饱和溶液
降温、蒸发溶剂、加溶质
升温、加溶剂
一般规律:
特殊溶质: Ca(OH)2
不饱和溶液
饱和溶液
升温、蒸发溶剂、加溶质
降温、加溶剂
练习
关于饱和溶液的说法中不正确的是( )
A.饱和溶液就是不再溶解任何溶质的溶液
B.饱和溶液是有条件的,即一定温度,一定量溶剂
C.饱和溶液和不饱和溶液可以相互转化
D.改变温度或者蒸发溶剂一定能使不饱和溶液变成饱和溶液。
A
下列有关饱和溶液的说法是否正确?
①食盐的饱和溶液就是不能再溶解食盐的溶液
②在20 C,不能再溶解食盐的溶液是食盐的饱和溶液
③在100g水中,不能再溶解食盐的溶液是食盐的饱和溶液
④在20 C,在100g水中,不能再溶解食盐的溶液是食盐的饱和溶液
练习
海水晒盐图
知识引入
在海水晒盐的过程中,食盐什么时候开始析出?
1、海水开始蒸发便立即析出食盐
2、海水蒸发到一定程度时,析出食盐
3、海水蒸干的同时析出食盐
……
知识引入
结晶
海水晒盐流程
海水
贮水池
蒸发池
粗盐
结晶池
母液(苦卤)
多种化工产品
结晶(分离混合物的方法)
固体物质从它的饱和溶液中以晶体的形式析出的过程叫结晶。
蒸发结晶
海水“晒盐” 是海水经日晒、风吹等,使溶剂不断减少,溶质的质量分数逐渐增大,直至形成饱和溶液,继而析出晶体,这便是蒸发结晶。
冷却热饱和溶液(降温结晶)
热溶液
冷却后
晶体
结晶后所得到的溶液是饱和溶液
物质不能无限制地溶解在一定量的溶剂中,它会受到温度、物质本身在溶剂中的溶解能力等条件的影响。
结晶
从饱和溶液中析出具有规则几何外形的固体叫做晶体
练习
下列关于海水晒盐原理的分析 ,你认为正确的是 ( )
A.利用阳光照射使海水升温得到食盐
B.利用海风降温析出食盐
C.利用阳光和风力使水分蒸发得到食盐
D.利用阳光分解海水得到食盐
C
固体的溶解度
定义:在一定温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
溶解度四要素
条件
标准
状态
单位
一定温度
100克溶剂 (水)
饱和溶液
溶质的质量(克)
固体的溶解度
如:在20℃时,100g水中溶解36g氯化钠达到饱和,我们就说20℃时,氯化钠的溶解度是36g。
又如:60℃时,硝酸钾的溶解度是110克,说明在60℃时,100g水里最多能溶解110g硝酸钾。
固体的溶解度
蔗糖在20℃时的溶解度是203.9g的意义是什么?
在20℃时,100g水中溶解203.9g蔗糖,溶液达到饱和。
在20℃时,100g水中最多可溶解203.9g蔗糖。
20℃时硝酸钾的溶解度是31.6g,这句话的含义是什么?将其关系代入下表:
20℃
31.6g
100g
131.6g
判断下列说法是否正确
(1)在20 C时,100克水中溶解了23克食盐,则食盐在20 C时的溶解度为23克
(2)在20 C时,100克溶液中含有溶质23克,则该物质的溶解度为23克
(3)在100克水中最多能溶解NaCl 36.5克,则氯化钠的溶解度为36.5克
练习
“20℃时,硝酸钾的溶解度是31.6g。”如何理解这句话的涵义
练习
表格法
硝酸钾在不同温度时的溶解度:
13.3
20.9
31.6
45.8
63.9
85.5
110
138
169
202
264
从表中我们可以知道KNO3的溶解度随温度升高而增大
从表中我们可以知道某温度下KNO3的溶解度,例如:20℃时,KNO3的溶解度是20g
溶解度曲线
同种物质在不同温度下的溶解度不同
曲线的交点表示这两种物质在该温度下的溶解度相同
曲线越陡,该物质的溶解度受温度影响越大
溶解度曲线
讨论:固体物质溶解度受温度变化影响情况?
大多数固体物质溶解度随温度升高而增大(甲), 例如:硝酸钠、氯化铵等
少数固体物质溶解度受温度影响不大(乙), 例如:食盐
极少数固体物质溶解度随温度升高反而减小(丙),例如:熟石灰。
溶解度曲线
讨论:结晶方法的选择
蒸发结晶:适用于溶解度受温度影响较小的物质(如:Y/NaCl)
降温结晶(冷却热饱和溶液)适用于溶解度受温度影响较da的物质(如:X/KNO3)
溶解度和溶解性的关系
溶解度和溶解性的关系
0.01g
1g
10g
难(不)溶
微溶
可溶
易溶
A.
B.
C.
D.
练习
A
练习
仔细观察右图,其中X为纯碱的溶解度曲线;Y为食盐的溶解度曲线。请分析盐湖地区为什么可以“冬天捞碱,夏天晒盐”
纯碱的溶解度受温度影响比较大,
食盐溶解度受温度影响较小。冬
天气温较低,纯碱降温结晶析出,而食盐因溶解度较大仍在湖水当中;夏天气温较高,水分大量蒸发,食盐蒸发结晶析出,纯碱因溶解度较大仍在湖水当中。
练习
练习
右图为X、Y两种物质的溶解度曲线,请根据图中内容回答问题:
(1)曲线X、Y的交叉点b表示的含义是( )
(2)从Y的溶液中 获得Y常用
( )法
(3)常温下,M、N两种物质都属于( )
[填易溶、可溶、微溶、难溶]
20℃时X、Y的溶解度相等
易溶
蒸发结晶
如图是甲、乙、丙三种物质的溶解度曲线。下列说法正确的是
( )
A.在t1℃时,三种物质的溶解度由大到
小的顺序是甲>乙>丙
B.在t2℃时,甲、乙两物质的溶解度相等
C.甲、乙、丙三种物质的饱和溶液升温都
会转化为不饱和溶液
D.当甲的饱和溶液中混有少量乙时,可采用降温结晶的方法析出甲
练习
BD
气体的溶解度与什么有关系呢?回答以下问题找出答案。
知识引入
打开汽水盖时,汽水会自动喷出来。这说明气体在水中的溶解度与什么有关?
喝了汽水以后,常常会打嗝。这说明气体的溶解度还与什么有关?
影响气体溶解度的因素
压强:
温度:
气体溶解度一般随压强增大而增大,压强减小而减小。
气体溶解度一般随温度升高而减小,温度降低而增大。
练习
温度升高,气体的溶解度变小
气压减小,气体的溶解度变小
温度升高,气体的溶解度变小
课本练习
使接近饱和的硝酸钾溶液变为饱和溶液的三种方法分别是?
课本练习
在60℃时,硝酸钾的溶解度是110g。这句话的含义是?
课本练习
查溶解度曲线,在表中空白处填上该物质的溶解度?
课本练习
甲、乙、丙三种物质的溶解度曲线如右图所示。回答下列问题:
(1)a3℃时,三种物质溶解度由大到小的
顺序是_________________
(2)a3℃时,______和______的溶解度大小相等
(3)三种物质中,________的溶解度受温度影响最大,________的溶解度受温度影响最小,______的溶解度随温度升高而减小。
课本练习
甲、乙两种物质的溶解度曲线如右图所示。下列说法中正确的是
( )
A、a1℃时甲和乙的饱和溶液,升温到a2℃
时仍是饱和溶液
B、甲和乙的溶解度相等
C、a1℃,甲和乙各30g分别加入到100g水
中,均形成饱和溶液
D、a2℃时,在100g水中加入60g甲,形成
不饱和溶液
课本练习
下图是利用海水提取粗盐的过程:
(1)图中①是__________池(填“蒸发”或“冷却”)。
(2)根据海水晒盐原理,下列说法正确的是( )
A、海水进入贮水池,海水成分基本不变
B、在①中,海水中氯化钠的质量逐渐增加
C、在①中,海水中水的质量逐渐减少
D、析出晶体后的母液是氯化钠的不饱和溶液
课本练习
为什么汗水带有咸味?被汗水浸湿的衣服晾干后,常出现白色斑迹。这是为什么?
课本练习
现有一瓶蒸馏水和一瓶稀氯化钾溶液,可以用什么简单的方法把他们鉴别开?(注意:在实验室里,任何时候都不能尝溶液的味道。)
课本练习
加热冷水,当温度尚未达到沸点时,为什么水中常有气泡冒出?天气闷热时,鱼塘里的鱼为什么总是接近水面游动?
饱和溶液不饱和溶液小结
概念:在一定温度下,在一定量溶剂里,不能(还能)再溶解某种溶质的溶液,叫做该条件下这种溶质的饱和(不饱和)溶液
不饱和溶液
饱和溶液
降温、蒸发溶剂、加溶质
升温、加溶剂
一般规律(大部分固体):
固体溶解度
定义:在一定温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
溶解度的表示方法
表格法:可以知道溶解度的变化趋势以及某温度下固体的溶解度
同种物质在不同温度下的溶解度不同
曲线的交点表示这两种物质在该温度下的溶解度相同
曲线越陡,该物质的溶解度受温度影响越大
溶解度曲线:
气体溶解度
气体溶解度一般随压强增大而增大,温度升高而减小。
同课章节目录
