江苏省两所学校2021-2022学年高一上学期期中联考化学试题(Word版含答案)
文档属性
| 名称 | 江苏省两所学校2021-2022学年高一上学期期中联考化学试题(Word版含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 372.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-05 21:52:02 | ||
图片预览



文档简介
响水中学、清源高级中学2021-2022学年高一上学期期中考试
化学试题
注意事项:
1.试卷分值100分,考试时间75分钟。
2.可能用到的相对原子质量:
H-1 C-12 O-16 S-32 Cl-35.5 K-39 Mn-55
第Ⅰ卷
选择题(本题有20题,每题3分,共60分,每题只有一个选项符合题意)
1.科学家用某有机分子和球形笼状分子C60制成了“纳米车”,
每辆 “纳米车” 是由一个有机分子和4个C60分子构成,
直径约到9纳米。“纳米车”可以用来运输单个有机分子。
下列说法正确的是
A.人们用肉眼可以清晰看到“纳米车”的运动
B.C60是一种新型的化合物
C. 将若干辆“纳米车”分散在水中形成分散系,用激光笔照射时会产生一条光亮的通路
D.“纳米车”是胶体
2.近期,日本政府决定将核废水排放入海,多个国家一致提出反对意见。因核废水中含有氚、锶、铯、碘等放射性核素,对海洋生物、环境以及人们自身造成威胁。原子核内中子数与核外电子数之差为
A.14 B.38 C.52 D.90
3.化学变化多姿多彩,美丽如花。如图所示,甲、乙、丙、
X分别是C、CO、Fe2O3、盐酸中的某一种,一定条件下,
甲、乙、丙均能与X发生化学反应,则X是
A.C B.Fe2O3 C.CO D.盐酸
4.下列关于物质分类的正确组合是。
选项 碱 酸 盐 碱性氧化物 酸性氧化物
A 纯碱 硫酸 小苏打 氧化钙 干冰
B 烧碱 HCl 食盐 氧化镁 一氧化碳
C 火碱 冰醋酸 胆矾 氧化铁 二氧化硫
D 硝酸 石灰石 过氧化钠 三氧化硫
5.下列说法中正确的是
A.难溶于水的电解质一定是弱电解质
B.易溶于水的电解质一定是强电解质
C.强电解质溶液的导电能力一定比弱电解质溶液强
D.强、弱电解质的本质区别是在水溶液中能否全部电离成离子
6.下列与“物质的量”相关的计算正确的是
A.18g D2O含有的中子数为10mol
B.28 g CO和22.4 L CO2中含有的碳原子数相等
C.标准状况下,11.2 L X气体分子的质量为16 g,则X气体的摩尔质量是32
D.a g Cl2中有b个氯原子,则阿伏加德罗常数NA的数值可表示为35.5b/ a
7.我国自主研制的第五代单座双发隐形战斗机歼31使用了高强度、耐高温的钛合金,工业上炼
钛的原理是在880℃—950℃下的氩气气氛发生反应:TiCl4 + 2Mg Ti + 2MgCl2 下列有关该反应的说法中正确的是
A.TCl4是还原剂 B.氩气在反应体系中做保护气,防止镁与其他元素反应
C.TiCl4中氯元素被氧化 D.每1 mol TiCl4被还原时转移2mol电子
8.下列有关物质的性质和应用说法不正确的是
A.合金可用作快中子反应堆导热剂 B.是一种比更优良的杀菌消毒剂
C.氧化镁是优质的耐高温材料 D.氯水显酸性,可用pH试纸测定氯水的pH
9.下列关于钠及其化合物的说法不正确的是
A.钠、氧化钠、过氧化钠、氢氧化钠在空气中长期放置,最终都变成碳酸钠
B.氧化钠、过氧化钠晶体中阳离子与阴离子个数比都为2:1
C.侯氏制碱法是在饱和食盐水中先通足量二氧化碳,再通入氨气,则析出碳酸氢钠晶体
D.碳酸氢钠做可以治疗胃酸过多药物,但碳酸钠不能
10.将少量通入溶液中,再加入,振荡后静置,对该实验的描述,错误的是
A.在该实验中作萃取剂 B.该实验能证明Cl2的氧化性比I2的强
C.分层,上层呈紫红色 D.该实验能说明I—的还原性比Cl—的强
11.下列反应的离子方程式中正确的是
A.氯气溶于水:Cl2 + H2O = 2H+ + Cl- + ClO-
B.碳酸钙与醋酸: CO3 2— + 2CH3COOH = CO2↑+ 2CH3COO— + H2O
C.铜片插入硝酸银溶液中: Cu +2 Ag+== Cu 2++ 2 Ag
D.过氧化钠与水反应:2+2H2O=4OH-+O2↑
12.室温下,在强酸性和强碱性溶液中都能大量共存的离子组是
A.、、、 B.、、、
C.、、、 D.、、、
13.实验室用Na2CO3溶液、BaCl2溶液、NaOH溶液等试剂除去粗盐中含有的Ca2+、Mg2+、,下列有关粗盐提纯正确的是
A.除去粗盐中的泥沙,所需玻璃仪器有烧杯、玻璃棒、漏斗
B.除杂质离子时,应先加Na2CO3溶液,再加BaCl2溶液
C.加入NaOH溶液的主要目的是除去溶液中的Ca2+
D.每加入一种除杂试剂,必须过滤除去产生的沉淀后,再在滤液中加入另一种除杂试剂
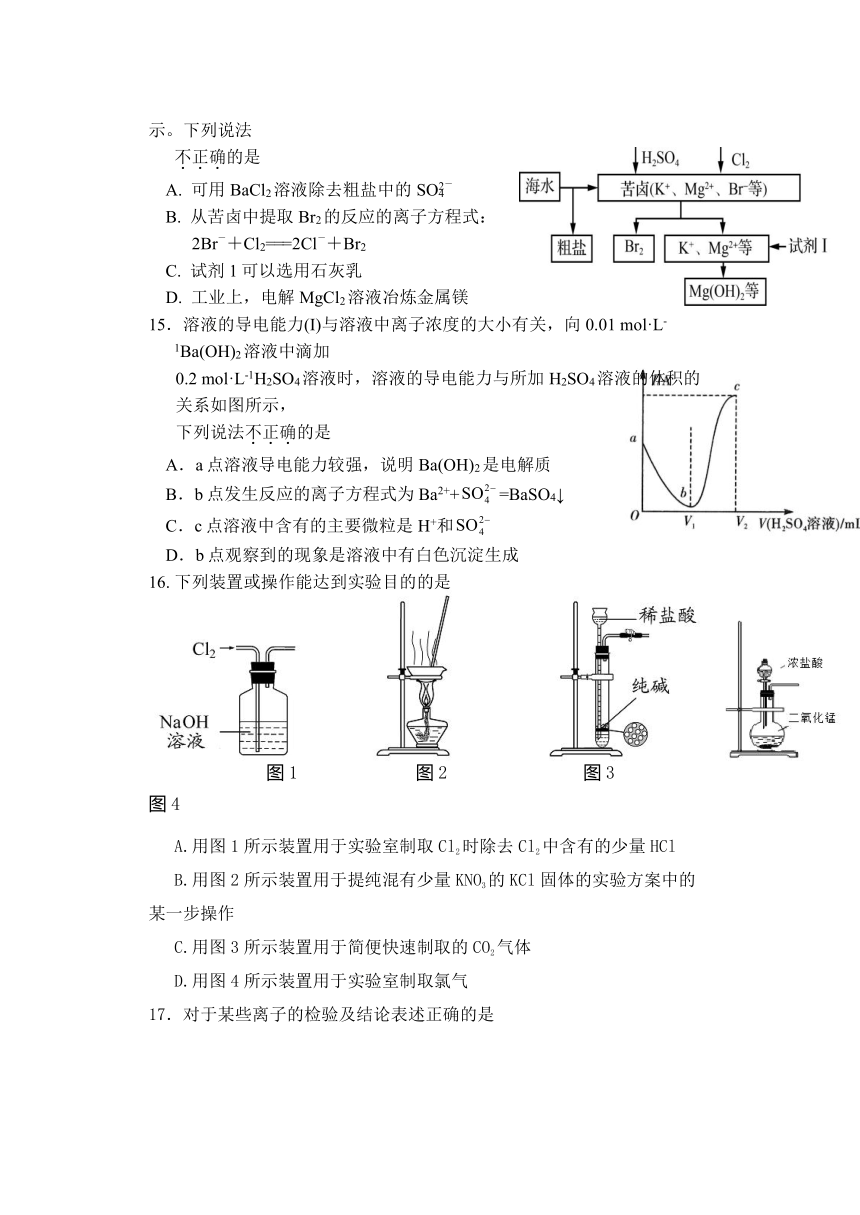
14. 海洋约占地球表面积的71%,对其进行开发利用的 部分流程如右图所示。下列说法
不正确的是
A. 可用BaCl2溶液除去粗盐中的SO
B. 从苦卤中提取Br2的反应的离子方程式:
2Br-+Cl2===2Cl-+Br2
C. 试剂1可以选用石灰乳
D. 工业上,电解MgCl2溶液冶炼金属镁
15.溶液的导电能力(I)与溶液中离子浓度的大小有关,向0.01 mol·L-1Ba(OH)2溶液中滴加
0.2 mol·L-1H2SO4溶液时,溶液的导电能力与所加H2SO4溶液的体积的关系如图所示,
下列说法不正确的是
A.a点溶液导电能力较强,说明Ba(OH)2是电解质
B.b点发生反应的离子方程式为Ba2++=BaSO4↓
C.c点溶液中含有的主要微粒是H+和
D.b点观察到的现象是溶液中有白色沉淀生成
16. 下列装置或操作能达到实验目的的是
图1 图2 图3 图4
A.用图1所示装置用于实验室制取Cl2时除去Cl2中含有的少量HCl
B.用图2所示装置用于提纯混有少量KNO3的KCl固体的实验方案中的某一步操作
C.用图3所示装置用于简便快速制取的CO2气体
D.用图4所示装置用于实验室制取氯气
17.对于某些离子的检验及结论表述正确的是
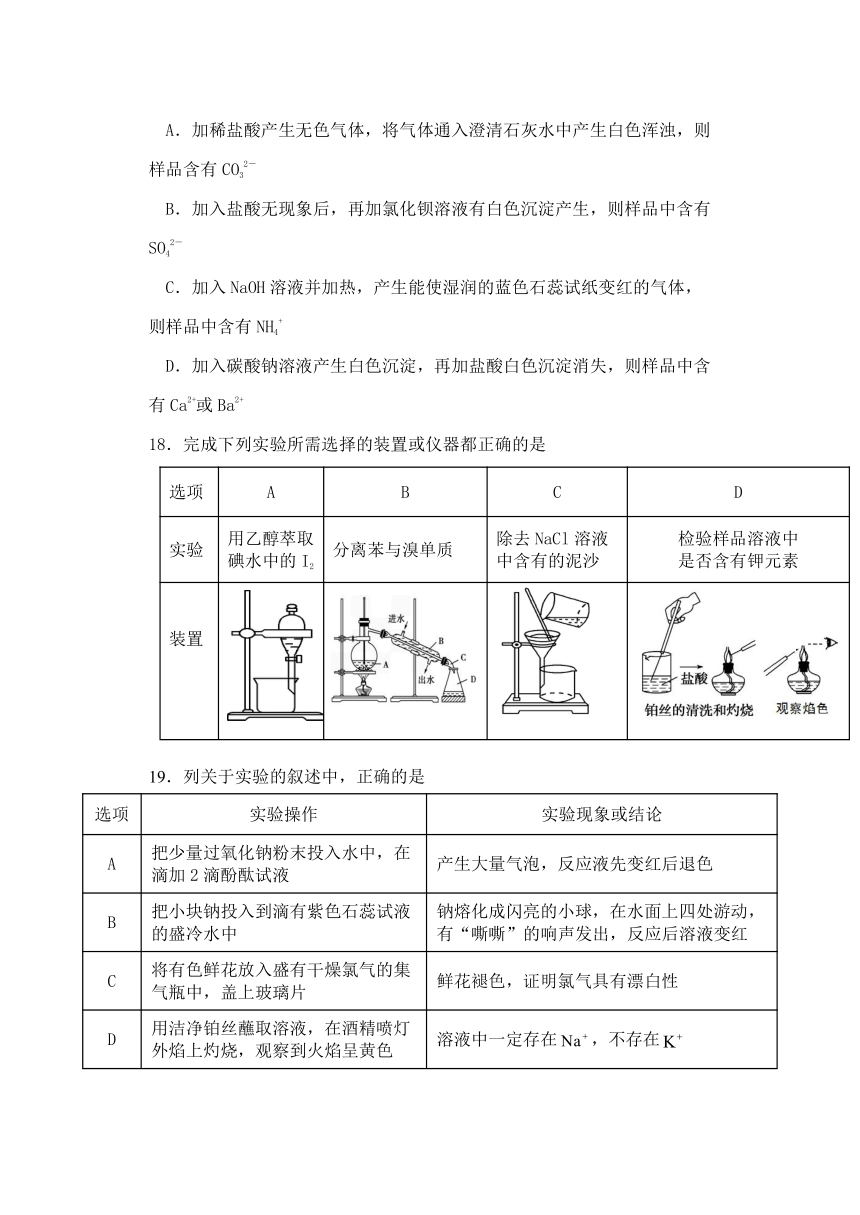
A.加稀盐酸产生无色气体,将气体通入澄清石灰水中产生白色浑浊,则样品含有CO32-
B.加入盐酸无现象后,再加氯化钡溶液有白色沉淀产生,则样品中含有SO42-
C.加入NaOH溶液并加热,产生能使湿润的蓝色石蕊试纸变红的气体,则样品中含有NH4+
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,则样品中含有Ca2+或Ba2+
18.完成下列实验所需选择的装置或仪器都正确的是
选项 A B C D
实验 用乙醇萃取碘水中的I2 分离苯与溴单质 除去NaCl溶液中含有的泥沙 检验样品溶液中 是否含有钾元素
装置
19.列关于实验的叙述中,正确的是
选项 实验操作 实验现象或结论
A 把少量过氧化钠粉末投入水中,在滴加2滴酚酞试液 产生大量气泡,反应液先变红后退色
B 把小块钠投入到滴有紫色石蕊试液的盛冷水中 钠熔化成闪亮的小球,在水面上四处游动,有“嘶嘶”的响声发出,反应后溶液变红
C 将有色鲜花放入盛有干燥氯气的集气瓶中,盖上玻璃片 鲜花褪色,证明氯气具有漂白性
D 用洁净铂丝蘸取溶液,在酒精喷灯外焰上灼烧,观察到火焰呈黄色 溶液中一定存在,不存在
20.ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求,ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业制备ClO2的方法有多种,其中之一是用 NaClO3和H2C2O4(草酸)的混合溶液加硫酸酸化制取ClO2,该反应中还原剂和氧化剂的物质的量之比是
A. 1: 1 B.2 : 1 C.1 : 2 D.2 : 3
第II卷
非选择题(本部分有5题,共40分)
21.(6分)在化学家的眼中,丰富多彩的化学物质可以按一定的标准进行分类。电解质和非电
解质是中学化学中两个重要的概念,辨析清楚有利于我们对元素化合物知识的学习。
(1)在下列化学物质物质中(用字母序号填空)
a. Na b. 熔融K2O c. CO2 d. HCl e. 稀硫酸 f.Ba(OH) 2固体 g.NH4HCO3 h.蔗糖
①能导电的电解质的是 ▲ ,
②非电解质的是 ▲ .
③既不是电解质也不是非电解质是 ▲ .
(2)写出下列电解质在水溶液中的电离方程式
①Ba(OH)2 ▲ .
②(NH4)2SO4 ▲ .
③KAl(SO4)2 ▲ .
22. (9分)某化学兴趣小组做某次实验时需要490 mL
0.2 mol/L的硫酸,现在请你帮忙用右图的浓硫酸
来配制,实验仪器自选。请回答下列问题:
(1)该浓硫酸中H2SO4的物质的量浓度为 ▲ ,
(2)经计算,需浓H2SO4的体积为 ▲ ,
如用量筒量取浓硫酸,应选用量筒的规格是__ ▲ ____
(3)配制该稀硫酸时必须使用的玻璃仪器有:量筒、烧杯、胶头滴管,还必须用到的两种
玻璃仪器分别是 ▲ 、 ▲ 。
(4)在该配制溶液的实验中,你必须用到胶头滴管的实验步骤有几处 ? ▲ 。
(5)对所配的稀硫酸进行测定,发现其浓度大于0.2 mol· L-1,配制过程中下列各项
操作可能导致该问题的是_ ▲ __(填字母)。
A.定容时,仰视容量瓶刻度线进行定容
B.量筒量取浓硫酸时,仰视刻度线
C.将硫酸稀释后立即转入容量瓶后,紧接着就进行之后的实验操作
D.转移溶液时,不慎有少量溶液洒到容量瓶外面
E.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
F.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
23.( 10分)碘( Godine)是人体必需的微量元素,是维持人体甲状腺正常功能所必需的元素, 人体缺碘时就会患甲状腺肿大,人们主要从饮水、粮食、蔬菜和周围环境中获取碘。多食海带,海鱼等含碘丰富的食品,对于防治甲状腺肿大很有效。某化学课外活动小组在实验室以海带为原料获得少量碘水,并以四氯化碳(沸点76.8℃)为溶剂将碘从碘水中提取出来,甲同学设计实验流程如图所示。请回答下列问题:
(1)上述流程中灼烧时必须用到最主要的实验仪器有酒精灯、泥三角和 ▲ (填名称)
(2)操作①的名称为 ▲ ;
(3)操作②中发生反应的离子方程式为 ▲ ,
乙同学对操作②进行了改进,用绿色氧化剂H2O2代替氯气并加适量稀盐酸,则所发生的
离子反应方程式是 ▲ ;
(4) 操作③的实验名称为 ▲ ,最主要的实验仪器的名称为 ▲ ;
(5)丙同学补充增加了一步操作:从碘的CCl4溶液中经过 ▲ 提取了碘单质并回收CCl4
(填该操作名称)
(6)目前,我国推行全民食用的加碘盐是在食盐中加入 ▲ 这一物质(填写化学式)。
24.(9分)钠元素在自然界中分布很广,储量极为丰富,都以化合态存在,如氯化钠、碳酸钠、硫酸钠等。钠单质和钠的化合物在生产、生活中被广泛应用。请根据钠及其化合物性质按
要求完成各题。
(1)金属钠的密度比水小,在钠与水反应的实验中,能得出“该反应是放热反应”这一结论的
实验现象是 ▲ ,反应的离子方程式是 ▲ 。
(2)钠的焰色反应的焰色为 ▲ 色,该波长的光射程远,透雾力强,据此原理制作的高压钠灯广泛应用于道路和广场的照明。金属焰色反应是 ▲ 变化(填“物理”或“化学”)。
(3)过氧化钠是一种淡黄色的固体, 可作漂白剂和呼吸面具中的供氧剂。写出过氧化钠和二氧化碳反应的化学方程式,并用双线桥表示电子转移方向和数目 ▲ 。
25.(6分) 1774年,瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸在一定条件下
能反应产生一种黄绿色气体,命名为氯气。 实验室也可以用高锰酸钾和盐酸反应制氯气。
(1)写出该反应的离子方程式: ▲ ,
(2)当质量分数80%的高锰酸钾7.9g完全反应时,计算理论上生成标准状况下氯气体积(假设杂质不参与反应)。
响水中学、清源高级中学2021-2022学年高一上学期期中考试
化学试题参考答案
选择题(单选,每题3分,共60分)
题号 1 2 3 4 5 6 7 8 9 10
答案 C A B C D D B D C C
题号 11 12 13 14 15 16 17 18 19 20
答案 C B A D B B B C A C
非选择题(5题,共40分)
21.(每空1分,共6分)
(1)① b ② c h ③ a e
(2)①Ba(OH)2 === Ba2+ + 2OH—
②(NH4)2SO4 == 2NH4+ + SO4 2—
③KAl(SO4)2 == K + + Al3+ + 2 SO42—
22.(计算每空2分,其余每空1分,共9分)
(1)18.4 mol/L(2分) (2) 5.4mL (2分) 10mL
(3)500mL容量瓶 玻璃棒 (无顺序) (4)两处 (5)B C
23.(方程式书写每空2分,其余每空1分,共10分)
(1)坩埚 (2)过滤
(3) Cl2 + 2 I— == 2Cl— + I2 (2分) H2O2 + 2 I— + 2 H+ == I2 + 2H2O (2分)
(4)萃取分液 分液漏斗 (5)蒸馏 (6)KIO3
24.(9分)
(1) 钠块熔化成光亮的小球(1分) 2 H2O + 2 Na == H2 ↑+ 2 Na+ + 2OH — (2分)
(2) 黄(1分) 物理(1分) (3) (4分)
25.(方程式2分,计算4分,共6分)
(1)2MnO4— + 16 H+ + 10Cl— == 2Mn2+ + 5 Cl2 ↑ + 8H2O
(2) 解: n(KmnO4 )= 7.9g × 80% ÷158 g/mol = 0.04 mol -----------------(1分)
2KMnO4 + 16 HCl == 2 KCl + 2MnCl 2+ 5 Cl2 ↑ + 8H2O
2 mol 5mol×22.4 L/mol
0.04 mol V(Cl2) -----------------(2分)
V(Cl2)=2.24 L -------------------------------------------------------------------(3分)
答:理论上生成标准状况下氯气体积为2.24L ----------------------------------(4分)
化学试题
注意事项:
1.试卷分值100分,考试时间75分钟。
2.可能用到的相对原子质量:
H-1 C-12 O-16 S-32 Cl-35.5 K-39 Mn-55
第Ⅰ卷
选择题(本题有20题,每题3分,共60分,每题只有一个选项符合题意)
1.科学家用某有机分子和球形笼状分子C60制成了“纳米车”,
每辆 “纳米车” 是由一个有机分子和4个C60分子构成,
直径约到9纳米。“纳米车”可以用来运输单个有机分子。
下列说法正确的是
A.人们用肉眼可以清晰看到“纳米车”的运动
B.C60是一种新型的化合物
C. 将若干辆“纳米车”分散在水中形成分散系,用激光笔照射时会产生一条光亮的通路
D.“纳米车”是胶体
2.近期,日本政府决定将核废水排放入海,多个国家一致提出反对意见。因核废水中含有氚、锶、铯、碘等放射性核素,对海洋生物、环境以及人们自身造成威胁。原子核内中子数与核外电子数之差为
A.14 B.38 C.52 D.90
3.化学变化多姿多彩,美丽如花。如图所示,甲、乙、丙、
X分别是C、CO、Fe2O3、盐酸中的某一种,一定条件下,
甲、乙、丙均能与X发生化学反应,则X是
A.C B.Fe2O3 C.CO D.盐酸
4.下列关于物质分类的正确组合是。
选项 碱 酸 盐 碱性氧化物 酸性氧化物
A 纯碱 硫酸 小苏打 氧化钙 干冰
B 烧碱 HCl 食盐 氧化镁 一氧化碳
C 火碱 冰醋酸 胆矾 氧化铁 二氧化硫
D 硝酸 石灰石 过氧化钠 三氧化硫
5.下列说法中正确的是
A.难溶于水的电解质一定是弱电解质
B.易溶于水的电解质一定是强电解质
C.强电解质溶液的导电能力一定比弱电解质溶液强
D.强、弱电解质的本质区别是在水溶液中能否全部电离成离子
6.下列与“物质的量”相关的计算正确的是
A.18g D2O含有的中子数为10mol
B.28 g CO和22.4 L CO2中含有的碳原子数相等
C.标准状况下,11.2 L X气体分子的质量为16 g,则X气体的摩尔质量是32
D.a g Cl2中有b个氯原子,则阿伏加德罗常数NA的数值可表示为35.5b/ a
7.我国自主研制的第五代单座双发隐形战斗机歼31使用了高强度、耐高温的钛合金,工业上炼
钛的原理是在880℃—950℃下的氩气气氛发生反应:TiCl4 + 2Mg Ti + 2MgCl2 下列有关该反应的说法中正确的是
A.TCl4是还原剂 B.氩气在反应体系中做保护气,防止镁与其他元素反应
C.TiCl4中氯元素被氧化 D.每1 mol TiCl4被还原时转移2mol电子
8.下列有关物质的性质和应用说法不正确的是
A.合金可用作快中子反应堆导热剂 B.是一种比更优良的杀菌消毒剂
C.氧化镁是优质的耐高温材料 D.氯水显酸性,可用pH试纸测定氯水的pH
9.下列关于钠及其化合物的说法不正确的是
A.钠、氧化钠、过氧化钠、氢氧化钠在空气中长期放置,最终都变成碳酸钠
B.氧化钠、过氧化钠晶体中阳离子与阴离子个数比都为2:1
C.侯氏制碱法是在饱和食盐水中先通足量二氧化碳,再通入氨气,则析出碳酸氢钠晶体
D.碳酸氢钠做可以治疗胃酸过多药物,但碳酸钠不能
10.将少量通入溶液中,再加入,振荡后静置,对该实验的描述,错误的是
A.在该实验中作萃取剂 B.该实验能证明Cl2的氧化性比I2的强
C.分层,上层呈紫红色 D.该实验能说明I—的还原性比Cl—的强
11.下列反应的离子方程式中正确的是
A.氯气溶于水:Cl2 + H2O = 2H+ + Cl- + ClO-
B.碳酸钙与醋酸: CO3 2— + 2CH3COOH = CO2↑+ 2CH3COO— + H2O
C.铜片插入硝酸银溶液中: Cu +2 Ag+== Cu 2++ 2 Ag
D.过氧化钠与水反应:2+2H2O=4OH-+O2↑
12.室温下,在强酸性和强碱性溶液中都能大量共存的离子组是
A.、、、 B.、、、
C.、、、 D.、、、
13.实验室用Na2CO3溶液、BaCl2溶液、NaOH溶液等试剂除去粗盐中含有的Ca2+、Mg2+、,下列有关粗盐提纯正确的是
A.除去粗盐中的泥沙,所需玻璃仪器有烧杯、玻璃棒、漏斗
B.除杂质离子时,应先加Na2CO3溶液,再加BaCl2溶液
C.加入NaOH溶液的主要目的是除去溶液中的Ca2+
D.每加入一种除杂试剂,必须过滤除去产生的沉淀后,再在滤液中加入另一种除杂试剂
14. 海洋约占地球表面积的71%,对其进行开发利用的 部分流程如右图所示。下列说法
不正确的是
A. 可用BaCl2溶液除去粗盐中的SO
B. 从苦卤中提取Br2的反应的离子方程式:
2Br-+Cl2===2Cl-+Br2
C. 试剂1可以选用石灰乳
D. 工业上,电解MgCl2溶液冶炼金属镁
15.溶液的导电能力(I)与溶液中离子浓度的大小有关,向0.01 mol·L-1Ba(OH)2溶液中滴加
0.2 mol·L-1H2SO4溶液时,溶液的导电能力与所加H2SO4溶液的体积的关系如图所示,
下列说法不正确的是
A.a点溶液导电能力较强,说明Ba(OH)2是电解质
B.b点发生反应的离子方程式为Ba2++=BaSO4↓
C.c点溶液中含有的主要微粒是H+和
D.b点观察到的现象是溶液中有白色沉淀生成
16. 下列装置或操作能达到实验目的的是
图1 图2 图3 图4
A.用图1所示装置用于实验室制取Cl2时除去Cl2中含有的少量HCl
B.用图2所示装置用于提纯混有少量KNO3的KCl固体的实验方案中的某一步操作
C.用图3所示装置用于简便快速制取的CO2气体
D.用图4所示装置用于实验室制取氯气
17.对于某些离子的检验及结论表述正确的是
A.加稀盐酸产生无色气体,将气体通入澄清石灰水中产生白色浑浊,则样品含有CO32-
B.加入盐酸无现象后,再加氯化钡溶液有白色沉淀产生,则样品中含有SO42-
C.加入NaOH溶液并加热,产生能使湿润的蓝色石蕊试纸变红的气体,则样品中含有NH4+
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,则样品中含有Ca2+或Ba2+
18.完成下列实验所需选择的装置或仪器都正确的是
选项 A B C D
实验 用乙醇萃取碘水中的I2 分离苯与溴单质 除去NaCl溶液中含有的泥沙 检验样品溶液中 是否含有钾元素
装置
19.列关于实验的叙述中,正确的是
选项 实验操作 实验现象或结论
A 把少量过氧化钠粉末投入水中,在滴加2滴酚酞试液 产生大量气泡,反应液先变红后退色
B 把小块钠投入到滴有紫色石蕊试液的盛冷水中 钠熔化成闪亮的小球,在水面上四处游动,有“嘶嘶”的响声发出,反应后溶液变红
C 将有色鲜花放入盛有干燥氯气的集气瓶中,盖上玻璃片 鲜花褪色,证明氯气具有漂白性
D 用洁净铂丝蘸取溶液,在酒精喷灯外焰上灼烧,观察到火焰呈黄色 溶液中一定存在,不存在
20.ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求,ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业制备ClO2的方法有多种,其中之一是用 NaClO3和H2C2O4(草酸)的混合溶液加硫酸酸化制取ClO2,该反应中还原剂和氧化剂的物质的量之比是
A. 1: 1 B.2 : 1 C.1 : 2 D.2 : 3
第II卷
非选择题(本部分有5题,共40分)
21.(6分)在化学家的眼中,丰富多彩的化学物质可以按一定的标准进行分类。电解质和非电
解质是中学化学中两个重要的概念,辨析清楚有利于我们对元素化合物知识的学习。
(1)在下列化学物质物质中(用字母序号填空)
a. Na b. 熔融K2O c. CO2 d. HCl e. 稀硫酸 f.Ba(OH) 2固体 g.NH4HCO3 h.蔗糖
①能导电的电解质的是 ▲ ,
②非电解质的是 ▲ .
③既不是电解质也不是非电解质是 ▲ .
(2)写出下列电解质在水溶液中的电离方程式
①Ba(OH)2 ▲ .
②(NH4)2SO4 ▲ .
③KAl(SO4)2 ▲ .
22. (9分)某化学兴趣小组做某次实验时需要490 mL
0.2 mol/L的硫酸,现在请你帮忙用右图的浓硫酸
来配制,实验仪器自选。请回答下列问题:
(1)该浓硫酸中H2SO4的物质的量浓度为 ▲ ,
(2)经计算,需浓H2SO4的体积为 ▲ ,
如用量筒量取浓硫酸,应选用量筒的规格是__ ▲ ____
(3)配制该稀硫酸时必须使用的玻璃仪器有:量筒、烧杯、胶头滴管,还必须用到的两种
玻璃仪器分别是 ▲ 、 ▲ 。
(4)在该配制溶液的实验中,你必须用到胶头滴管的实验步骤有几处 ? ▲ 。
(5)对所配的稀硫酸进行测定,发现其浓度大于0.2 mol· L-1,配制过程中下列各项
操作可能导致该问题的是_ ▲ __(填字母)。
A.定容时,仰视容量瓶刻度线进行定容
B.量筒量取浓硫酸时,仰视刻度线
C.将硫酸稀释后立即转入容量瓶后,紧接着就进行之后的实验操作
D.转移溶液时,不慎有少量溶液洒到容量瓶外面
E.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
F.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
23.( 10分)碘( Godine)是人体必需的微量元素,是维持人体甲状腺正常功能所必需的元素, 人体缺碘时就会患甲状腺肿大,人们主要从饮水、粮食、蔬菜和周围环境中获取碘。多食海带,海鱼等含碘丰富的食品,对于防治甲状腺肿大很有效。某化学课外活动小组在实验室以海带为原料获得少量碘水,并以四氯化碳(沸点76.8℃)为溶剂将碘从碘水中提取出来,甲同学设计实验流程如图所示。请回答下列问题:
(1)上述流程中灼烧时必须用到最主要的实验仪器有酒精灯、泥三角和 ▲ (填名称)
(2)操作①的名称为 ▲ ;
(3)操作②中发生反应的离子方程式为 ▲ ,
乙同学对操作②进行了改进,用绿色氧化剂H2O2代替氯气并加适量稀盐酸,则所发生的
离子反应方程式是 ▲ ;
(4) 操作③的实验名称为 ▲ ,最主要的实验仪器的名称为 ▲ ;
(5)丙同学补充增加了一步操作:从碘的CCl4溶液中经过 ▲ 提取了碘单质并回收CCl4
(填该操作名称)
(6)目前,我国推行全民食用的加碘盐是在食盐中加入 ▲ 这一物质(填写化学式)。
24.(9分)钠元素在自然界中分布很广,储量极为丰富,都以化合态存在,如氯化钠、碳酸钠、硫酸钠等。钠单质和钠的化合物在生产、生活中被广泛应用。请根据钠及其化合物性质按
要求完成各题。
(1)金属钠的密度比水小,在钠与水反应的实验中,能得出“该反应是放热反应”这一结论的
实验现象是 ▲ ,反应的离子方程式是 ▲ 。
(2)钠的焰色反应的焰色为 ▲ 色,该波长的光射程远,透雾力强,据此原理制作的高压钠灯广泛应用于道路和广场的照明。金属焰色反应是 ▲ 变化(填“物理”或“化学”)。
(3)过氧化钠是一种淡黄色的固体, 可作漂白剂和呼吸面具中的供氧剂。写出过氧化钠和二氧化碳反应的化学方程式,并用双线桥表示电子转移方向和数目 ▲ 。
25.(6分) 1774年,瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸在一定条件下
能反应产生一种黄绿色气体,命名为氯气。 实验室也可以用高锰酸钾和盐酸反应制氯气。
(1)写出该反应的离子方程式: ▲ ,
(2)当质量分数80%的高锰酸钾7.9g完全反应时,计算理论上生成标准状况下氯气体积(假设杂质不参与反应)。
响水中学、清源高级中学2021-2022学年高一上学期期中考试
化学试题参考答案
选择题(单选,每题3分,共60分)
题号 1 2 3 4 5 6 7 8 9 10
答案 C A B C D D B D C C
题号 11 12 13 14 15 16 17 18 19 20
答案 C B A D B B B C A C
非选择题(5题,共40分)
21.(每空1分,共6分)
(1)① b ② c h ③ a e
(2)①Ba(OH)2 === Ba2+ + 2OH—
②(NH4)2SO4 == 2NH4+ + SO4 2—
③KAl(SO4)2 == K + + Al3+ + 2 SO42—
22.(计算每空2分,其余每空1分,共9分)
(1)18.4 mol/L(2分) (2) 5.4mL (2分) 10mL
(3)500mL容量瓶 玻璃棒 (无顺序) (4)两处 (5)B C
23.(方程式书写每空2分,其余每空1分,共10分)
(1)坩埚 (2)过滤
(3) Cl2 + 2 I— == 2Cl— + I2 (2分) H2O2 + 2 I— + 2 H+ == I2 + 2H2O (2分)
(4)萃取分液 分液漏斗 (5)蒸馏 (6)KIO3
24.(9分)
(1) 钠块熔化成光亮的小球(1分) 2 H2O + 2 Na == H2 ↑+ 2 Na+ + 2OH — (2分)
(2) 黄(1分) 物理(1分) (3) (4分)
25.(方程式2分,计算4分,共6分)
(1)2MnO4— + 16 H+ + 10Cl— == 2Mn2+ + 5 Cl2 ↑ + 8H2O
(2) 解: n(KmnO4 )= 7.9g × 80% ÷158 g/mol = 0.04 mol -----------------(1分)
2KMnO4 + 16 HCl == 2 KCl + 2MnCl 2+ 5 Cl2 ↑ + 8H2O
2 mol 5mol×22.4 L/mol
0.04 mol V(Cl2) -----------------(2分)
V(Cl2)=2.24 L -------------------------------------------------------------------(3分)
答:理论上生成标准状况下氯气体积为2.24L ----------------------------------(4分)
同课章节目录
