铁及其重要化合物
图片预览







文档简介
(共20张PPT)
新课标人教版课件系列
《高中化学》
必修1
3.2.3《铁的重要
化合物》
教学目标
知识与能力:
铁的氧化物的性质与比较;铁的氢氧化物的性质与比较;Fe3+离子的检验;“铁三角”(即Fe. Fe2+ .Fe3+之间的转化)
教学方法:
通过讨论、发现问题、实验探究、类比、构建思维导图等方法
教学手段:
多媒体辅助,魔术表演(沾KSCN溶液的白花)
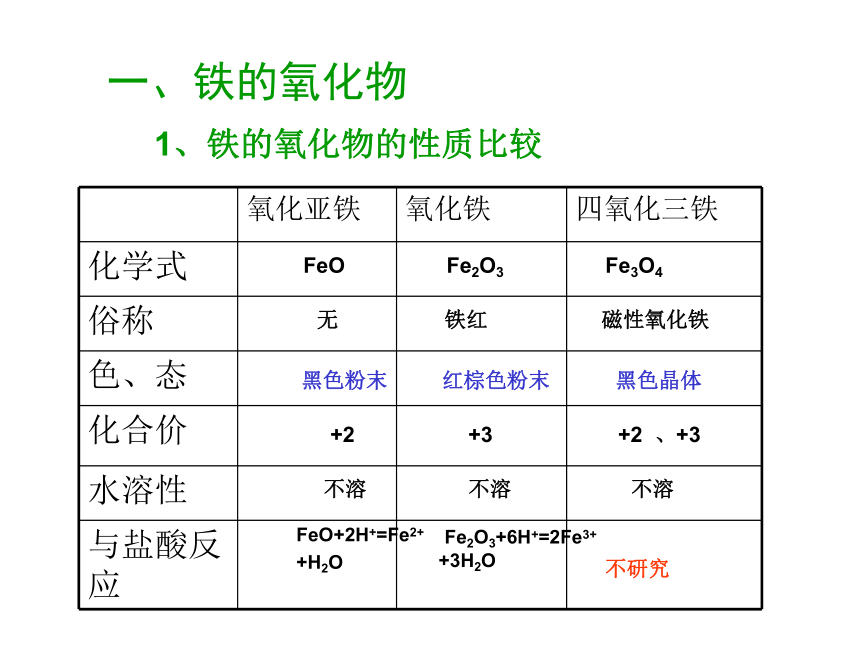
一、铁的氧化物
1、铁的氧化物的性质比较
氧化亚铁 氧化铁 四氧化三铁
化学式
俗称
色、态
化合价
水溶性
与盐酸反应
不研究
FeO Fe2O3 Fe3O4
无 铁红 磁性氧化铁
黑色粉末 红棕色粉末 黑色晶体
+2 +3 +2 、+3
不溶 不溶 不溶
FeO+2H+=Fe2+
+H2O
Fe2O3+6H+=2Fe3+
+3H2O
2、 铁的氧化物 的用途
Ⅰ.作为冶炼金属的原料
Fe2O3+3CO===2Fe+3CO2
Ⅱ.氧化铁常用于制造红色油漆和涂料
氧化铁作外墙涂料
高温
二、铁的氢氧化物
有两种:Fe(OH)3 、Fe(OH) 2
如何制备Fe(OH)3 、Fe(OH)2 ?
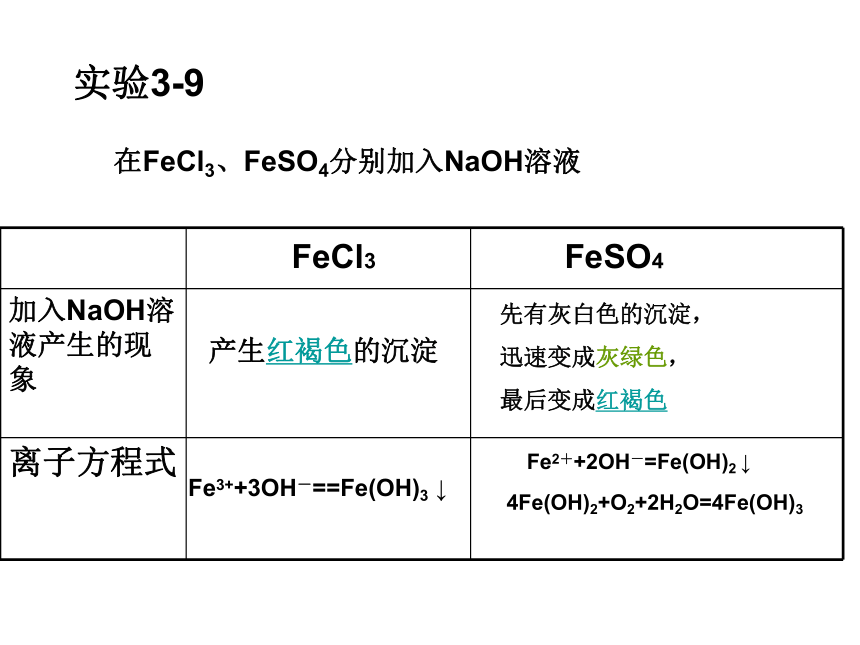
实验3-9
在FeCl3、FeSO4分别加入NaOH溶液
FeCl3 FeSO4
加入NaOH溶液产生的现象
离子方程式
产生红褐色的沉淀
先有灰白色的沉淀,
迅速变成灰绿色,
最后变成红褐色
Fe3++3OH-==Fe(OH)3 ↓
Fe2++2OH-=Fe(OH)2 ↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
Fe(OH)3
Fe(OH)2转变过程
FeSO4+2NaOH=Fe(OH)2↓+Na2SO4
4Fe(OH)2+O2+2H2O=4Fe(OH)3
思考与交流
既然Fe(OH)2 容易被空气中的氧气氧化,那么在制备Fe(OH)2时应采取哪些措施防止其被氧化
三、铁盐和亚铁盐
1、常见的铁盐和亚铁盐
铁盐:FeCl3 、 Fe2(SO4)3 、 Fe(NO3)3
亚铁盐: FeCl2 、Fe(SO4)2 、Fe(NO3)2
(1)、Fe3+离子的检验
向FeCl3和FeCl2溶液中分别滴入KSCN溶液
滴入KSCN溶液
FeCl3溶液
FeCl2溶液
溶液呈血红色
溶液颜色无变化
有哪些方法可以鉴别
FeCl3溶液和FeCl2溶液?
(1)颜色:Fe 2+ Fe3+ .
Fe2+ 和Fe3+的鉴别方法:
浅绿色
黄色
(2)KSCN法:滴入KSCN溶液,呈______ 色的溶液中含有Fe 3+
血红
(3)碱液法:分别加入碱液(或氨水),生成 色沉淀的溶液中含有Fe3+,先生成 色沉淀,又迅速转变为 色,最后变为 的溶液中含有Fe2+
红褐
白
灰绿
红褐
(2)、Fe3+的氧化性(科学探究)
实验(1):在FeCl3溶液中加入Fe粉,振荡。再滴入几滴KSCN溶液
现象:
结论:
2FeCl3 + Fe == 3FeCl2
反应方程式:
(氧化剂)
(还原剂)
离子方程式:
2FeCl3 + Cu == 2FeCl2+CuCl2
(氧化剂)
(还原剂)
溶液不显血红色
溶液中不含Fe3+
2Fe3++ Fe == 3Fe2+
金属铜也能将Fe3+还原:
实验2:在以上所得到的FeCl2和KSCN的混合
溶液中,滴加氯水(Cl2)
现象:
溶液变成血红色
结论:
原溶液中的Fe2+转变成Fe3+
反应方程式:
2FeCl2 + Cl2 == 2FeCl3
离子方程式:
2Fe2+ + Cl2 == 2Fe3+ +2Cl-
(还原剂)
(氧化剂)
小结:
还原剂
+氧化剂(Cl2)
+还原剂(Fe)
氧化剂
Fe2+
Fe3+
课堂练习:
1.将下列四种化合物溶于稀盐酸,滴加硫氰化钾溶液没有颜色变化的是: ( )
A.FeS B.Fe2O3
C.FeCl3 D.Fe2(SO4)3
A
课堂练习:
2. 硫酸亚铁溶液含有杂质硫酸铜和硫酸铁,为除去杂质,提纯硫酸亚铁,应该加入下列哪种物质 ( )
A.锌粉 B.镁粉
C.铁粉 D. 铝粉
C
新课标人教版课件系列
《高中化学》
必修1
3.2.3《铁的重要
化合物》
教学目标
知识与能力:
铁的氧化物的性质与比较;铁的氢氧化物的性质与比较;Fe3+离子的检验;“铁三角”(即Fe. Fe2+ .Fe3+之间的转化)
教学方法:
通过讨论、发现问题、实验探究、类比、构建思维导图等方法
教学手段:
多媒体辅助,魔术表演(沾KSCN溶液的白花)
一、铁的氧化物
1、铁的氧化物的性质比较
氧化亚铁 氧化铁 四氧化三铁
化学式
俗称
色、态
化合价
水溶性
与盐酸反应
不研究
FeO Fe2O3 Fe3O4
无 铁红 磁性氧化铁
黑色粉末 红棕色粉末 黑色晶体
+2 +3 +2 、+3
不溶 不溶 不溶
FeO+2H+=Fe2+
+H2O
Fe2O3+6H+=2Fe3+
+3H2O
2、 铁的氧化物 的用途
Ⅰ.作为冶炼金属的原料
Fe2O3+3CO===2Fe+3CO2
Ⅱ.氧化铁常用于制造红色油漆和涂料
氧化铁作外墙涂料
高温
二、铁的氢氧化物
有两种:Fe(OH)3 、Fe(OH) 2
如何制备Fe(OH)3 、Fe(OH)2 ?
实验3-9
在FeCl3、FeSO4分别加入NaOH溶液
FeCl3 FeSO4
加入NaOH溶液产生的现象
离子方程式
产生红褐色的沉淀
先有灰白色的沉淀,
迅速变成灰绿色,
最后变成红褐色
Fe3++3OH-==Fe(OH)3 ↓
Fe2++2OH-=Fe(OH)2 ↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
Fe(OH)3
Fe(OH)2转变过程
FeSO4+2NaOH=Fe(OH)2↓+Na2SO4
4Fe(OH)2+O2+2H2O=4Fe(OH)3
思考与交流
既然Fe(OH)2 容易被空气中的氧气氧化,那么在制备Fe(OH)2时应采取哪些措施防止其被氧化
三、铁盐和亚铁盐
1、常见的铁盐和亚铁盐
铁盐:FeCl3 、 Fe2(SO4)3 、 Fe(NO3)3
亚铁盐: FeCl2 、Fe(SO4)2 、Fe(NO3)2
(1)、Fe3+离子的检验
向FeCl3和FeCl2溶液中分别滴入KSCN溶液
滴入KSCN溶液
FeCl3溶液
FeCl2溶液
溶液呈血红色
溶液颜色无变化
有哪些方法可以鉴别
FeCl3溶液和FeCl2溶液?
(1)颜色:Fe 2+ Fe3+ .
Fe2+ 和Fe3+的鉴别方法:
浅绿色
黄色
(2)KSCN法:滴入KSCN溶液,呈______ 色的溶液中含有Fe 3+
血红
(3)碱液法:分别加入碱液(或氨水),生成 色沉淀的溶液中含有Fe3+,先生成 色沉淀,又迅速转变为 色,最后变为 的溶液中含有Fe2+
红褐
白
灰绿
红褐
(2)、Fe3+的氧化性(科学探究)
实验(1):在FeCl3溶液中加入Fe粉,振荡。再滴入几滴KSCN溶液
现象:
结论:
2FeCl3 + Fe == 3FeCl2
反应方程式:
(氧化剂)
(还原剂)
离子方程式:
2FeCl3 + Cu == 2FeCl2+CuCl2
(氧化剂)
(还原剂)
溶液不显血红色
溶液中不含Fe3+
2Fe3++ Fe == 3Fe2+
金属铜也能将Fe3+还原:
实验2:在以上所得到的FeCl2和KSCN的混合
溶液中,滴加氯水(Cl2)
现象:
溶液变成血红色
结论:
原溶液中的Fe2+转变成Fe3+
反应方程式:
2FeCl2 + Cl2 == 2FeCl3
离子方程式:
2Fe2+ + Cl2 == 2Fe3+ +2Cl-
(还原剂)
(氧化剂)
小结:
还原剂
+氧化剂(Cl2)
+还原剂(Fe)
氧化剂
Fe2+
Fe3+
课堂练习:
1.将下列四种化合物溶于稀盐酸,滴加硫氰化钾溶液没有颜色变化的是: ( )
A.FeS B.Fe2O3
C.FeCl3 D.Fe2(SO4)3
A
课堂练习:
2. 硫酸亚铁溶液含有杂质硫酸铜和硫酸铁,为除去杂质,提纯硫酸亚铁,应该加入下列哪种物质 ( )
A.锌粉 B.镁粉
C.铁粉 D. 铝粉
C
