第三节 生活中两种常见的有机物
文档属性
| 名称 | 第三节 生活中两种常见的有机物 |  | |
| 格式 | zip | ||
| 文件大小 | 253.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-10-15 20:36:19 | ||
图片预览








文档简介
(共23张PPT)
第三节 生活中两种常见的有机物
第一课时 乙醇
一、乙醇(俗称酒精)的物理性质
乙醇是无色、有特殊香味的液体;乙醇易挥发;
乙醇能够溶解多种有机物和无机物,能与水以任意比互溶;
经测定,乙醇中含有碳、氢、氧三种元素, 它的分子式为C2H6O,其结构式应如何书写?
学生活动
阅读课本,归纳乙醇的物理性质
H H
H—C— C—O—H
H H
H H
H—C—O— C—H
H H
乙醇的结构式可能有两种情况:
或
结构探究:乙醇与金属钠的反应
实验3-2
金属钠的变化 气体燃烧现象 检验产物
金属钠慢慢溶解,
有气泡产生。
火焰为淡蓝色,
干燥的烧杯内壁有水珠,
石灰水没有变浑浊。
说明反应生成的 气体是H2
实验证明:1mol乙醇与足量的钠反应可以产生0.5mol氢气。
金属钠的变化 气体燃烧现象 检验产物
水
乙醇
“浮、熔、
游、响、红”
“沉、不熔、
不响”
发出淡蓝
色火焰。
安静燃烧,发出
淡蓝色火焰,
烧杯内壁有水珠
加酚酞后溶液变红,
说明有碱性物质
(NaOH)生成。
加酚酞后溶液变红,
说明有碱性物质生成;
烧杯中石灰水无明显现
象,说明无CO2生成。
比较水、乙醇与钠反应
思考:乙醇分子里的氢跟烃分子里的氢有不同吗?乙醇分子可
能是哪一种结构呢?
乙醇的结构式为:
H H
H—C— C—O—H
H H
乙醇的结构简式为:
CH3CH2OH 或 C2H5OH
—OH称为羟基
烃的衍生物:烃分子中的氢原子被其他原子或原子团所取代 而生成的一系列化合物称为烃的衍生物。
官能团:决定有机物化学特性的原子或原子团,被称为官能团。
如:卤代烃中的卤素原子、乙醇中的羟基等。
练习1:请分别写出氢氧根和羟基的化学式及电子式。
二、乙醇的化学性质
1、乙醇的分子结构
乙醇的分子结构
H—C—C—O— H
︳
H
︳
H
H
︳
H
︳
2、化学性质
(1) 与金属钠的置换反应(断键①)
2CH3 CH2OH + 2Na 2CH3CH2ONa + H2
①
②
③
④
乙醇钠
乙醇与钠反应不如水与钠反应剧烈,说明乙醇羟基中的H不如 水中的H活泼。
思考:乙醇能否与金属Ca发生反应?
2CH3CH2OH + Ca (CH3CH2O) 2Ca + H2
思考:根据乙醇的分子结构,分析乙醇的燃烧及其催化氧
化时断键的方式。
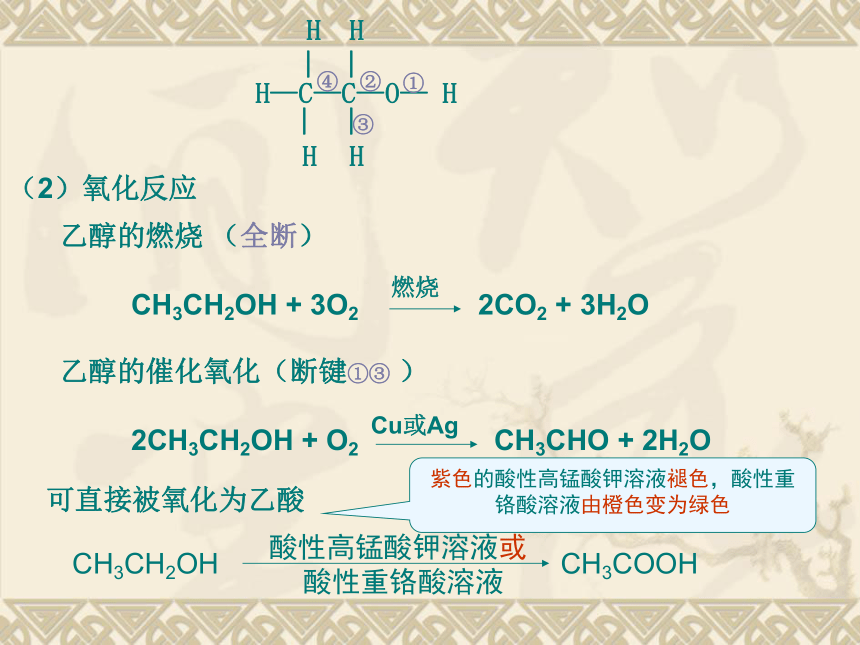
(2)氧化反应
可直接被氧化为乙酸
H—C—C—O— H
H
︳
︳
H
︳
H
H
︳
①
②
③
④
乙醇的燃烧 (全断)
CH3CH2OH + 3O2 2CO2 + 3H2O
燃烧
乙醇的催化氧化(断键①③ )
2CH3CH2OH + O2 CH3CHO + 2H2O
Cu或Ag
CH3CH2OH CH3COOH
酸性高锰酸钾溶液或
酸性重铬酸溶液
紫色的酸性高锰酸钾溶液褪色,酸性重铬酸溶液由橙色变为绿色
课堂小结
1.掌握乙醇的组成、分子结构与主要化学性质,了解
它们的主要用途。
2.理解烃的衍生物及官能团的概念。
3.通过建立乙醇分子的立体结构模型,从结构角度初步
认识乙醇的氧化反应的原理。
练习2:怎样检验酒精中是否含有水?
加入少量无水硫酸铜,若白色晶体变为蓝色,则说明 酒精中含水。
练习3:怎样把96%的酒精制成无水乙醇?
加入足量的生石灰,充分搅拌后蒸馏,即可得到无水 乙醇。
新课导入
同学们知道酒越陈越香,那原因是什么呢?
第三节 生活中两种常见的有机物
第二课时 乙酸
一、乙酸(俗称醋酸)的物理性质
学生活动
阅读课本,归纳乙酸的物理性质
物理性质:有强烈刺激性气味的无色液体;
熔点为16.6℃,当温度低于熔点时,形成无色晶体, 纯净的乙酸又称为冰醋酸; 乙酸易溶于水和乙醇。
二、乙酸的化学性质
分子式为 C2H4O2
H O
H—C— C—O—H
H
结构式为
结构简式为 CH3COOH
乙酸的官能团为—COOH,称为羧基。
过渡:乙酸具有什么化学性质呢?
1、乙酸的分子结构
比例模型
球棍模型
这利用了乙酸的什么性质?通过这个事实你能比较醋酸和碳酸的酸性强弱吗?
CaCO3 + 2CH3COOH (CH3COO)2Ca + CO2↑+ H2O
CaCO3 + 2CH3COOH
2CH3COO- + Ca2+ + CO2↑+ H2O
能,酸性: CH3COOH > H2CO3
科学探究
结论:说明乙酸具有酸性
2、化学性质
(1)乙酸的酸性
(I)能使紫色石蕊溶液变红;
(II)能与活泼的金属反应产生氢气,如
2CH3COOH + Mg (CH3COO)2Mg + H2
(III)能与碱性氧化物或碱反应生成盐和水,如
CH3COOH + NaOH CH3COONa + H2O
(IV)能与某些盐反应生成新的酸和新的盐,如
2CH3COOH + Na2CO3 2CH3COONa + H2O + CO2
乙酸是弱酸,具有酸的通性:
CH3COOH CH3COO- + H+
(2)乙酸的酯化反应
乙酸、乙醇、浓硫酸的混合物
饱和Na2CO3溶液
(2)乙酸的酯化反应`
思考:(1)浓硫酸有何作用? (2)为什么要缓慢加热? (3)饱和碳酸钠溶液有何作用? (4)导管能否插入饱和碳酸钠溶液中?
现象:液面上有透明的不溶于水的油状液体产生,有香味。
CH3COOH + HOCH2CH3 CH3COOCH2CH3 + H2O
浓硫酸
乙酸乙酯
酸与醇反应生成酯和水的反应,叫酯化反应。
催化剂、脱水剂
减少反应物的损失
吸收挥发出来的乙醇和乙酸,分离出乙酸乙酯
不能,避免倒吸
即:酸 + 醇 → 酯 + 水
同位素原子示踪法判断酯化反应的本质。
提示:如果用乙酸跟含18O的乙醇起反应,可发现生成物中乙酸乙酯分子中含有18O原子。
18
18
断键方式:酸脱羟基(-OH) 醇脱氢(H)
酯化反应又属于取代反应。是可逆反应
O
CH3—C—O—H
酸性
酯化反应
练习:
1、下列有关酯的叙述中,不正确的是( )
A、酯一般难溶于水
B、乙酸和甲醇在一定条件下也能发生酯化反应
C、酯化反应也属于取代反应
D、酯化反应中需要稀硫酸做催化剂
2、除去乙酸乙酯中含有的乙酸,最好的处理方法是( )
A、蒸馏 B、水洗后分液
C、用过量饱和碳酸钠溶液洗涤后分液
D、用过量氯化钠溶液洗涤后分液
D
C
某有机物的结构为
它最不可能具有的性质是( )。
A.能与金属钠反应放出H2
B.既能与C2H5OH发生酯化反应也能与
CH3COOH发生酯化反应
C.能发生加聚反应
D.水溶液能使紫色石蕊试纸变红
C
3、下列各组中的两对物质,都能用分液漏斗分离的是( )
A、乙酸乙酯和水、酒精和水
B、苯和水、四氯化碳和水
C、汽油和水,乙酸和乙醇
D、乙酸和水,溴水和四氯化碳
4、下列物质中,可一次性鉴别乙酸、乙醇、苯及氢氧化钡溶液的是( )
A、金属钠 B、溴水
C、碳酸钠溶液 D、紫色石蕊试液
B
C 、D
第三节 生活中两种常见的有机物
第一课时 乙醇
一、乙醇(俗称酒精)的物理性质
乙醇是无色、有特殊香味的液体;乙醇易挥发;
乙醇能够溶解多种有机物和无机物,能与水以任意比互溶;
经测定,乙醇中含有碳、氢、氧三种元素, 它的分子式为C2H6O,其结构式应如何书写?
学生活动
阅读课本,归纳乙醇的物理性质
H H
H—C— C—O—H
H H
H H
H—C—O— C—H
H H
乙醇的结构式可能有两种情况:
或
结构探究:乙醇与金属钠的反应
实验3-2
金属钠的变化 气体燃烧现象 检验产物
金属钠慢慢溶解,
有气泡产生。
火焰为淡蓝色,
干燥的烧杯内壁有水珠,
石灰水没有变浑浊。
说明反应生成的 气体是H2
实验证明:1mol乙醇与足量的钠反应可以产生0.5mol氢气。
金属钠的变化 气体燃烧现象 检验产物
水
乙醇
“浮、熔、
游、响、红”
“沉、不熔、
不响”
发出淡蓝
色火焰。
安静燃烧,发出
淡蓝色火焰,
烧杯内壁有水珠
加酚酞后溶液变红,
说明有碱性物质
(NaOH)生成。
加酚酞后溶液变红,
说明有碱性物质生成;
烧杯中石灰水无明显现
象,说明无CO2生成。
比较水、乙醇与钠反应
思考:乙醇分子里的氢跟烃分子里的氢有不同吗?乙醇分子可
能是哪一种结构呢?
乙醇的结构式为:
H H
H—C— C—O—H
H H
乙醇的结构简式为:
CH3CH2OH 或 C2H5OH
—OH称为羟基
烃的衍生物:烃分子中的氢原子被其他原子或原子团所取代 而生成的一系列化合物称为烃的衍生物。
官能团:决定有机物化学特性的原子或原子团,被称为官能团。
如:卤代烃中的卤素原子、乙醇中的羟基等。
练习1:请分别写出氢氧根和羟基的化学式及电子式。
二、乙醇的化学性质
1、乙醇的分子结构
乙醇的分子结构
H—C—C—O— H
︳
H
︳
H
H
︳
H
︳
2、化学性质
(1) 与金属钠的置换反应(断键①)
2CH3 CH2OH + 2Na 2CH3CH2ONa + H2
①
②
③
④
乙醇钠
乙醇与钠反应不如水与钠反应剧烈,说明乙醇羟基中的H不如 水中的H活泼。
思考:乙醇能否与金属Ca发生反应?
2CH3CH2OH + Ca (CH3CH2O) 2Ca + H2
思考:根据乙醇的分子结构,分析乙醇的燃烧及其催化氧
化时断键的方式。
(2)氧化反应
可直接被氧化为乙酸
H—C—C—O— H
H
︳
︳
H
︳
H
H
︳
①
②
③
④
乙醇的燃烧 (全断)
CH3CH2OH + 3O2 2CO2 + 3H2O
燃烧
乙醇的催化氧化(断键①③ )
2CH3CH2OH + O2 CH3CHO + 2H2O
Cu或Ag
CH3CH2OH CH3COOH
酸性高锰酸钾溶液或
酸性重铬酸溶液
紫色的酸性高锰酸钾溶液褪色,酸性重铬酸溶液由橙色变为绿色
课堂小结
1.掌握乙醇的组成、分子结构与主要化学性质,了解
它们的主要用途。
2.理解烃的衍生物及官能团的概念。
3.通过建立乙醇分子的立体结构模型,从结构角度初步
认识乙醇的氧化反应的原理。
练习2:怎样检验酒精中是否含有水?
加入少量无水硫酸铜,若白色晶体变为蓝色,则说明 酒精中含水。
练习3:怎样把96%的酒精制成无水乙醇?
加入足量的生石灰,充分搅拌后蒸馏,即可得到无水 乙醇。
新课导入
同学们知道酒越陈越香,那原因是什么呢?
第三节 生活中两种常见的有机物
第二课时 乙酸
一、乙酸(俗称醋酸)的物理性质
学生活动
阅读课本,归纳乙酸的物理性质
物理性质:有强烈刺激性气味的无色液体;
熔点为16.6℃,当温度低于熔点时,形成无色晶体, 纯净的乙酸又称为冰醋酸; 乙酸易溶于水和乙醇。
二、乙酸的化学性质
分子式为 C2H4O2
H O
H—C— C—O—H
H
结构式为
结构简式为 CH3COOH
乙酸的官能团为—COOH,称为羧基。
过渡:乙酸具有什么化学性质呢?
1、乙酸的分子结构
比例模型
球棍模型
这利用了乙酸的什么性质?通过这个事实你能比较醋酸和碳酸的酸性强弱吗?
CaCO3 + 2CH3COOH (CH3COO)2Ca + CO2↑+ H2O
CaCO3 + 2CH3COOH
2CH3COO- + Ca2+ + CO2↑+ H2O
能,酸性: CH3COOH > H2CO3
科学探究
结论:说明乙酸具有酸性
2、化学性质
(1)乙酸的酸性
(I)能使紫色石蕊溶液变红;
(II)能与活泼的金属反应产生氢气,如
2CH3COOH + Mg (CH3COO)2Mg + H2
(III)能与碱性氧化物或碱反应生成盐和水,如
CH3COOH + NaOH CH3COONa + H2O
(IV)能与某些盐反应生成新的酸和新的盐,如
2CH3COOH + Na2CO3 2CH3COONa + H2O + CO2
乙酸是弱酸,具有酸的通性:
CH3COOH CH3COO- + H+
(2)乙酸的酯化反应
乙酸、乙醇、浓硫酸的混合物
饱和Na2CO3溶液
(2)乙酸的酯化反应`
思考:(1)浓硫酸有何作用? (2)为什么要缓慢加热? (3)饱和碳酸钠溶液有何作用? (4)导管能否插入饱和碳酸钠溶液中?
现象:液面上有透明的不溶于水的油状液体产生,有香味。
CH3COOH + HOCH2CH3 CH3COOCH2CH3 + H2O
浓硫酸
乙酸乙酯
酸与醇反应生成酯和水的反应,叫酯化反应。
催化剂、脱水剂
减少反应物的损失
吸收挥发出来的乙醇和乙酸,分离出乙酸乙酯
不能,避免倒吸
即:酸 + 醇 → 酯 + 水
同位素原子示踪法判断酯化反应的本质。
提示:如果用乙酸跟含18O的乙醇起反应,可发现生成物中乙酸乙酯分子中含有18O原子。
18
18
断键方式:酸脱羟基(-OH) 醇脱氢(H)
酯化反应又属于取代反应。是可逆反应
O
CH3—C—O—H
酸性
酯化反应
练习:
1、下列有关酯的叙述中,不正确的是( )
A、酯一般难溶于水
B、乙酸和甲醇在一定条件下也能发生酯化反应
C、酯化反应也属于取代反应
D、酯化反应中需要稀硫酸做催化剂
2、除去乙酸乙酯中含有的乙酸,最好的处理方法是( )
A、蒸馏 B、水洗后分液
C、用过量饱和碳酸钠溶液洗涤后分液
D、用过量氯化钠溶液洗涤后分液
D
C
某有机物的结构为
它最不可能具有的性质是( )。
A.能与金属钠反应放出H2
B.既能与C2H5OH发生酯化反应也能与
CH3COOH发生酯化反应
C.能发生加聚反应
D.水溶液能使紫色石蕊试纸变红
C
3、下列各组中的两对物质,都能用分液漏斗分离的是( )
A、乙酸乙酯和水、酒精和水
B、苯和水、四氯化碳和水
C、汽油和水,乙酸和乙醇
D、乙酸和水,溴水和四氯化碳
4、下列物质中,可一次性鉴别乙酸、乙醇、苯及氢氧化钡溶液的是( )
A、金属钠 B、溴水
C、碳酸钠溶液 D、紫色石蕊试液
B
C 、D
