2020-2021学年下学期高一化学苏教版(2020)必修第二册9.2.1 反应的合理选择(21张ppt)
文档属性
| 名称 | 2020-2021学年下学期高一化学苏教版(2020)必修第二册9.2.1 反应的合理选择(21张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 10.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-07 00:00:00 | ||
图片预览






文档简介
9.2.1反应的合理选择
铁在生产生活中无处不在
富含铁元素的食品
structure of heme
血红蛋白携氧示意图
吞吐O2的“蜘蛛”
市售补铁剂
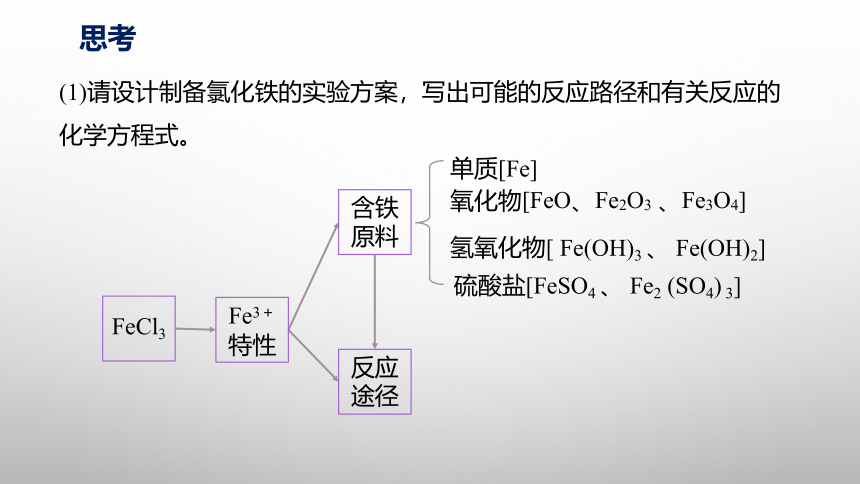
(1)请设计制备氯化铁的实验方案,写出可能的反应路径和有关反应的化学方程式。
思考
FeCl3
Fe3+特性
含铁原料
反应途径
氧化物[FeO、Fe2O3 、Fe3O4]
单质[Fe]
氢氧化物[ Fe(OH)3 、 Fe(OH)2]
硫酸盐[FeSO4 、 Fe2 (SO4) 3]
Fe
FeO
Fe2O3
Fe3O4
Fe(OH)3
Fe(OH)2
FeSO4
Fe2 (SO4) 3
FeCl 3
化合价升高,发生氧化还原反应
化合价不变,发生非氧化还原反应
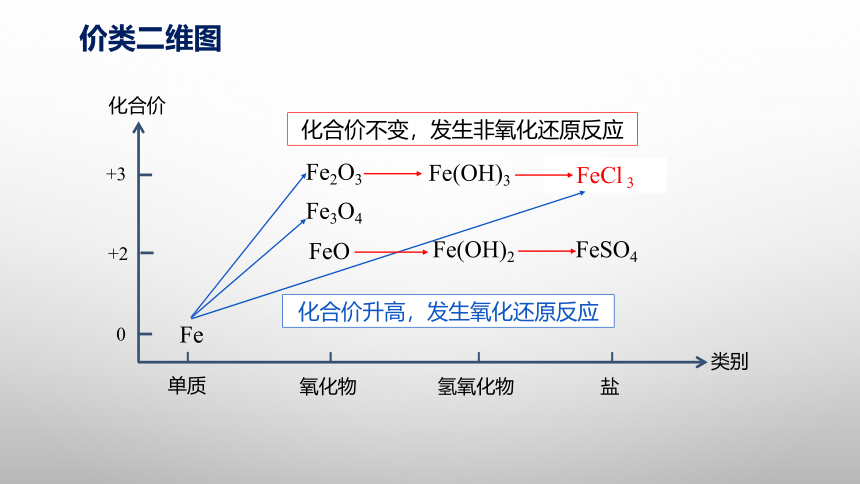
价类二维图
+3
+2
氢氧化物
盐
氧化物
单质
0
类别
化合价
根据价类二维图选择以铁屑为原料制取FeCl 3的可能反应途径
交流讨论
Fe
FeO
Fe2O3
Fe(OH)3
Fe(OH)2
FeCl3
FeCl2
1.Fe→FeCl3
3.Fe→Fe2O3→ FeCl3
2.Fe→ FeCl2→FeCl3
+3
+2
氢氧化物
盐
氧化物
单质
0
类别
化合价
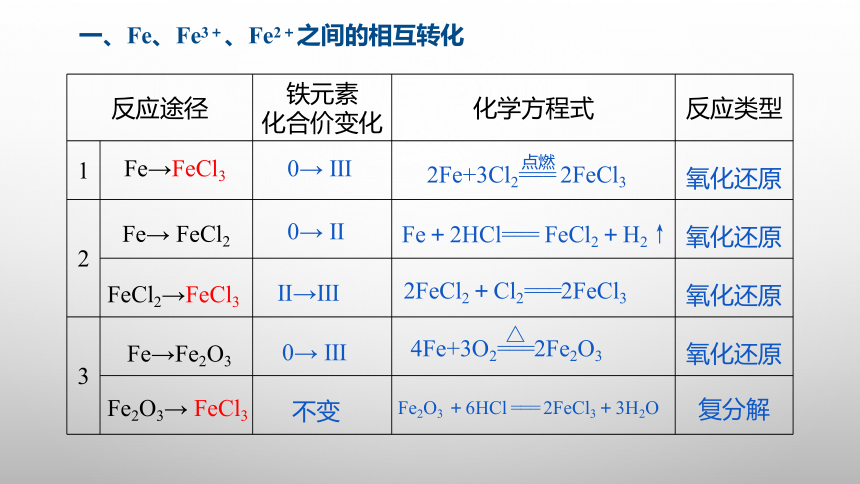
一、Fe、Fe3+、Fe2+之间的相互转化
{5940675A-B579-460E-94D1-54222C63F5DA}反应途径
铁元素
化合价变化
化学方程式
反应类型
1
2
3
Fe2O3→ FeCl3
Fe→ FeCl2
FeCl2→FeCl3
Fe→Fe2O3
0→ Ⅲ
0→ Ⅱ
Ⅱ→Ⅲ
0→ Ⅲ
不变
2Fe+3Cl2=== 2FeCl3
点燃
Fe+2HCl=== FeCl2+H2↑
2FeCl2+Cl2===2FeCl3
4Fe+3O2===2Fe2O3
△
Fe2O3 +6HCl === 2FeCl3+3H2O
氧化还原
氧化还原
氧化还原
氧化还原
复分解
Fe→FeCl3
一、Fe、Fe3+、Fe2+之间的相互转化
① Fe(0) → Fe(Ⅱ)
② Fe(0) → Fe(Ⅲ)
1.Fe在化学反应中只能失去电子体现还原性。
可被弱氧化剂(H+、S和Cu2+等) 氧化成Fe2+。
Fe+2H+===Fe2++H2↑
Fe+ Cu2+ ===Fe2++ Cu
Fe+S===FeS
△
可被强氧化剂(Cl2、HNO3等)氧化成Fe3+。
2Fe+3Cl2 === 2FeCl3
点燃
Fe+4H++NO3??=== Fe3++NO↑+2H2O
?
2.Fe2+既有氧化性又有还原性。
① Fe(Ⅱ) → Fe(Ⅲ),化合价升高,失去电子,体现还原性。
2Fe2++H2O2+2H+ === 2Fe3++2H2O
2Fe2++Cl2 === 2Fe3++2Cl-
一、Fe、Fe3+、Fe2+之间的相互转化
可被强氧化剂[Cl2、KMnO4(H+)、O2、H2O2 、 HNO3等]氧化为Fe3+。
3Fe2++4H++NO3? === 3Fe3++NO↑+2H2O
?
2.Fe2+既有氧化性又有还原性。
一、Fe、Fe3+、Fe2+之间的相互转化
②Fe(Ⅱ) → Fe(0),化合价降低,得到电子,体现氧化性。
FeO+CO === Fe+CO2
高温
可被还原剂(CO、C等)还原为Fe。
3.Fe3+在化学反应中能得到电子体现氧化性。
一、Fe、Fe3+、Fe2+之间的相互转化
① Fe(Ⅲ) → Fe(Ⅱ)
可被弱还原剂(Cu、Fe、 H2S、S2-、I-等)还原为Fe2+。
2Fe3++Fe === 3Fe2+
2Fe3++Cu === 2Fe2++Cu2+
2Fe3++2I- === 2Fe2++I2
Fe2O3 +3CO === 2Fe+3CO2
高温
② Fe(Ⅲ) → Fe(0)
可被强还原剂(Al、Zn、CO等)还原为Fe。
Fe2O3 +2Al === 2Fe+Al2O3
高温
(2)FeCl3可用作印刷电路铜板腐蚀剂(HCl—FeCl3),印刷铜制电路板的腐蚀液回收再利用一直是研究的热点。思考回答下列问题:
① 蚀刻铜板主要反应的离子方程式为___________________________,氧化剂是_______________。
②腐蚀结束后,废腐蚀液中含有的金属阳离子有__________________。
思考
2Fe3++Cu===2Fe2++Cu2+
FeCl3(或Fe3+)
Fe3+、Fe2+和Cu2+
③如何检验废腐蚀液中是否含有Fe3+?
二、Fe3+、Fe2+的性质
Fe3+
Fe2+
溶液颜色
与碱反应
氧化还原反应
检验
黄色
浅绿色
Fe(OH)2沉淀
Fe(OH)3沉淀
Fe3+→Fe2+
Fe←Fe2+→Fe3+
(1)观察溶液的颜色
(2)加OH-
(3)加KSCN溶液
(1)观察溶液的颜色
(2)加OH-,观察沉淀颜色变化
(3)加KSCN后再加氯水
FeCl3溶液
黄色褪去
无明显变化
血红色溶液
说明含Fe3+
铁粉
①
氯水
③
KSCN溶液
②
①Fe3+→Fe2+
2Fe3++Fe === 3Fe2+
②Fe2+
③Fe2+→Fe3+
(FeCl2溶液)
Fe2+与KSCN溶液无明显变化
2Fe2++Cl2 === 2Fe3++2Cl-
Fe3++3SCN-===Fe(SCN)3
血红色
三、Fe3+、Fe2+的检验
思考
(3)设计实验,实现Fe2+和Fe3+的相互转化,并证明。
① FeCl2溶液、FeCl3溶液、KSCN溶液。
②新制氯水、酸性KMnO4溶液、H2O2溶液。
③铁粉、铜粉、Vc。
相互转化
?
Fe2+
Fe3+
加氧化剂
加还原剂
课堂小结
——Fe、Fe3+、Fe2+之间的相互转化
氧化剂
S 、I2、Cu2+ H+
强氧化剂
Cl2、Br2、HNO3 、浓H2SO4
氧化剂Cl2、Br2、HNO3 、O2、浓H2SO4、H2O2、KMnO4
还原剂Fe、Cu、H2S、S2-、I-
还原剂H2、CO、C、活泼金属
还原剂H2、CO、C、活泼金属
Fe
Fe2+
Fe3+
还原性
氧化性
氧化性
——Fe3+、Fe2+的检验方法
课堂小结
Fe3+
Fe2+
检验
(1)观察溶液的颜色
(2)加OH-
(3)加KSCN溶液
(1)观察溶液的颜色
(2)加OH-,观察沉淀颜色变化
(3)加KSCN后再加氯水
随堂演练
1.为检验某FeCl2溶液是否变质可以向溶液中加入( )
A.NaOH 溶液 B.铁片
C.KSCN 溶液 D.石蕊试液
C
随堂演练
2.要证明某溶液中不含三价铁离子而可能含有亚铁离子,进行如下实验操作时最佳顺序为 ( )
①加入足量氯水 ②加入足量KMnO4 ③加入少量KSCN溶液
A.①③ B.③② C.③① D.①②③
C
铁在生产生活中无处不在
富含铁元素的食品
structure of heme
血红蛋白携氧示意图
吞吐O2的“蜘蛛”
市售补铁剂
(1)请设计制备氯化铁的实验方案,写出可能的反应路径和有关反应的化学方程式。
思考
FeCl3
Fe3+特性
含铁原料
反应途径
氧化物[FeO、Fe2O3 、Fe3O4]
单质[Fe]
氢氧化物[ Fe(OH)3 、 Fe(OH)2]
硫酸盐[FeSO4 、 Fe2 (SO4) 3]
Fe
FeO
Fe2O3
Fe3O4
Fe(OH)3
Fe(OH)2
FeSO4
Fe2 (SO4) 3
FeCl 3
化合价升高,发生氧化还原反应
化合价不变,发生非氧化还原反应
价类二维图
+3
+2
氢氧化物
盐
氧化物
单质
0
类别
化合价
根据价类二维图选择以铁屑为原料制取FeCl 3的可能反应途径
交流讨论
Fe
FeO
Fe2O3
Fe(OH)3
Fe(OH)2
FeCl3
FeCl2
1.Fe→FeCl3
3.Fe→Fe2O3→ FeCl3
2.Fe→ FeCl2→FeCl3
+3
+2
氢氧化物
盐
氧化物
单质
0
类别
化合价
一、Fe、Fe3+、Fe2+之间的相互转化
{5940675A-B579-460E-94D1-54222C63F5DA}反应途径
铁元素
化合价变化
化学方程式
反应类型
1
2
3
Fe2O3→ FeCl3
Fe→ FeCl2
FeCl2→FeCl3
Fe→Fe2O3
0→ Ⅲ
0→ Ⅱ
Ⅱ→Ⅲ
0→ Ⅲ
不变
2Fe+3Cl2=== 2FeCl3
点燃
Fe+2HCl=== FeCl2+H2↑
2FeCl2+Cl2===2FeCl3
4Fe+3O2===2Fe2O3
△
Fe2O3 +6HCl === 2FeCl3+3H2O
氧化还原
氧化还原
氧化还原
氧化还原
复分解
Fe→FeCl3
一、Fe、Fe3+、Fe2+之间的相互转化
① Fe(0) → Fe(Ⅱ)
② Fe(0) → Fe(Ⅲ)
1.Fe在化学反应中只能失去电子体现还原性。
可被弱氧化剂(H+、S和Cu2+等) 氧化成Fe2+。
Fe+2H+===Fe2++H2↑
Fe+ Cu2+ ===Fe2++ Cu
Fe+S===FeS
△
可被强氧化剂(Cl2、HNO3等)氧化成Fe3+。
2Fe+3Cl2 === 2FeCl3
点燃
Fe+4H++NO3??=== Fe3++NO↑+2H2O
?
2.Fe2+既有氧化性又有还原性。
① Fe(Ⅱ) → Fe(Ⅲ),化合价升高,失去电子,体现还原性。
2Fe2++H2O2+2H+ === 2Fe3++2H2O
2Fe2++Cl2 === 2Fe3++2Cl-
一、Fe、Fe3+、Fe2+之间的相互转化
可被强氧化剂[Cl2、KMnO4(H+)、O2、H2O2 、 HNO3等]氧化为Fe3+。
3Fe2++4H++NO3? === 3Fe3++NO↑+2H2O
?
2.Fe2+既有氧化性又有还原性。
一、Fe、Fe3+、Fe2+之间的相互转化
②Fe(Ⅱ) → Fe(0),化合价降低,得到电子,体现氧化性。
FeO+CO === Fe+CO2
高温
可被还原剂(CO、C等)还原为Fe。
3.Fe3+在化学反应中能得到电子体现氧化性。
一、Fe、Fe3+、Fe2+之间的相互转化
① Fe(Ⅲ) → Fe(Ⅱ)
可被弱还原剂(Cu、Fe、 H2S、S2-、I-等)还原为Fe2+。
2Fe3++Fe === 3Fe2+
2Fe3++Cu === 2Fe2++Cu2+
2Fe3++2I- === 2Fe2++I2
Fe2O3 +3CO === 2Fe+3CO2
高温
② Fe(Ⅲ) → Fe(0)
可被强还原剂(Al、Zn、CO等)还原为Fe。
Fe2O3 +2Al === 2Fe+Al2O3
高温
(2)FeCl3可用作印刷电路铜板腐蚀剂(HCl—FeCl3),印刷铜制电路板的腐蚀液回收再利用一直是研究的热点。思考回答下列问题:
① 蚀刻铜板主要反应的离子方程式为___________________________,氧化剂是_______________。
②腐蚀结束后,废腐蚀液中含有的金属阳离子有__________________。
思考
2Fe3++Cu===2Fe2++Cu2+
FeCl3(或Fe3+)
Fe3+、Fe2+和Cu2+
③如何检验废腐蚀液中是否含有Fe3+?
二、Fe3+、Fe2+的性质
Fe3+
Fe2+
溶液颜色
与碱反应
氧化还原反应
检验
黄色
浅绿色
Fe(OH)2沉淀
Fe(OH)3沉淀
Fe3+→Fe2+
Fe←Fe2+→Fe3+
(1)观察溶液的颜色
(2)加OH-
(3)加KSCN溶液
(1)观察溶液的颜色
(2)加OH-,观察沉淀颜色变化
(3)加KSCN后再加氯水
FeCl3溶液
黄色褪去
无明显变化
血红色溶液
说明含Fe3+
铁粉
①
氯水
③
KSCN溶液
②
①Fe3+→Fe2+
2Fe3++Fe === 3Fe2+
②Fe2+
③Fe2+→Fe3+
(FeCl2溶液)
Fe2+与KSCN溶液无明显变化
2Fe2++Cl2 === 2Fe3++2Cl-
Fe3++3SCN-===Fe(SCN)3
血红色
三、Fe3+、Fe2+的检验
思考
(3)设计实验,实现Fe2+和Fe3+的相互转化,并证明。
① FeCl2溶液、FeCl3溶液、KSCN溶液。
②新制氯水、酸性KMnO4溶液、H2O2溶液。
③铁粉、铜粉、Vc。
相互转化
?
Fe2+
Fe3+
加氧化剂
加还原剂
课堂小结
——Fe、Fe3+、Fe2+之间的相互转化
氧化剂
S 、I2、Cu2+ H+
强氧化剂
Cl2、Br2、HNO3 、浓H2SO4
氧化剂Cl2、Br2、HNO3 、O2、浓H2SO4、H2O2、KMnO4
还原剂Fe、Cu、H2S、S2-、I-
还原剂H2、CO、C、活泼金属
还原剂H2、CO、C、活泼金属
Fe
Fe2+
Fe3+
还原性
氧化性
氧化性
——Fe3+、Fe2+的检验方法
课堂小结
Fe3+
Fe2+
检验
(1)观察溶液的颜色
(2)加OH-
(3)加KSCN溶液
(1)观察溶液的颜色
(2)加OH-,观察沉淀颜色变化
(3)加KSCN后再加氯水
随堂演练
1.为检验某FeCl2溶液是否变质可以向溶液中加入( )
A.NaOH 溶液 B.铁片
C.KSCN 溶液 D.石蕊试液
C
随堂演练
2.要证明某溶液中不含三价铁离子而可能含有亚铁离子,进行如下实验操作时最佳顺序为 ( )
①加入足量氯水 ②加入足量KMnO4 ③加入少量KSCN溶液
A.①③ B.③② C.③① D.①②③
C
