2020-2021学年下学期高一化学苏教版(2020)必修第二册9.1金属的冶炼方法(24张ppt)
文档属性
| 名称 | 2020-2021学年下学期高一化学苏教版(2020)必修第二册9.1金属的冶炼方法(24张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 165.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-07 07:08:21 | ||
图片预览








文档简介
(共24张PPT)
专题9 金属与人类文明
第一单元 金属的冶炼方法
科学·技术·社会
春秋战国时代,
我国社会经济飞
跃发展的一个重
要表现,便是铁
器的应用和普及,
它是当时社会生
产力中的新因素
之一。
如何从自然界获得铁、铜单质呢?
一、金属的存在形式
1.金属的存在形式
(1)游离态:
(2)化合态:
黄铜矿(CuFeS2)
自然界以单质形式存在,如“陨铁”和金等。
自然界以化合物形式存在,如黄铜矿、赤铁矿、铝土矿等。
赤铁矿(Fe2O3)
铝土矿 (Al2O3)
陨铁
金
(3)还有一些金属以离子或矿石的形式分布于海洋中,如钠、镁、锰等。
深度思考
(1)新石器中期,在我国的河北和甘肃等地就已用自然铜来打制铜器,俄罗斯和意大利都有自然铜的矿产地。但很少听闻关于自然铁(单质铁)矿产的报道。为什么?
如图表示金属活动性顺序表中铜、锡、铁和铝元素被人类大规模开发利用的大致年限。
铁的活动性强,自然界中没有自然铁,自然铁主要存在于陨石中
深度思考
(2)根据以上金属的活动性和人类开发利用这些金属时间的数据,你发现了什么规律?
(3)找出你熟悉的2~3种金属单质,说明它们的制备方法,写出有关的化学方程式。
金属的活动性越弱,人类开发、利用它的时间越早;
金属的活动性越强,人类开发、利用它的时间越迟。
金属Na、Mg
MgCl2(熔融)=== Mg+Cl2↑
电解
2NaCl(熔融)=== 2Na+Cl2↑
电解
二、金属的冶炼
1.金属的冶炼实质
冶炼金属的实质是用还原的方法使金属化合物中的金属离子得到电子变成金属单质。
(化合态)Mn+
得电子
M(游离态)
(被还原)
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
深度思考
金属活动性逐渐减弱
(1)金属活动性不同,还原方法一样吗?
(2)金属活动顺序与金属冶炼有关系吗?
二、金属的冶炼
2.金属冶炼的方法
(1) 物理提取法:适用于极不活泼的金属的冶炼。Pt Au
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
(2)热分解法:适用于金属活动性顺序表中氢以后的金属冶炼。 Hg Ag
(3)热还原法:适用于金属活动性顺序表中部的金属冶炼。 Zn Fe Sn Pb Cu
(4)电解法:适用于钾、钠、钙、铝等活泼金属的冶炼。 K Ca Na Mg Al
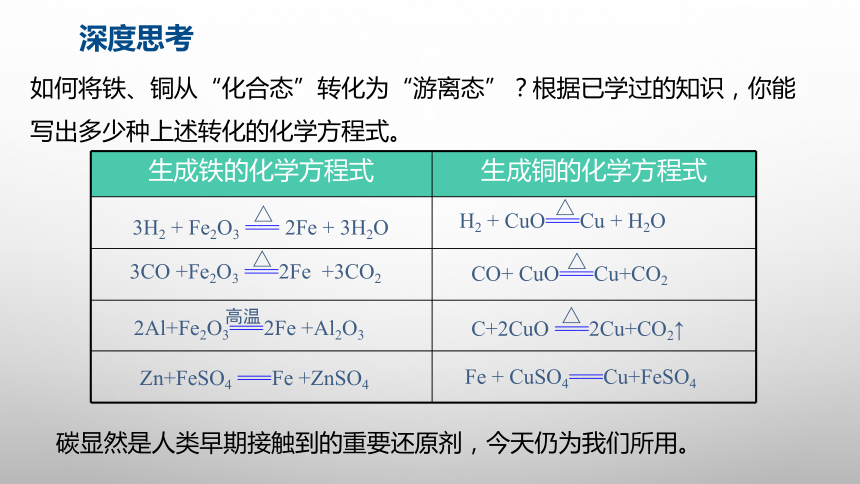
如何将铁、铜从“化合态”转化为“游离态”?根据已学过的知识,你能写出多少种上述转化的化学方程式。
生成铁的化学方程式 生成铜的化学方程式
碳显然是人类早期接触到的重要还原剂,今天仍为我们所用。
3H2 + Fe2O3 === 2Fe + 3H2O
△
3CO +Fe2O3 ===2Fe +3CO2
△
2Al+Fe2O3===2Fe +Al2O3
高温
Zn+FeSO4 ===Fe +ZnSO4
H2 + CuO===Cu + H2O
△
CO+ CuO===Cu+CO2
△
C+2CuO ===2Cu+CO2↑
△
Fe + CuSO4===Cu+FeSO4
深度思考
三、铁的冶炼——高炉炼铁
1.原料:
铁矿石、焦炭、空气、石灰石等。
2.反应原理:
(1)还原剂的产生
(2)铁矿石的还原
(3)造渣:
(炉渣的主要成分)
石灰石的作用:形成炉渣,除去铁矿石中的SiO2等杂质
C + O2===CO2
高温
C + CO2 === 2CO
高温
Fe2O3+3CO === 2Fe+3CO2
高温
CaCO3 === CaO+CO2↑
高温
SiO2+CaO === CaSiO3
高温
3.主要设备:
炼铁高炉
钢铁中的含碳量:
铁:2%~4.5%
钢:0.03%~2%
三、铁的冶炼——高炉炼铁
四、铝热反应
铝热反应放出大量的热。
2 .用途
2Al+Fe2O3 === 2Fe+Al2O3
高温
1 .反应原理
冶炼难熔金属,
如V、Cr、Mn等。
焊接钢轨
铝的活动性强于铁,可置换出铁。
拓展视野之一——铝的冶炼
铝土矿
NaOH溶液
二氧化碳
Al(OH)3
Al2O3
Al
NaAlO2溶液
①溶解
④过滤
⑤灼烧
⑥电解
②过滤
③酸化
1. 工业流程
拓展视野之一——铝的冶炼
铝土矿
NaOH溶液
二氧化碳
Al(OH)3
Al2O3
Al
NaAlO2溶液
①溶解
④过滤
⑤灼烧
⑥电解
②过滤
③酸化
矿物的溶解
Al2O3 +2NaOH === 2NaAlO2 + H2O
滤液的酸化
NaAlO2 + CO2 + 2H2O === Al(OH)3↓+ NaHCO3
灼烧
电解
电解时加入冰晶石(Na3AlF6),降低氧化铝的熔融温度。
2. 反应原理
2Al(OH)3 === Al2O3+3H2O
高温
2Al2O3 === 4Al + 3O2↑
电解
1.古老的冶炼技术
(1)火烧孔雀石炼铜
Cu2(OH) 2CO3 === 2CuO+H2O+CO2↑
△
2CuO+C=== 2Cu+CO2
△
(2)湿法炼铜
Fe + CuSO4 === Cu + FeSO4
汉代许多著作里有记载“石胆能化铁为铜”,晋葛洪《抱朴子内篇·黄白》中也有“以曾青涂铁,铁赤色如铜”的记载。
古籍中的湿法炼铜
拓展视野之二——铜的冶炼
(3)生物炼铜:
(1)高温炼铜
2.现代冶炼技术
精铜(99.95~99.98%)
粗铜
电解精炼
(2)电解精炼铜:
利用细菌将矿石分化得到铜
拓展视野之二——铜的冶炼
课堂小结
(1)金属的冶炼方法与金属活动性的关系
(2)在工业上还有一种冶炼方法叫做湿法冶金,即利用活泼金属把不活泼
金属从它的盐溶液中置换出来。
例如:CuSO4+Fe===Cu+FeSO4。
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
电解法
高温还原法
热分解法
物理提炼法
随堂练习
1.下列关于金属冶炼的说法正确的是
A.金属冶炼的本质是将化合态金属还原为游离态,冶炼方法由金属的活
动性决定
B.铜的湿法冶炼是将金属钠投入到CuSO4溶液中,从而置换出铜
C.铁通常采用高温还原法冶炼,加入石灰石的目的是除去过量的碳
D.用海水为原料制得精盐,再电解纯净的NaCl溶液可制得金属钠
√
随堂练习
2.甲图是一氧化碳与氧化铁反应的装置示意图,乙图是高炉炼铁示意图。请回答下列问题:
(1)写出甲图中硬质玻璃管内所发生反应的化学方程式:_____________________。
(2)甲图中尾气处理的方法是_______________________。
将尾气在空气中点燃
3CO+Fe2O3===2Fe+3CO2
高温
原理:玻璃管内CO还原氧化铁生成铁
CO污染环境,可点燃除去
随堂练习
2.甲图是一氧化碳与氧化铁反应的装置示意图,乙图是高炉炼铁示意图。请回答下列问题:
(3)乙图中高炉炼铁时焦炭的作用是①______________________________;
②__________________________。
(4)图中生铁出口低于炉渣出口的原因是__________________________。
产生热量(或提高炉温)
生成还原剂一氧化碳
铁水的密度大于液态炉渣的密度
焦炭燃烧时可为炼铁提供能量,在高温下C和CO2反应生成CO是炼铁的还原剂。
ρ(铁水) >ρ(液态炉渣)
随堂练习
3.工业上用铝土矿(主要成分Al2O3、Fe2O3、SiO2)提取氧化铝作冶炼铝的原料,有多种不同的操作过程。现有提取的操作过程如下所示:
(1)写出步骤①中发生反应的化学方程式:
____________________________________________________________。
(2)写出滤液(甲)中一种溶质与过量NaOH溶液反应进入滤液(乙)所发生反应的化学方程式:____________________________________________________________。
Al2O3+6HCl===2AlCl3+3H2O、Fe2O3+6HCl===2FeCl3+3H2O
AlCl3+3NaOH==Al(OH)3↓+3NaCl、Al(OH)3+NaOH==NaAlO2+2H2O
SiO2不溶于盐酸,
Al2O3、Fe2O3均可与盐酸反应
Al(OH)3可与NaOH反应
随堂练习
3.工业上用铝土矿(主要成分Al2O3、Fe2O3、SiO2)提取氧化铝作冶炼铝的原料,有多种不同的操作过程。现有提取的操作过程如下所示:
(3)写出步骤③中生成Al(OH)3沉淀的化学方程式:
____________________________________________________。
NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3
专题9 金属与人类文明
第一单元 金属的冶炼方法
科学·技术·社会
春秋战国时代,
我国社会经济飞
跃发展的一个重
要表现,便是铁
器的应用和普及,
它是当时社会生
产力中的新因素
之一。
如何从自然界获得铁、铜单质呢?
一、金属的存在形式
1.金属的存在形式
(1)游离态:
(2)化合态:
黄铜矿(CuFeS2)
自然界以单质形式存在,如“陨铁”和金等。
自然界以化合物形式存在,如黄铜矿、赤铁矿、铝土矿等。
赤铁矿(Fe2O3)
铝土矿 (Al2O3)
陨铁
金
(3)还有一些金属以离子或矿石的形式分布于海洋中,如钠、镁、锰等。
深度思考
(1)新石器中期,在我国的河北和甘肃等地就已用自然铜来打制铜器,俄罗斯和意大利都有自然铜的矿产地。但很少听闻关于自然铁(单质铁)矿产的报道。为什么?
如图表示金属活动性顺序表中铜、锡、铁和铝元素被人类大规模开发利用的大致年限。
铁的活动性强,自然界中没有自然铁,自然铁主要存在于陨石中
深度思考
(2)根据以上金属的活动性和人类开发利用这些金属时间的数据,你发现了什么规律?
(3)找出你熟悉的2~3种金属单质,说明它们的制备方法,写出有关的化学方程式。
金属的活动性越弱,人类开发、利用它的时间越早;
金属的活动性越强,人类开发、利用它的时间越迟。
金属Na、Mg
MgCl2(熔融)=== Mg+Cl2↑
电解
2NaCl(熔融)=== 2Na+Cl2↑
电解
二、金属的冶炼
1.金属的冶炼实质
冶炼金属的实质是用还原的方法使金属化合物中的金属离子得到电子变成金属单质。
(化合态)Mn+
得电子
M(游离态)
(被还原)
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
深度思考
金属活动性逐渐减弱
(1)金属活动性不同,还原方法一样吗?
(2)金属活动顺序与金属冶炼有关系吗?
二、金属的冶炼
2.金属冶炼的方法
(1) 物理提取法:适用于极不活泼的金属的冶炼。Pt Au
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
(2)热分解法:适用于金属活动性顺序表中氢以后的金属冶炼。 Hg Ag
(3)热还原法:适用于金属活动性顺序表中部的金属冶炼。 Zn Fe Sn Pb Cu
(4)电解法:适用于钾、钠、钙、铝等活泼金属的冶炼。 K Ca Na Mg Al
如何将铁、铜从“化合态”转化为“游离态”?根据已学过的知识,你能写出多少种上述转化的化学方程式。
生成铁的化学方程式 生成铜的化学方程式
碳显然是人类早期接触到的重要还原剂,今天仍为我们所用。
3H2 + Fe2O3 === 2Fe + 3H2O
△
3CO +Fe2O3 ===2Fe +3CO2
△
2Al+Fe2O3===2Fe +Al2O3
高温
Zn+FeSO4 ===Fe +ZnSO4
H2 + CuO===Cu + H2O
△
CO+ CuO===Cu+CO2
△
C+2CuO ===2Cu+CO2↑
△
Fe + CuSO4===Cu+FeSO4
深度思考
三、铁的冶炼——高炉炼铁
1.原料:
铁矿石、焦炭、空气、石灰石等。
2.反应原理:
(1)还原剂的产生
(2)铁矿石的还原
(3)造渣:
(炉渣的主要成分)
石灰石的作用:形成炉渣,除去铁矿石中的SiO2等杂质
C + O2===CO2
高温
C + CO2 === 2CO
高温
Fe2O3+3CO === 2Fe+3CO2
高温
CaCO3 === CaO+CO2↑
高温
SiO2+CaO === CaSiO3
高温
3.主要设备:
炼铁高炉
钢铁中的含碳量:
铁:2%~4.5%
钢:0.03%~2%
三、铁的冶炼——高炉炼铁
四、铝热反应
铝热反应放出大量的热。
2 .用途
2Al+Fe2O3 === 2Fe+Al2O3
高温
1 .反应原理
冶炼难熔金属,
如V、Cr、Mn等。
焊接钢轨
铝的活动性强于铁,可置换出铁。
拓展视野之一——铝的冶炼
铝土矿
NaOH溶液
二氧化碳
Al(OH)3
Al2O3
Al
NaAlO2溶液
①溶解
④过滤
⑤灼烧
⑥电解
②过滤
③酸化
1. 工业流程
拓展视野之一——铝的冶炼
铝土矿
NaOH溶液
二氧化碳
Al(OH)3
Al2O3
Al
NaAlO2溶液
①溶解
④过滤
⑤灼烧
⑥电解
②过滤
③酸化
矿物的溶解
Al2O3 +2NaOH === 2NaAlO2 + H2O
滤液的酸化
NaAlO2 + CO2 + 2H2O === Al(OH)3↓+ NaHCO3
灼烧
电解
电解时加入冰晶石(Na3AlF6),降低氧化铝的熔融温度。
2. 反应原理
2Al(OH)3 === Al2O3+3H2O
高温
2Al2O3 === 4Al + 3O2↑
电解
1.古老的冶炼技术
(1)火烧孔雀石炼铜
Cu2(OH) 2CO3 === 2CuO+H2O+CO2↑
△
2CuO+C=== 2Cu+CO2
△
(2)湿法炼铜
Fe + CuSO4 === Cu + FeSO4
汉代许多著作里有记载“石胆能化铁为铜”,晋葛洪《抱朴子内篇·黄白》中也有“以曾青涂铁,铁赤色如铜”的记载。
古籍中的湿法炼铜
拓展视野之二——铜的冶炼
(3)生物炼铜:
(1)高温炼铜
2.现代冶炼技术
精铜(99.95~99.98%)
粗铜
电解精炼
(2)电解精炼铜:
利用细菌将矿石分化得到铜
拓展视野之二——铜的冶炼
课堂小结
(1)金属的冶炼方法与金属活动性的关系
(2)在工业上还有一种冶炼方法叫做湿法冶金,即利用活泼金属把不活泼
金属从它的盐溶液中置换出来。
例如:CuSO4+Fe===Cu+FeSO4。
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
电解法
高温还原法
热分解法
物理提炼法
随堂练习
1.下列关于金属冶炼的说法正确的是
A.金属冶炼的本质是将化合态金属还原为游离态,冶炼方法由金属的活
动性决定
B.铜的湿法冶炼是将金属钠投入到CuSO4溶液中,从而置换出铜
C.铁通常采用高温还原法冶炼,加入石灰石的目的是除去过量的碳
D.用海水为原料制得精盐,再电解纯净的NaCl溶液可制得金属钠
√
随堂练习
2.甲图是一氧化碳与氧化铁反应的装置示意图,乙图是高炉炼铁示意图。请回答下列问题:
(1)写出甲图中硬质玻璃管内所发生反应的化学方程式:_____________________。
(2)甲图中尾气处理的方法是_______________________。
将尾气在空气中点燃
3CO+Fe2O3===2Fe+3CO2
高温
原理:玻璃管内CO还原氧化铁生成铁
CO污染环境,可点燃除去
随堂练习
2.甲图是一氧化碳与氧化铁反应的装置示意图,乙图是高炉炼铁示意图。请回答下列问题:
(3)乙图中高炉炼铁时焦炭的作用是①______________________________;
②__________________________。
(4)图中生铁出口低于炉渣出口的原因是__________________________。
产生热量(或提高炉温)
生成还原剂一氧化碳
铁水的密度大于液态炉渣的密度
焦炭燃烧时可为炼铁提供能量,在高温下C和CO2反应生成CO是炼铁的还原剂。
ρ(铁水) >ρ(液态炉渣)
随堂练习
3.工业上用铝土矿(主要成分Al2O3、Fe2O3、SiO2)提取氧化铝作冶炼铝的原料,有多种不同的操作过程。现有提取的操作过程如下所示:
(1)写出步骤①中发生反应的化学方程式:
____________________________________________________________。
(2)写出滤液(甲)中一种溶质与过量NaOH溶液反应进入滤液(乙)所发生反应的化学方程式:____________________________________________________________。
Al2O3+6HCl===2AlCl3+3H2O、Fe2O3+6HCl===2FeCl3+3H2O
AlCl3+3NaOH==Al(OH)3↓+3NaCl、Al(OH)3+NaOH==NaAlO2+2H2O
SiO2不溶于盐酸,
Al2O3、Fe2O3均可与盐酸反应
Al(OH)3可与NaOH反应
随堂练习
3.工业上用铝土矿(主要成分Al2O3、Fe2O3、SiO2)提取氧化铝作冶炼铝的原料,有多种不同的操作过程。现有提取的操作过程如下所示:
(3)写出步骤③中生成Al(OH)3沉淀的化学方程式:
____________________________________________________。
NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3
