h金属钠的性质与应用
图片预览





文档简介
(共17张PPT)
K 钾
Rb铷
Cs铯
Fr钫
Li 锂
Na钠
H 氢
碱金属家族中所包含的成员
锂(Li)、钠(Na)、钾(K)、
铷(Rb)、铯(Cs )、钫(Fr)
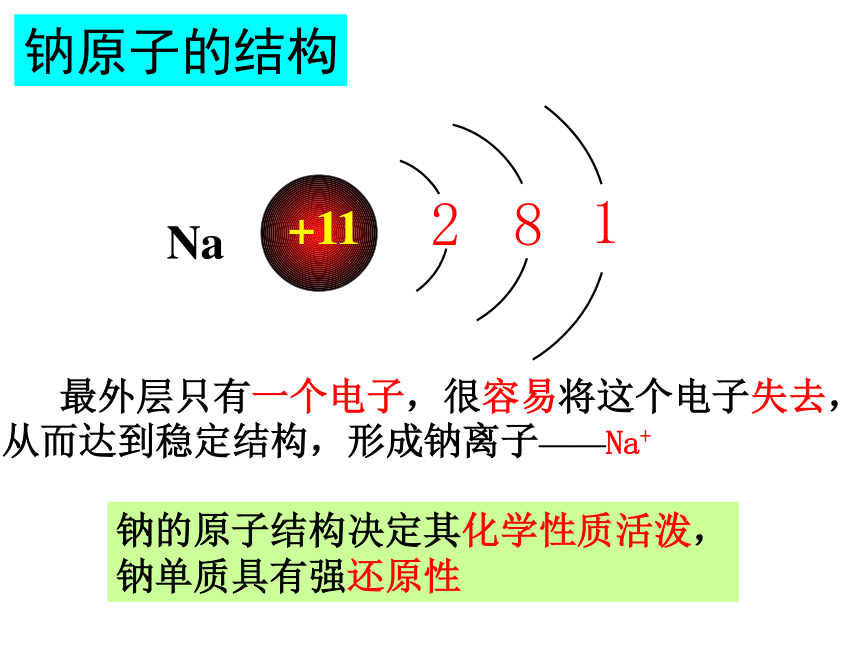
钠原子的结构
+11
最外层只有一个电子,很容易将这个电子失去,
从而达到稳定结构,形成钠离子——Na+
钠的原子结构决定其化学性质活泼,
钠单质具有强还原性
Na
观察金属钠样品
提问1:保存钠的液体是什么?
实验1:取一小块金属钠,用滤纸吸干表面的煤
油,用小刀切去一端的表层,观察表面
的颜色,将其放置在空气中,观察表面
颜色的变化
提问2:煤油的作用是什么?
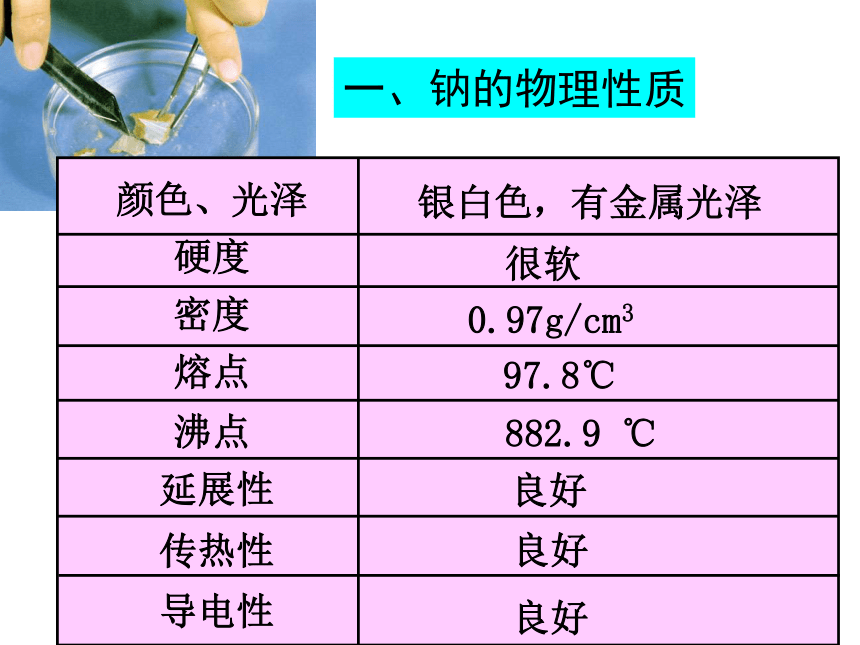
一、钠的物理性质
密度
硬度
熔点
沸点
延展性
传热性
导电性
很软
0.97g/cm3
97.8℃
882.9 ℃
颜色、光泽
银白色,有金属光泽
良好
良好
良好
二、钠的化学性质
1.与非金属单质反应
①在常温下,被空气缓慢氧化,表面变暗
4Na+O2===2Na2O
白色固体
实验2:将一小块金属钠放在蒸发皿上加热,观
察现象
②在空气中燃烧,生成淡黄色固体
2Na+O2===Na2O2
点燃
③与硫、氯气等非金属单质反应
2Na+Cl2===2NaCl
点燃
过氧化钠
2Na+S===Na2S
点燃
实验4:向一只盛有水的小烧杯中滴加几滴酚酞溶液,然后将一小块金属钠投入小烧杯中,观察实验现象
说 明
反应现象
浮在水面
钠熔成闪亮的小球
迅速游动,嘶嘶响声
酚酞变红
反应放热,钠的熔点低
钠的密度小于水
生成物溶液显碱性
反应产生气体,反应放热
2.钠与水反应
2Na + 2H2O === 2NaOH + H2↑
2Na+2H2O=2Na++2OH-+H2↑
基本反应类型:
置换反应
氧化还原反应
电子得失角度:
能量变化角度:
放热反应
[思考]:是否是一个离子反应?
思考:
钠能否与CuSO4溶液反应?产物是什么?
写出反应方程式。
钠在水溶液中不能与盐发生置换反应
钠先与水反应,生成的NaOH再与CuSO4反应
①、2Na + 2H2O === 2NaOH + H2↑
②、2NaOH+CuSO4===Na2SO4+Cu(OH)2↓
2Na+2H2O+CuSO4==Na2SO4+H2↑+Cu(OH)2↓
总方程式: ① + ②
3.与酸反应
钠与盐酸反应时,钠先与HCl反应
2Na + 2HCl === 2NaCl + H2↑
过量的钠还会与水反应
2Na + 2H2O === 2NaOH + H2↑
金属钠投入盐酸溶液中反应比水中剧烈得多
电解熔融氯化钠制取金属钠
2NaCl=====2Na+Cl2
通电
阴极:2Na++2e-=2Na
阳极:2Cl--2e-=Cl2
四、金属钠的制备
钠的存在
元素在自然界的存在方式有两种
游离态 化合态
化合态
NaCl
Na2SO4 、NaNO3 、 Na2CO3
五、钠的用途
1. 制取Na2O2等化合物
2. 钠、钾合金在常温下为液态,可用于快
中子反应堆作热交换剂
3. 作强还原剂,将有些稀有金属从它们的
卤化物中还原出来
4. 可用作电光源:高压钠灯发出的黄光
射程远,透雾能力强,常用于道路和广场
的照明
TiCl4+4Na=======Ti+4NaCl
700 ~ 8000C
1.钠着火了如何灭?
2.能否用手接触钠的固体?
3.钠能否保存在汽油或四氯化碳中?
(提示:汽油易挥发、易燃;四氯化碳的
密度比钠大)
问题探究:
Na2O2的特殊用途
拓展视野
Na2O2可用于呼吸面具中作为氧气的来源,
潜水艇在紧急情况时也可用Na2O2来供氧。这是
因为它不仅能与水起反应生成氧气,而且还能
与二氧化碳反应生成氧气。
2Na2O2 + 2H2O = 4NaOH + O2↑
2Na2O2 + 2CO2 = 2Na2CO3 + O2
这样就可以使CO2转化为O2,减少因缺氧而窒息的危险。
提高:
一小块钠暴露在空气中,发生了哪些变化?
有何现象?写出化学方程式。
Na
Na2O
NaOH
Na2CO3·10H2O
Na2CO3
O2
H2O
CO2
风化
①
②
③
④
①钠表面逐渐变暗
②固体逐渐变潮湿
③转变成白色固体
④白色固体变成白色粉末
现象
反应式
4Na+O2===2Na2O
Na2O + H2O === 2NaOH
2NaOH+CO2+9H2O=Na2CO3·10H2O
Na2CO3·10H2O=== Na2CO3
风化
K 钾
Rb铷
Cs铯
Fr钫
Li 锂
Na钠
H 氢
碱金属家族中所包含的成员
锂(Li)、钠(Na)、钾(K)、
铷(Rb)、铯(Cs )、钫(Fr)
钠原子的结构
+11
最外层只有一个电子,很容易将这个电子失去,
从而达到稳定结构,形成钠离子——Na+
钠的原子结构决定其化学性质活泼,
钠单质具有强还原性
Na
观察金属钠样品
提问1:保存钠的液体是什么?
实验1:取一小块金属钠,用滤纸吸干表面的煤
油,用小刀切去一端的表层,观察表面
的颜色,将其放置在空气中,观察表面
颜色的变化
提问2:煤油的作用是什么?
一、钠的物理性质
密度
硬度
熔点
沸点
延展性
传热性
导电性
很软
0.97g/cm3
97.8℃
882.9 ℃
颜色、光泽
银白色,有金属光泽
良好
良好
良好
二、钠的化学性质
1.与非金属单质反应
①在常温下,被空气缓慢氧化,表面变暗
4Na+O2===2Na2O
白色固体
实验2:将一小块金属钠放在蒸发皿上加热,观
察现象
②在空气中燃烧,生成淡黄色固体
2Na+O2===Na2O2
点燃
③与硫、氯气等非金属单质反应
2Na+Cl2===2NaCl
点燃
过氧化钠
2Na+S===Na2S
点燃
实验4:向一只盛有水的小烧杯中滴加几滴酚酞溶液,然后将一小块金属钠投入小烧杯中,观察实验现象
说 明
反应现象
浮在水面
钠熔成闪亮的小球
迅速游动,嘶嘶响声
酚酞变红
反应放热,钠的熔点低
钠的密度小于水
生成物溶液显碱性
反应产生气体,反应放热
2.钠与水反应
2Na + 2H2O === 2NaOH + H2↑
2Na+2H2O=2Na++2OH-+H2↑
基本反应类型:
置换反应
氧化还原反应
电子得失角度:
能量变化角度:
放热反应
[思考]:是否是一个离子反应?
思考:
钠能否与CuSO4溶液反应?产物是什么?
写出反应方程式。
钠在水溶液中不能与盐发生置换反应
钠先与水反应,生成的NaOH再与CuSO4反应
①、2Na + 2H2O === 2NaOH + H2↑
②、2NaOH+CuSO4===Na2SO4+Cu(OH)2↓
2Na+2H2O+CuSO4==Na2SO4+H2↑+Cu(OH)2↓
总方程式: ① + ②
3.与酸反应
钠与盐酸反应时,钠先与HCl反应
2Na + 2HCl === 2NaCl + H2↑
过量的钠还会与水反应
2Na + 2H2O === 2NaOH + H2↑
金属钠投入盐酸溶液中反应比水中剧烈得多
电解熔融氯化钠制取金属钠
2NaCl=====2Na+Cl2
通电
阴极:2Na++2e-=2Na
阳极:2Cl--2e-=Cl2
四、金属钠的制备
钠的存在
元素在自然界的存在方式有两种
游离态 化合态
化合态
NaCl
Na2SO4 、NaNO3 、 Na2CO3
五、钠的用途
1. 制取Na2O2等化合物
2. 钠、钾合金在常温下为液态,可用于快
中子反应堆作热交换剂
3. 作强还原剂,将有些稀有金属从它们的
卤化物中还原出来
4. 可用作电光源:高压钠灯发出的黄光
射程远,透雾能力强,常用于道路和广场
的照明
TiCl4+4Na=======Ti+4NaCl
700 ~ 8000C
1.钠着火了如何灭?
2.能否用手接触钠的固体?
3.钠能否保存在汽油或四氯化碳中?
(提示:汽油易挥发、易燃;四氯化碳的
密度比钠大)
问题探究:
Na2O2的特殊用途
拓展视野
Na2O2可用于呼吸面具中作为氧气的来源,
潜水艇在紧急情况时也可用Na2O2来供氧。这是
因为它不仅能与水起反应生成氧气,而且还能
与二氧化碳反应生成氧气。
2Na2O2 + 2H2O = 4NaOH + O2↑
2Na2O2 + 2CO2 = 2Na2CO3 + O2
这样就可以使CO2转化为O2,减少因缺氧而窒息的危险。
提高:
一小块钠暴露在空气中,发生了哪些变化?
有何现象?写出化学方程式。
Na
Na2O
NaOH
Na2CO3·10H2O
Na2CO3
O2
H2O
CO2
风化
①
②
③
④
①钠表面逐渐变暗
②固体逐渐变潮湿
③转变成白色固体
④白色固体变成白色粉末
现象
反应式
4Na+O2===2Na2O
Na2O + H2O === 2NaOH
2NaOH+CO2+9H2O=Na2CO3·10H2O
Na2CO3·10H2O=== Na2CO3
风化
