高二化学 晶体结构与性质 课件
文档属性
| 名称 | 高二化学 晶体结构与性质 课件 |

|
|
| 格式 | zip | ||
| 文件大小 | 397.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-10-16 00:00:00 | ||
图片预览









文档简介
(共39张PPT)
晶体结构与性质
晶体的概念
什么叫晶体
决定晶体物理性质的因素是什么
通过结晶过程形成的具有规则几何外形的固体叫晶体。
晶体中的微粒(分子、原子或离子)按一定的规则排列。
构成晶体微粒之间的结合力。
结合力越强,晶体的熔沸点越高,晶体的硬度越大。
构成晶体的基本微粒和作用力
阴阳离子
分子
原子
阴阳离子间以离子键结合,形成离子晶体。
分子间以分子间作用力(又称范德华力)结合,形成 分子晶体。
原子间以共价键结合,形成原子晶体。
离子晶体
什么叫离子晶体?
离子晶体的特点?
哪些物质属于离子晶体?
离子间通过离子键结合而成的晶体。
无单个分子存在;NaCl 和CsCl不是表示分子式。
熔沸点较高,硬度较大,难挥发难压缩。
水溶液或者熔融状态下均导电。
强碱、部分金属氧化物、部分盐类。
Na Cl
Cs Cl
熔 点
硬 度
分子晶体
原子晶体
上一页
Cl-
Na+
返回
NaCl
CsCl
熔点℃
沸点℃
801
645
1413
1290
请你想想
为什么NaCl的熔沸点比CsCl高?
Na+半径比Cs+ 小
Na+与Cl- 的相互作用比Cs+与Cl- 的相互作用强
Na+ 与Cs+ 均带一个单位正电荷,
阴离子均为氯离子。
NaCl晶体中的离子键较强,
NaCl晶体的熔沸点较高。
课 堂 巩 固
1.下列说法正确的是( )
A.离子晶体在固态时不能导电是因为其中没有离子.
B.离子晶体中也可能含有共价键.
C.离子晶体中一个阳离子只能与一个阴离子形成离子键.
D.离子晶体中阴离子与阳离子数总是相等的.
E.离子晶体中离子键越强,其熔沸点越高,硬度越大.
F.离子晶体中肯定含有金属阳离子。
分子晶体
什么叫分子晶体?
分子晶体的特点?
哪些物质可以形成分子晶体?
分子间通过分子间作用力结合成的晶体。
有单个分子存在;化学式就是分子式。
熔沸点较低,硬度较小,易升华。
多数非金属单质(卤素、氧气、等 )
稀有气体(如氦,氖,氩)
非金属氢化物(如氨,氯化氢)
多数非金属氧化物(如CO、SO2)等。
干冰1
图
原子晶体
离子晶体
分子间作用力(范德华力)
分子间存在作用力的事实:
由分子构成的物质,在一定条件下能发生三态变化,说明分子间存在作用力。
分子间作用力与化学键的区别:
化学键存在于原子之间(即分子之内),而分子间作用力显然是在“分子之间”。
强度:化学键的键能为120~800kJ/mol,而分子间作用力只有几到几十kJ/mol。
分子晶体
原子晶体
离子晶体
分子间作用力
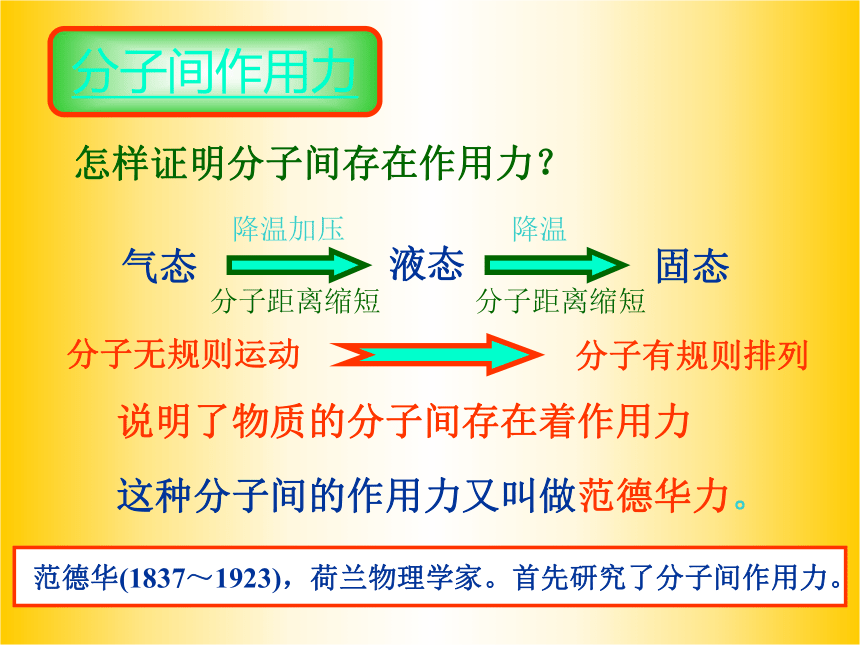
怎样证明分子间存在作用力?
说明了物质的分子间存在着作用力
这种分子间的作用力又叫做范德华力。
范德华(1837~1923),荷兰物理学家。首先研究了分子间作用力。
气态
液态
固态
降温加压
降温
分子距离缩短
分子距离缩短
分子无规则运动
分子有规则排列
范 德 华 力
化 学 键
存在于何种
微粒之间
相互作用
的强弱
分子与分子
间的作用力
相邻原子间
的相互作用
弱(几到几十
kJ/mol)
强( 120~
800 kJ/mol)
HCl分子中,H-Cl 键能为 431kJ/mol ,
HCl 分子间的作用力为 21kJ/mol 。
分子间作用力对物质的熔点、沸点有
何影响?
分子间作用力越大,克服分子间引力
使物质熔化和气化就需要更多的能量,熔
沸点越高。
分子组成和结构相似时,分子量越大,分
子间作用力越大。请解释,卤素单质熔沸点变
化规律。
氟、氯、溴、碘的单质均是分子晶体,
双原子分子,每个分子都是通过一个单键结
合而成,随着分子量的增大,分子间作用力
增大,故熔沸点递升。
分子
F2
Cl2
Br2
I2
F2
Cl2
Br2
I2
沸点
熔点
相对分子质量
0
-50
-100
-150
-200
-250
50
100
150
200
250
50
100
150
200
250
温度/℃
卤素单质的熔、沸点与
相对分子质量的关系
0
-50
-100
-150
-200
-250
50
100
150
200
250
100
300
200
400
温度/℃
相对分子质量
×
×
×
500
×
×
×
×
CF4
CCl4
CBr4
CF4
CCl4
CBr4
CI4
沸点
熔点
四卤化碳的熔沸点与
相对原子质量的关系
-150
-125
-100
-75
-50
-25
0
25
50
75
100
2
3
4
5
×
×
×
×
CH4
SiH4
GeH4
SnH4
NH3
PH3
AsH3
SbH3
HF
HCl
HBr
HI
H2O
H2S
H2Se
H2Te
沸点/℃
周期
一些氢化物的沸点
返回
点击后还有两个图
氢键的形成过程
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
氢键
共价键
返回
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
2、如果水分子之间没有氢键存在,地球上将会出现?什么面貌?
讨论:
1、冰的密度为什么比液态水的小?
原子晶体
什么叫原子晶体?
原子晶体的特点?
哪些物质属于原子晶体?
原子间通过共价键结合成的具有空间网状结构的晶体。
熔沸点很高,硬度很大,难溶于一般溶剂。
金刚石、单晶硅、碳化硅、二氧化硅等。
金刚石
熔 点
硬 度
离子晶体
分子晶体
石 墨
原 子 晶 体
如金刚石是以碳碳单键结合而成的正四面
体的空间网状结构。
键角:109°28′
键长 :1.55×10-10m
熔点: 3550℃ 沸点:4827℃
180
109 28
Si
o
下一页
共价键
109 28
返回
共价键
石墨
石墨为什么很软?
石墨的熔沸点为什么很高?
石墨为层状结构,各层之间是范德华力结合,容易滑动,所以石墨很软。
石墨各层均为平面网状结构,碳原子之间存在很强的共价键,故熔沸点很高。
所以,石墨称为混合型晶体。
知识归纳
—混合型晶体
石墨结构
本节知识归纳
晶体类型
离子晶体
分子晶体
原子晶体
离子键
范德华力
共价键
离子
分子
原子
较高
较低
很高
NaCl、CsCl
干冰
金刚石
晶体判断
课堂训练
开拓思考
微粒
结合力
熔沸点
典型实例
结束课程
一、三种晶体的比较
二、晶体类型的判断
晶体类型
微粒
结 合 力
熔沸点
硬度
实 例
离子晶体
分子晶体
原子晶体
离子
分子
原子
离子键
范德华力
共价键
较 高
较 低
很 高
较 大
较 小
很大
NaCl
CaO
干冰
碘
金刚石
二氧化硅
晶体类型的判断
从组成上判断(仅限于中学范围):
有无金属离子?(有:离子晶体)
是否属于“四种原子晶体”?
以上皆否定,则多数是分子晶体。
从性质上判断:
熔沸点和硬度;(高:原子晶体;中:离子晶体;低:分子晶体)
熔融状态的导电性。(导电:离子晶体)
开拓思考
结束课程
课堂训练
课堂练习题
下列不存在化学键的晶体是:
A.硝酸钾 B.干冰 C.石墨 D.固体氩
常温常压下的分子晶体是:
A.碘 B.水 C. 硫酸铵 D.干冰
晶体中的一个微粒周围有6个微粒,这种晶体是:
A.金刚石 B.石墨 C.干冰 D.氯化钠
结束课程
开拓思考
晶体判断
开拓思考题
仔细观察左边的示意图后,回答下列问题:
金刚石与石墨的熔点均很高,那么二者熔点是否相同?为什么?若不相同,哪种更高一些?
结束课程
课堂训练
晶体判断
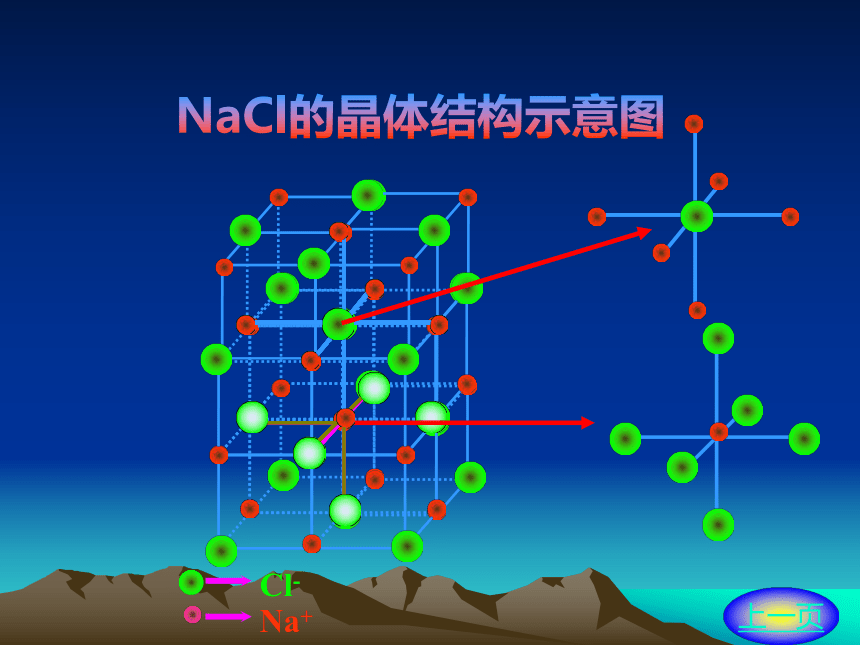
氯化钠的晶体结构
晶格扩展
回离子晶体
氯化钠的晶格扩展
回离子晶体
在NaCl晶体中,每个Na+同时吸引6个Cl-,
每个Cl- 同时吸引6个Na+。
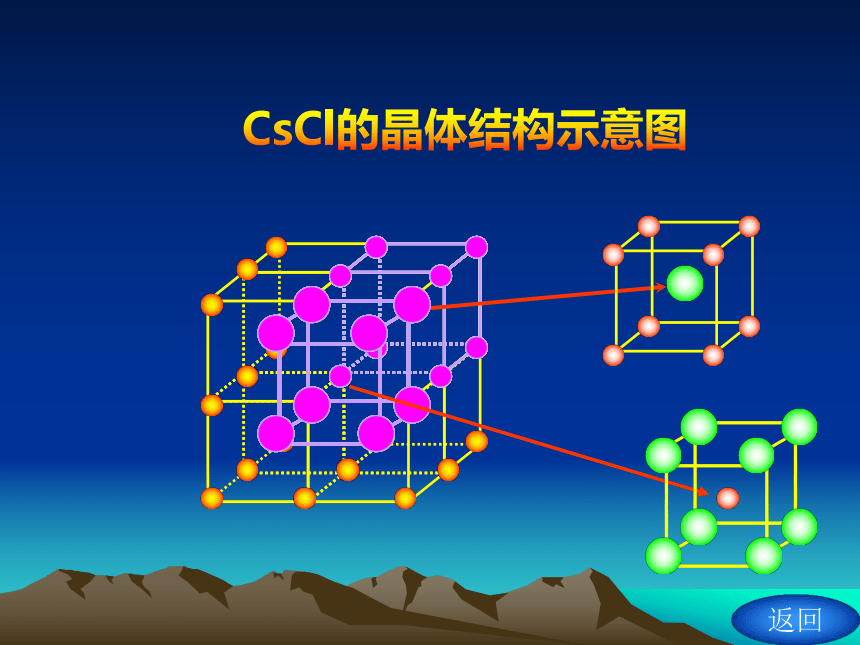
氯化铯的晶体结构
回离子晶体
在CsCl晶体中,每个Cs+同时吸引8个Cl-,
每个Cl- 同时吸引8个Cs+。
三种典型立方晶体结构
简单立方
体心立方
面心立方
结束
返回原处
O
C
范德华力
共价键
返回
干冰晶体结构示意
结束
回分子晶体
由此可见,每个二氧化碳分子周围有12个二氧化碳分子。
金刚石的晶体结构
回原子晶体
旋转模型
金刚石晶体结构模型
结束
回原子晶体
石墨的晶体结构
返回石墨
晶体的硬度
金刚石
食 盐
石 墨
结束
返回原处
晶体结构与性质
晶体的概念
什么叫晶体
决定晶体物理性质的因素是什么
通过结晶过程形成的具有规则几何外形的固体叫晶体。
晶体中的微粒(分子、原子或离子)按一定的规则排列。
构成晶体微粒之间的结合力。
结合力越强,晶体的熔沸点越高,晶体的硬度越大。
构成晶体的基本微粒和作用力
阴阳离子
分子
原子
阴阳离子间以离子键结合,形成离子晶体。
分子间以分子间作用力(又称范德华力)结合,形成 分子晶体。
原子间以共价键结合,形成原子晶体。
离子晶体
什么叫离子晶体?
离子晶体的特点?
哪些物质属于离子晶体?
离子间通过离子键结合而成的晶体。
无单个分子存在;NaCl 和CsCl不是表示分子式。
熔沸点较高,硬度较大,难挥发难压缩。
水溶液或者熔融状态下均导电。
强碱、部分金属氧化物、部分盐类。
Na Cl
Cs Cl
熔 点
硬 度
分子晶体
原子晶体
上一页
Cl-
Na+
返回
NaCl
CsCl
熔点℃
沸点℃
801
645
1413
1290
请你想想
为什么NaCl的熔沸点比CsCl高?
Na+半径比Cs+ 小
Na+与Cl- 的相互作用比Cs+与Cl- 的相互作用强
Na+ 与Cs+ 均带一个单位正电荷,
阴离子均为氯离子。
NaCl晶体中的离子键较强,
NaCl晶体的熔沸点较高。
课 堂 巩 固
1.下列说法正确的是( )
A.离子晶体在固态时不能导电是因为其中没有离子.
B.离子晶体中也可能含有共价键.
C.离子晶体中一个阳离子只能与一个阴离子形成离子键.
D.离子晶体中阴离子与阳离子数总是相等的.
E.离子晶体中离子键越强,其熔沸点越高,硬度越大.
F.离子晶体中肯定含有金属阳离子。
分子晶体
什么叫分子晶体?
分子晶体的特点?
哪些物质可以形成分子晶体?
分子间通过分子间作用力结合成的晶体。
有单个分子存在;化学式就是分子式。
熔沸点较低,硬度较小,易升华。
多数非金属单质(卤素、氧气、等 )
稀有气体(如氦,氖,氩)
非金属氢化物(如氨,氯化氢)
多数非金属氧化物(如CO、SO2)等。
干冰1
图
原子晶体
离子晶体
分子间作用力(范德华力)
分子间存在作用力的事实:
由分子构成的物质,在一定条件下能发生三态变化,说明分子间存在作用力。
分子间作用力与化学键的区别:
化学键存在于原子之间(即分子之内),而分子间作用力显然是在“分子之间”。
强度:化学键的键能为120~800kJ/mol,而分子间作用力只有几到几十kJ/mol。
分子晶体
原子晶体
离子晶体
分子间作用力
怎样证明分子间存在作用力?
说明了物质的分子间存在着作用力
这种分子间的作用力又叫做范德华力。
范德华(1837~1923),荷兰物理学家。首先研究了分子间作用力。
气态
液态
固态
降温加压
降温
分子距离缩短
分子距离缩短
分子无规则运动
分子有规则排列
范 德 华 力
化 学 键
存在于何种
微粒之间
相互作用
的强弱
分子与分子
间的作用力
相邻原子间
的相互作用
弱(几到几十
kJ/mol)
强( 120~
800 kJ/mol)
HCl分子中,H-Cl 键能为 431kJ/mol ,
HCl 分子间的作用力为 21kJ/mol 。
分子间作用力对物质的熔点、沸点有
何影响?
分子间作用力越大,克服分子间引力
使物质熔化和气化就需要更多的能量,熔
沸点越高。
分子组成和结构相似时,分子量越大,分
子间作用力越大。请解释,卤素单质熔沸点变
化规律。
氟、氯、溴、碘的单质均是分子晶体,
双原子分子,每个分子都是通过一个单键结
合而成,随着分子量的增大,分子间作用力
增大,故熔沸点递升。
分子
F2
Cl2
Br2
I2
F2
Cl2
Br2
I2
沸点
熔点
相对分子质量
0
-50
-100
-150
-200
-250
50
100
150
200
250
50
100
150
200
250
温度/℃
卤素单质的熔、沸点与
相对分子质量的关系
0
-50
-100
-150
-200
-250
50
100
150
200
250
100
300
200
400
温度/℃
相对分子质量
×
×
×
500
×
×
×
×
CF4
CCl4
CBr4
CF4
CCl4
CBr4
CI4
沸点
熔点
四卤化碳的熔沸点与
相对原子质量的关系
-150
-125
-100
-75
-50
-25
0
25
50
75
100
2
3
4
5
×
×
×
×
CH4
SiH4
GeH4
SnH4
NH3
PH3
AsH3
SbH3
HF
HCl
HBr
HI
H2O
H2S
H2Se
H2Te
沸点/℃
周期
一些氢化物的沸点
返回
点击后还有两个图
氢键的形成过程
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
氢键
共价键
返回
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
2、如果水分子之间没有氢键存在,地球上将会出现?什么面貌?
讨论:
1、冰的密度为什么比液态水的小?
原子晶体
什么叫原子晶体?
原子晶体的特点?
哪些物质属于原子晶体?
原子间通过共价键结合成的具有空间网状结构的晶体。
熔沸点很高,硬度很大,难溶于一般溶剂。
金刚石、单晶硅、碳化硅、二氧化硅等。
金刚石
熔 点
硬 度
离子晶体
分子晶体
石 墨
原 子 晶 体
如金刚石是以碳碳单键结合而成的正四面
体的空间网状结构。
键角:109°28′
键长 :1.55×10-10m
熔点: 3550℃ 沸点:4827℃
180
109 28
Si
o
下一页
共价键
109 28
返回
共价键
石墨
石墨为什么很软?
石墨的熔沸点为什么很高?
石墨为层状结构,各层之间是范德华力结合,容易滑动,所以石墨很软。
石墨各层均为平面网状结构,碳原子之间存在很强的共价键,故熔沸点很高。
所以,石墨称为混合型晶体。
知识归纳
—混合型晶体
石墨结构
本节知识归纳
晶体类型
离子晶体
分子晶体
原子晶体
离子键
范德华力
共价键
离子
分子
原子
较高
较低
很高
NaCl、CsCl
干冰
金刚石
晶体判断
课堂训练
开拓思考
微粒
结合力
熔沸点
典型实例
结束课程
一、三种晶体的比较
二、晶体类型的判断
晶体类型
微粒
结 合 力
熔沸点
硬度
实 例
离子晶体
分子晶体
原子晶体
离子
分子
原子
离子键
范德华力
共价键
较 高
较 低
很 高
较 大
较 小
很大
NaCl
CaO
干冰
碘
金刚石
二氧化硅
晶体类型的判断
从组成上判断(仅限于中学范围):
有无金属离子?(有:离子晶体)
是否属于“四种原子晶体”?
以上皆否定,则多数是分子晶体。
从性质上判断:
熔沸点和硬度;(高:原子晶体;中:离子晶体;低:分子晶体)
熔融状态的导电性。(导电:离子晶体)
开拓思考
结束课程
课堂训练
课堂练习题
下列不存在化学键的晶体是:
A.硝酸钾 B.干冰 C.石墨 D.固体氩
常温常压下的分子晶体是:
A.碘 B.水 C. 硫酸铵 D.干冰
晶体中的一个微粒周围有6个微粒,这种晶体是:
A.金刚石 B.石墨 C.干冰 D.氯化钠
结束课程
开拓思考
晶体判断
开拓思考题
仔细观察左边的示意图后,回答下列问题:
金刚石与石墨的熔点均很高,那么二者熔点是否相同?为什么?若不相同,哪种更高一些?
结束课程
课堂训练
晶体判断
氯化钠的晶体结构
晶格扩展
回离子晶体
氯化钠的晶格扩展
回离子晶体
在NaCl晶体中,每个Na+同时吸引6个Cl-,
每个Cl- 同时吸引6个Na+。
氯化铯的晶体结构
回离子晶体
在CsCl晶体中,每个Cs+同时吸引8个Cl-,
每个Cl- 同时吸引8个Cs+。
三种典型立方晶体结构
简单立方
体心立方
面心立方
结束
返回原处
O
C
范德华力
共价键
返回
干冰晶体结构示意
结束
回分子晶体
由此可见,每个二氧化碳分子周围有12个二氧化碳分子。
金刚石的晶体结构
回原子晶体
旋转模型
金刚石晶体结构模型
结束
回原子晶体
石墨的晶体结构
返回石墨
晶体的硬度
金刚石
食 盐
石 墨
结束
返回原处
