吉林省松原市乾安县第七高级中学2021-2022学年高一上学期11月第一次质量检测化学试卷(Word版含答案)
文档属性
| 名称 | 吉林省松原市乾安县第七高级中学2021-2022学年高一上学期11月第一次质量检测化学试卷(Word版含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 175.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-08 16:53:53 | ||
图片预览




文档简介
乾安县第七中学2021-2022学年高一上学期11月第一次质量检测
化学试题
一、选择题(每题只有一个选项,各3分,共计60分)
1.下列物质属于碱的是( )
A.纯碱:Na2CO3 B.烧碱:NaOH
C.生石灰:CaO D.碱式碳酸铜:Cu2(OH)2CO3
2.将下列物质按酸、碱、盐分类排列,正确的是( )
A.硫酸、纯碱、食盐 B.氢氯酸、烧碱、胆矾
C.碳酸、乙醇、醋酸钠 D.磷酸、熟石灰、苛性钾
3.下列属于酸性氧化物的是( )
A.SiO2 B.CaO
C.CO D.NaOH
4.下列说法正确的是( )
A.丁达尔效应不是胶体特有的现象,溶液与浊液也有
B.胶体与其他分散系的本质区别是有丁达尔效应,而其他分散系没有
C.胶体粒子的直径小于1 nm
D.丁达尔效应可用于鉴别胶体和溶液
5、下列叙述中正确的是( )
A.凡是盐在离子方程式中都要以离子形式表示
B.离子互换反应总是向着溶液中反应物离子浓度减小的方向进行
C.酸碱中和反应的实质是H+与OH-结合生成水,故所有的酸碱中和反应的离子方程式都可写成H+ + OH- H2O的形式
D.复分解反应必须同时具备离子反应发生的三个条件才能进行
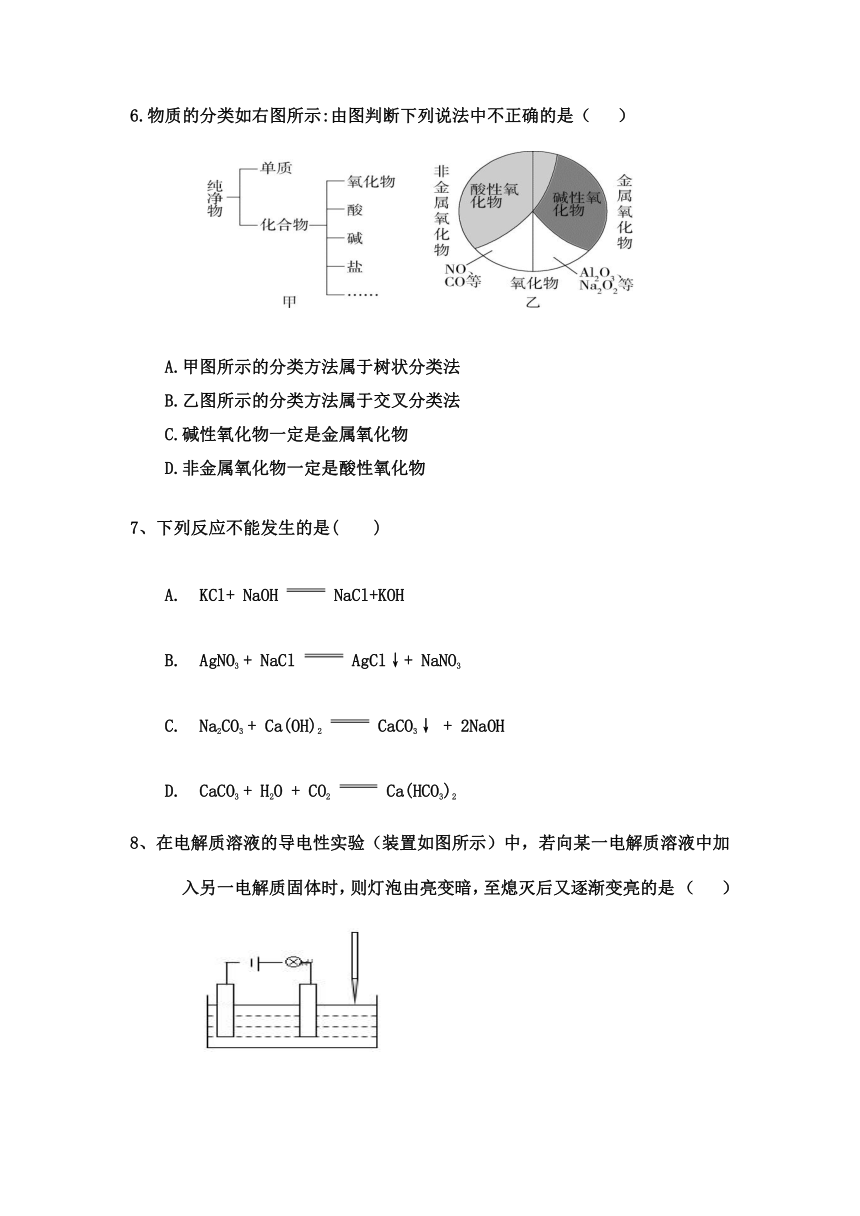
6.物质的分类如右图所示:由图判断下列说法中不正确的是( )
A.甲图所示的分类方法属于树状分类法
B.乙图所示的分类方法属于交叉分类法
C.碱性氧化物一定是金属氧化物
D.非金属氧化物一定是酸性氧化物
7、下列反应不能发生的是( )
A. KCl+ NaOH NaCl+KOH
B. AgNO3 + NaCl AgCl↓+ NaNO3
C. Na2CO3 + Ca(OH)2 CaCO3↓ + 2NaOH
D. CaCO3 + H2O + CO2 Ca(HCO3)2
8、在电解质溶液的导电性实验(装置如图所示)中,若向某一电解质溶液中加入另一电解质固体时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是 ( )
A.盐酸中慢慢加入氢氧化钠固体
B.硫酸铜溶液中慢慢加入氢氧化钡固体
C.硫酸溶液中慢慢加入氯化钡固体
D.盐酸中慢慢加入硝酸银固体
9.下列物质中的硫元素不能表现出氧化性的是( )
A.S B.Na2S C.SO2 D.H2SO4
10.下列反应不属于氧化还原反应的是( )
A.Cl2+H22HCl
B.3Fe+2O2Fe3O4
C.Fe2O3+3CO2Fe+3CO2
D.Na2O+2HCl===2NaCl+H2O
11.下列反应中有非金属元素被氧化的是( )
A.H2+CuOCu+H2O
B.2FeCl2+Cl2===2FeCl3
C.CaO+H2O===Ca(OH)2
D.Mg+2HCl===MgCl2+H2↑
12.下面三种方法都可以制得Cl2:
①MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑
②2KMnO4+16HCl(浓)===2KCl+2MnCl2+8H2O+5Cl2↑
③O2+4HCl(g)2H2O+2Cl2
这三种氧化剂的氧化性由强到弱的顺序是 ( )
A.O2 > MnO2 > KMnO4 B.KMnO4 > MnO2 > O2
C.MnO2 > KMnO4 > O2 D.O2 > KMnO4 > MnO2
13.同种物质中同一价态的同一元素部分被氧化、部分被还原的氧化还原反应是( )
A.3Br2+6KOH===5KBr+KBrO3+3H2O
B.MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑
C.2KNO32KNO2+O2↑
D.NH4NO3N2O↑+2H2O
14.对于下列反应类型的判断,不正确的是( )
A.CO2+H2O===H2CO3 化合反应;非氧化还原反应
B.Cu(OH)2CuO+H2O 分解反应;非氧化还原反应
C.Fe2O3+3CO2Fe+3CO2 置换反应;氧化还原反应
D.NaCl+AgNO3===AgCl↓+NaNO3 复分解反应;非氧化还原反应
15. 氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于阴影部分的是( )
A.Cl2+2KBr===Br2+2KCl
B.2NaHCO3Na2CO3+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O===4Fe(OH)3
D.2Na2O2+2CO2===2Na2CO3+O2
(提示:Na2O2中O元素的化合价为-1价)
16. 下列三种说法中,错误的是( )
①在NH4NO3中氮元素显+5价
②反应4FeS2+11O22Fe2O3+8SO2
中+2价铁和-2价硫都被氧化
③反应2Cu+O22CuO中Cu元素化合
价降低总数与O元素化合价升高总数一定相等
A.① B.②③
C.①③ D.①②③
17.歌曲《青花瓷》中有一句歌词“帘外芭蕉惹骤雨,门环惹铜绿”,其中的“铜绿”即是铜锈,它的化学成分是Cu2(OH)2CO3(碱式碳酸铜)。铜在潮湿的空气中生锈的化学反应为2Cu+O2+CO2+H2O===Cu2(OH)2CO3。下列有关该反应的说法正确的是( )
A.该反应不是氧化还原反应
B.该反应中氧元素和碳元素的化合价发生变化,所以是氧化还原反应
C.该反应中铜得电子,O2失电子,所以是氧化还原反应
D.该反应是氧化还原反应,变价的只有两种元素
18.铬能缓慢地溶于稀盐酸得到蓝色溶液,若通入空气则溶液颜色变绿,发生的反应有①Cr+2HCl===CrCl2+H2↑;②4CrCl2+4HCl+O2===4CrCl3+2H2O。下列叙述中正确的是( )
A.反应①②均属于置换反应
B.HCl在反应①②中均发生还原反应
C.反应①中HCl被氧化
D.溶液颜色由蓝变绿是因为Cr2+发生氧化反应
19.二氧化硒被还原后的单质硒可能成为环境污染物,通过与浓硝酸或浓硫酸反应生成SeO2以回收Se。涉及如下化学反应:
①SeO2+4KI+4HNO3===Se+2I2+4KNO3+2H2O;
②Se+2H2SO4(浓)===2SO2↑+SeO2+2H2O;
③Se+4HNO3(浓)===SeO2+4NO2↑+2H2O。
下列有关叙述错误的是( )
A.三个反应都属于氧化还原反应
B.反应①中Se被氧化,I被还原
C.反应②中转移电子数是4
D.反应③中N元素被还原
20. 已知: 2KMnO4 + 16HCl(浓 ) === 2KCl + 5Cl2↑ + 2MnCl2 + 8H2O,
下列说法正确的是( )
A.HCl发生了还原反应
B.KMnO4发生了氧化反应
C.该反应中HCl全部被氧化
D.该反应中转移的电子数为10
二、非选择题(40分)
21.(7分)有下列四组物质:
A.CaO、Na2O、CO2、CuO
B.H2、C、P、Cu
C.O2、Fe、Cu、Zn
D.H2CO3、H2O、H2SO4、HNO3
(1)以上四组物质中每组与其他三种物质的类别不同的物质依次是(填化学式)
A__ __;B_ _;C__ __;D__ __。
(2)若(1)中四种物质相互作用可生成一种新物质[碱式碳酸铜,化学式Cu2(OH)2CO3],该反应__ __(填“是”或“不是”)氧化还原反应。
(3)碱式碳酸铜可以看作是Cu(OH)2和CuCO3按照1∶1的比例组成的混合型化合物,写出它与足量盐酸反应的化学方程式:__ __。
22.(8分)下列反应:
①SO2+H2O===H2SO3
②C+H2O(g)H2+CO
③2Al+6H+===2Al3++3H2↑
④2Mg+CO22MgO+C
⑤2Na2O2+2H2O===4NaOH+O2↑
(1)上述反应中不属于氧化还原反应的有__ __(填序号,下同);反应物中H2O被还原的是__ __;还原产物为单质的是__ __。
(2)用双线桥表示反应④中电子转移的方向和数目:__ __。
23. (6分)对牙膏的探究要用到许多化学知识。
(1)牙膏中的摩擦剂可以有效的除去牙齿表面的牙垢,下表列出了两种牙膏中的摩擦剂,请在表中填写两种摩擦剂所属的物质类别:
X牙膏 Y牙膏
摩擦剂 碳酸钙 二氧化硅
摩擦剂的物质类别(指酸、碱、盐、氧化物)
(2) 根据你的推测,牙膏摩擦剂在水中的溶解性是___________________(填“易溶”或“难溶”)。
(3)X牙膏中的摩擦剂——碳酸钙可以用石灰石来制备。某学生设计了一种实验室制备碳酸钙的实验方案,其流程如下图所示:
请写出上述方案中有关反应的化学方程式:
①_____________________________________________________;
②_____________________________________________________;
③___________________________________________________
24.(7分)有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等混合而成,为检验它们,做了以下实验:
①将固体混合物溶于水中,搅拌后得无色透明溶液;
②往此溶液中滴加硝酸钡溶液,有白色沉淀产生;
③过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解。
根据上述实验事实,回答下列问题:
(1)原固体混合物中一定含有的物质是________,一定不含有的物质是________________________,可能含有的物质是________(以上空格均填写化学式)。
(2)写出步骤③中的离子方程式: ________________。
25.(12分)(1)按如图所示操作,充分反应后:
铜丝上观察到的现象是________________;发生反应的离子方程式为___________________。
(2)将表面附有铁锈(成分是Fe2O3)的铁钉放入稀硫酸中,开始反应的离子方程式是______________________________;反应片刻后,可观察到有气泡产生,产生气泡的有关离子方程式是___________。
(3)(3)人体胃液中有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,当胃酸过多时,医生通常用“小苏打片”给病人治疗。用小苏打片(NaHCO3)治疗胃酸过多的离子方程式为 __。
(4).将Na+、K+、Cu2+、H+、、Cl-、、OH-按可能大量共存于同一溶液的情况,把它们分成A、B两组,而且每组中均含两种阳离子和两种阴离子。
A组: ;
B组: 。
高一化学答案
A.选择题(每题3分,共计60分)
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20
B B A D B D A B B D A B A C D D D D B D
A.非选择题(共40分)
21. (7分)
1. A. CO2 (1分)B. Cu (1分)C. O2 (1分) D. H2O (1分)
1. 是 (1分)
1. CU2(OH)2CO3+4 HCl==2CuCl2+3H2O+CO↑2 (2分)
21. (8分)
1. .① (1分) ② (2分) ②③④ (3分)
1. . 双线桥略 (2分)
21. (6分,每空1分)
(1) .盐 氧化物
(1) .难溶
(1) .①.CaCO3=△=CaO+CO2↑
②.CaO+H2O==Ca(OH)2
③.Ca(OH)2+Na2CO3==CaCO3 ↓+2NaOH
21. (7分)
(1).Na2CO3 (1分) CuSO4 CaCl2 Na2SO4 (3分) NaCl(1分)
(1).CaCO3 + 2H+ == Ca2+ + H20 + CO↑2 (2分)
21. (12分)
(1).红色铜丝上有银白色金属附着(2分)
Cu + 2Ag+ == Cu2+ + 2Ag(2分)
(1).Fe2O3 + 6H+ == 2Fe3+ +3 H2O (2分)
Fe + 2H+ == Fe2+ + H2 ↑ (2分)
(3).HCO3- + H+ == H2O + CO2↑
(4).A组:OH-.CO32-.Na+.K+ (1分)
B组:H+ .Cu2+ .NO3-. Cl-(1分)
(A.B组答案可互换)
化学试题
一、选择题(每题只有一个选项,各3分,共计60分)
1.下列物质属于碱的是( )
A.纯碱:Na2CO3 B.烧碱:NaOH
C.生石灰:CaO D.碱式碳酸铜:Cu2(OH)2CO3
2.将下列物质按酸、碱、盐分类排列,正确的是( )
A.硫酸、纯碱、食盐 B.氢氯酸、烧碱、胆矾
C.碳酸、乙醇、醋酸钠 D.磷酸、熟石灰、苛性钾
3.下列属于酸性氧化物的是( )
A.SiO2 B.CaO
C.CO D.NaOH
4.下列说法正确的是( )
A.丁达尔效应不是胶体特有的现象,溶液与浊液也有
B.胶体与其他分散系的本质区别是有丁达尔效应,而其他分散系没有
C.胶体粒子的直径小于1 nm
D.丁达尔效应可用于鉴别胶体和溶液
5、下列叙述中正确的是( )
A.凡是盐在离子方程式中都要以离子形式表示
B.离子互换反应总是向着溶液中反应物离子浓度减小的方向进行
C.酸碱中和反应的实质是H+与OH-结合生成水,故所有的酸碱中和反应的离子方程式都可写成H+ + OH- H2O的形式
D.复分解反应必须同时具备离子反应发生的三个条件才能进行
6.物质的分类如右图所示:由图判断下列说法中不正确的是( )
A.甲图所示的分类方法属于树状分类法
B.乙图所示的分类方法属于交叉分类法
C.碱性氧化物一定是金属氧化物
D.非金属氧化物一定是酸性氧化物
7、下列反应不能发生的是( )
A. KCl+ NaOH NaCl+KOH
B. AgNO3 + NaCl AgCl↓+ NaNO3
C. Na2CO3 + Ca(OH)2 CaCO3↓ + 2NaOH
D. CaCO3 + H2O + CO2 Ca(HCO3)2
8、在电解质溶液的导电性实验(装置如图所示)中,若向某一电解质溶液中加入另一电解质固体时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是 ( )
A.盐酸中慢慢加入氢氧化钠固体
B.硫酸铜溶液中慢慢加入氢氧化钡固体
C.硫酸溶液中慢慢加入氯化钡固体
D.盐酸中慢慢加入硝酸银固体
9.下列物质中的硫元素不能表现出氧化性的是( )
A.S B.Na2S C.SO2 D.H2SO4
10.下列反应不属于氧化还原反应的是( )
A.Cl2+H22HCl
B.3Fe+2O2Fe3O4
C.Fe2O3+3CO2Fe+3CO2
D.Na2O+2HCl===2NaCl+H2O
11.下列反应中有非金属元素被氧化的是( )
A.H2+CuOCu+H2O
B.2FeCl2+Cl2===2FeCl3
C.CaO+H2O===Ca(OH)2
D.Mg+2HCl===MgCl2+H2↑
12.下面三种方法都可以制得Cl2:
①MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑
②2KMnO4+16HCl(浓)===2KCl+2MnCl2+8H2O+5Cl2↑
③O2+4HCl(g)2H2O+2Cl2
这三种氧化剂的氧化性由强到弱的顺序是 ( )
A.O2 > MnO2 > KMnO4 B.KMnO4 > MnO2 > O2
C.MnO2 > KMnO4 > O2 D.O2 > KMnO4 > MnO2
13.同种物质中同一价态的同一元素部分被氧化、部分被还原的氧化还原反应是( )
A.3Br2+6KOH===5KBr+KBrO3+3H2O
B.MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑
C.2KNO32KNO2+O2↑
D.NH4NO3N2O↑+2H2O
14.对于下列反应类型的判断,不正确的是( )
A.CO2+H2O===H2CO3 化合反应;非氧化还原反应
B.Cu(OH)2CuO+H2O 分解反应;非氧化还原反应
C.Fe2O3+3CO2Fe+3CO2 置换反应;氧化还原反应
D.NaCl+AgNO3===AgCl↓+NaNO3 复分解反应;非氧化还原反应
15. 氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于阴影部分的是( )
A.Cl2+2KBr===Br2+2KCl
B.2NaHCO3Na2CO3+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O===4Fe(OH)3
D.2Na2O2+2CO2===2Na2CO3+O2
(提示:Na2O2中O元素的化合价为-1价)
16. 下列三种说法中,错误的是( )
①在NH4NO3中氮元素显+5价
②反应4FeS2+11O22Fe2O3+8SO2
中+2价铁和-2价硫都被氧化
③反应2Cu+O22CuO中Cu元素化合
价降低总数与O元素化合价升高总数一定相等
A.① B.②③
C.①③ D.①②③
17.歌曲《青花瓷》中有一句歌词“帘外芭蕉惹骤雨,门环惹铜绿”,其中的“铜绿”即是铜锈,它的化学成分是Cu2(OH)2CO3(碱式碳酸铜)。铜在潮湿的空气中生锈的化学反应为2Cu+O2+CO2+H2O===Cu2(OH)2CO3。下列有关该反应的说法正确的是( )
A.该反应不是氧化还原反应
B.该反应中氧元素和碳元素的化合价发生变化,所以是氧化还原反应
C.该反应中铜得电子,O2失电子,所以是氧化还原反应
D.该反应是氧化还原反应,变价的只有两种元素
18.铬能缓慢地溶于稀盐酸得到蓝色溶液,若通入空气则溶液颜色变绿,发生的反应有①Cr+2HCl===CrCl2+H2↑;②4CrCl2+4HCl+O2===4CrCl3+2H2O。下列叙述中正确的是( )
A.反应①②均属于置换反应
B.HCl在反应①②中均发生还原反应
C.反应①中HCl被氧化
D.溶液颜色由蓝变绿是因为Cr2+发生氧化反应
19.二氧化硒被还原后的单质硒可能成为环境污染物,通过与浓硝酸或浓硫酸反应生成SeO2以回收Se。涉及如下化学反应:
①SeO2+4KI+4HNO3===Se+2I2+4KNO3+2H2O;
②Se+2H2SO4(浓)===2SO2↑+SeO2+2H2O;
③Se+4HNO3(浓)===SeO2+4NO2↑+2H2O。
下列有关叙述错误的是( )
A.三个反应都属于氧化还原反应
B.反应①中Se被氧化,I被还原
C.反应②中转移电子数是4
D.反应③中N元素被还原
20. 已知: 2KMnO4 + 16HCl(浓 ) === 2KCl + 5Cl2↑ + 2MnCl2 + 8H2O,
下列说法正确的是( )
A.HCl发生了还原反应
B.KMnO4发生了氧化反应
C.该反应中HCl全部被氧化
D.该反应中转移的电子数为10
二、非选择题(40分)
21.(7分)有下列四组物质:
A.CaO、Na2O、CO2、CuO
B.H2、C、P、Cu
C.O2、Fe、Cu、Zn
D.H2CO3、H2O、H2SO4、HNO3
(1)以上四组物质中每组与其他三种物质的类别不同的物质依次是(填化学式)
A__ __;B_ _;C__ __;D__ __。
(2)若(1)中四种物质相互作用可生成一种新物质[碱式碳酸铜,化学式Cu2(OH)2CO3],该反应__ __(填“是”或“不是”)氧化还原反应。
(3)碱式碳酸铜可以看作是Cu(OH)2和CuCO3按照1∶1的比例组成的混合型化合物,写出它与足量盐酸反应的化学方程式:__ __。
22.(8分)下列反应:
①SO2+H2O===H2SO3
②C+H2O(g)H2+CO
③2Al+6H+===2Al3++3H2↑
④2Mg+CO22MgO+C
⑤2Na2O2+2H2O===4NaOH+O2↑
(1)上述反应中不属于氧化还原反应的有__ __(填序号,下同);反应物中H2O被还原的是__ __;还原产物为单质的是__ __。
(2)用双线桥表示反应④中电子转移的方向和数目:__ __。
23. (6分)对牙膏的探究要用到许多化学知识。
(1)牙膏中的摩擦剂可以有效的除去牙齿表面的牙垢,下表列出了两种牙膏中的摩擦剂,请在表中填写两种摩擦剂所属的物质类别:
X牙膏 Y牙膏
摩擦剂 碳酸钙 二氧化硅
摩擦剂的物质类别(指酸、碱、盐、氧化物)
(2) 根据你的推测,牙膏摩擦剂在水中的溶解性是___________________(填“易溶”或“难溶”)。
(3)X牙膏中的摩擦剂——碳酸钙可以用石灰石来制备。某学生设计了一种实验室制备碳酸钙的实验方案,其流程如下图所示:
请写出上述方案中有关反应的化学方程式:
①_____________________________________________________;
②_____________________________________________________;
③___________________________________________________
24.(7分)有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等混合而成,为检验它们,做了以下实验:
①将固体混合物溶于水中,搅拌后得无色透明溶液;
②往此溶液中滴加硝酸钡溶液,有白色沉淀产生;
③过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解。
根据上述实验事实,回答下列问题:
(1)原固体混合物中一定含有的物质是________,一定不含有的物质是________________________,可能含有的物质是________(以上空格均填写化学式)。
(2)写出步骤③中的离子方程式: ________________。
25.(12分)(1)按如图所示操作,充分反应后:
铜丝上观察到的现象是________________;发生反应的离子方程式为___________________。
(2)将表面附有铁锈(成分是Fe2O3)的铁钉放入稀硫酸中,开始反应的离子方程式是______________________________;反应片刻后,可观察到有气泡产生,产生气泡的有关离子方程式是___________。
(3)(3)人体胃液中有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,当胃酸过多时,医生通常用“小苏打片”给病人治疗。用小苏打片(NaHCO3)治疗胃酸过多的离子方程式为 __。
(4).将Na+、K+、Cu2+、H+、、Cl-、、OH-按可能大量共存于同一溶液的情况,把它们分成A、B两组,而且每组中均含两种阳离子和两种阴离子。
A组: ;
B组: 。
高一化学答案
A.选择题(每题3分,共计60分)
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20
B B A D B D A B B D A B A C D D D D B D
A.非选择题(共40分)
21. (7分)
1. A. CO2 (1分)B. Cu (1分)C. O2 (1分) D. H2O (1分)
1. 是 (1分)
1. CU2(OH)2CO3+4 HCl==2CuCl2+3H2O+CO↑2 (2分)
21. (8分)
1. .① (1分) ② (2分) ②③④ (3分)
1. . 双线桥略 (2分)
21. (6分,每空1分)
(1) .盐 氧化物
(1) .难溶
(1) .①.CaCO3=△=CaO+CO2↑
②.CaO+H2O==Ca(OH)2
③.Ca(OH)2+Na2CO3==CaCO3 ↓+2NaOH
21. (7分)
(1).Na2CO3 (1分) CuSO4 CaCl2 Na2SO4 (3分) NaCl(1分)
(1).CaCO3 + 2H+ == Ca2+ + H20 + CO↑2 (2分)
21. (12分)
(1).红色铜丝上有银白色金属附着(2分)
Cu + 2Ag+ == Cu2+ + 2Ag(2分)
(1).Fe2O3 + 6H+ == 2Fe3+ +3 H2O (2分)
Fe + 2H+ == Fe2+ + H2 ↑ (2分)
(3).HCO3- + H+ == H2O + CO2↑
(4).A组:OH-.CO32-.Na+.K+ (1分)
B组:H+ .Cu2+ .NO3-. Cl-(1分)
(A.B组答案可互换)
同课章节目录
