人教版必修一(2019)-1.3《氧化还原反应》分层训练(含答案)
文档属性
| 名称 | 人教版必修一(2019)-1.3《氧化还原反应》分层训练(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 897.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-11 09:11:46 | ||
图片预览




文档简介
《氧化还原反应》分层训练
【基础】
1.反应3NO2+H2O2HNO3+NO中,当有6个电子发生转移时,被氧化的物质与被还原的物质的分子个数比为( )
A.1∶1 B.1∶2 C.2∶1 D.3∶1
2.在下列反应中,HCl被氧化的是( )
A.HCl+NaOHNaCl+H2O
B.Zn+2HClZnCl2+H2↑
C.4HCl(浓)+MnO2MnCl2+Cl2↑+2H2O
D.CuO+2HClCuCl2+H2O
3.下列反应属于氧化还原反应的是( )
A.CaCO3+2HClCaCl2+H2O+CO2↑
B.2NaHCO3Na2CO3+H2O+CO2↑
C.Cl2+2NaOHNaCl+NaClO+H2O
D.NaBr+AgNO3AgBr↓+NaNO3
4.氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既不是氧化剂也不是还原剂等。下列反应与C+H2O(g)CO+H2相比较,水的作用相同的是( )
A.3Fe+4H2O(g)Fe3O4+4H2
B.Na2O+H2O2NaOH
C.2F2+2H2O4HF+O2
D.3NO2+H2O2HNO3+NO
5.下列叙述正确的是( )
A.化合反应一定是氧化还原反应
B.氧化还原反应的本质是有元素化合价发生变化
C.还原剂就是反应中被还原的物质
D.氧化剂是所含元素化合价降低的物质
6.氧化还原反应与四个基本反应类型的关系如下图所示,则下列化学反应属于阴影部分的是( )
A.Cl2+2KBrBr2+2KCl
B.2NaHCO3Na2CO3+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O4Fe(OH)3
D.2Na2O2+2CO22Na2CO3+O2(提示:Na2O2中的氧元素显-1价)
7.根据下列反应的离子方程式:①2Fe3++2I-2Fe2++I2;②Br2+2Fe2+2Br-+2Fe3+,可判断各物质的氧化性由强到弱的顺序是( )
A.Fe3+、Br2、I2 B.Fe3+、I2、Br2
C.Br2、Fe3+、I2 D.Br2、I2、Fe3+
8.服用含硒元素(Se)的化合物亚硒酸钠(Na2SeO3),能消除人体内的活性氧,由此推断Na2SeO3的作用是 ( )
A.做还原剂
B.做氧化剂
C.既做氧化剂又做还原剂
D.既不做氧化剂又不做还原剂
9.我们生活在千变万化的物质世界里。下列变化中,没有发生氧化还原反应的是( )
10.下列物质间的转化一定需要加入氧化剂才能实现的是( )
A.C→CO2 B.H2O2→O2
C.SO2→S D.KMnO4→MnO2
吸入人体内的氧有2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀手”,
11.下列变化过程中,属于氧化反应的是( )
A.MnO2→Mn2+ B.CuO→CuCl2
C.Ag+→Ag2O D.Sn2+→Sn4+
12.用碱液吸收工业制硝酸尾气的化学方程式为NO+NO2+2NaOH2NaNO2+H2O,下列说法正确的是 ( )
A.NaNO2既是氧化产物又是还原产物
B.NaNO2既是氧化剂又是还原剂
C.反应中无元素化合价的变化
D.H2O是还原产物
13.(双选)田径比赛上使用的发令枪所用“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白烟。撞击时发生反应的化学方程式为5KClO3+6P3P2O5+5KCl,则下列有关叙述错误的是( )
A.上述反应中Cl的化合价由+5价变为-1价
B.P2O5是P被还原后所得的产物
C.该反应的氧化剂与还原剂的质量之比为5∶6
D.上述反应中消耗3个P时,转移15个e-
14.过氧化氢(H2O2)可作为采矿业的废液消毒剂,如消除采矿废液中有剧毒的氰化钾(KCN,其中N元素为-3价),化学方程式为KCN+H2O2+H2OA+NH3↑(已配平),请回答下列问题:
(1)生成物A的化学式是 。
(2)该反应是否是氧化还原反应 (填“是”或“不是”)。若是,请指出被还原的元素;若不是,请说明理由: 。
15.某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。
已知该反应中H2O2只发生如下过程:H2O2O2。
(1)该反应中的还原剂是 。
(2)该反应中,发生还原反应的过程是 → 。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目。
。
【提升】
1.照明弹内部有一个特别的照明装置,里面装着照明剂。它包含金属可燃物、氧化剂和黏合剂等数种物质。金属可燃物主要用镁粉和铝粉制成。镁粉和铝粉燃烧时,能产生几千度的高温、发射出耀眼的光芒。镁粉不仅可以在空气中燃烧,也可以在CO2中燃烧,反应的化学方程式为CO2+2MgC+2MgO,该反应属于( )
①化合反应 ②分解反应 ③置换反应 ④复分解反应
⑤氧化还原反应 ⑥离子反应 ⑦非氧化还原反应
A.①③⑦ B.②③⑥
C.③⑤ D.④⑥
2.下列反应中,氯元素全部被氧化的是( )
A.2P+3Cl22PCl3
B.2NaCl2Na+Cl2↑
C.NaOH+HClNaCl+H2O
D.2Cl2+2Ca(OH)2CaCl2+Ca(ClO)2+2H2O
3.下列叙述正确的是( )
A.元素的单质一定由氧化或还原该元素的化合物制得
B.在化学反应中,得电子越多的氧化剂,其氧化性就越强
C.阳离子只能得到电子被还原,阴离子只能失去电子被氧化
D.含有最高价元素的化合物不一定具有很强的氧化性
4.已知2M+5S2-+16H+2M2++5S↓+8H2O,则M中的x的值为( )
A.1 B.2 C.3 D.4
5.现有下列几个离子反应:
①Cr2+14H++6Cl-2Cr3++3Cl2↑+7H2O
②2Fe2++Cl22Fe3++2Cl-
③2Fe3++SO2+2H2O2Fe2++S+4H+
下列有关性质的比较中正确的是( )
A.氧化性:Cr2>Cl2>Fe3+
B.氧化性:Cl2>Fe3+>Cr2
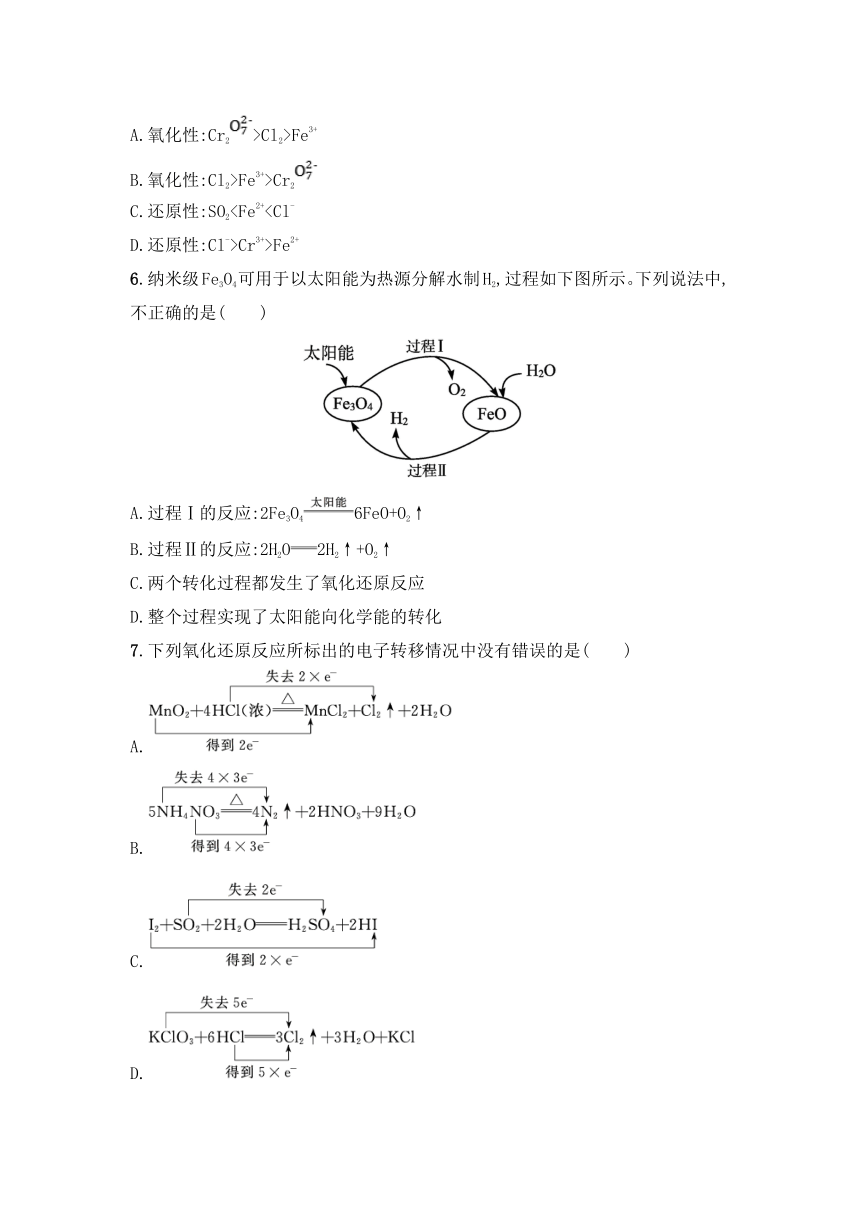
C.还原性:SO2D.还原性:Cl->Cr3+>Fe2+
6.纳米级Fe3O4可用于以太阳能为热源分解水制H2,过程如下图所示。下列说法中,不正确的是( )
A.过程Ⅰ的反应:2Fe3O46FeO+O2↑
B.过程Ⅱ的反应:2H2O2H2↑+O2↑
C.两个转化过程都发生了氧化还原反应
D.整个过程实现了太阳能向化学能的转化
7.下列氧化还原反应所标出的电子转移情况中没有错误的是( )
A.
B.
C.
D.
8.(双选)已知在相同条件下,下列几种微粒的还原性强弱顺序为Cl-A.2Fe3++SO2+2H2OS+4H++2Fe2+
B.2Br-+S+4H+SO2+Br2+2H2O
C.2Fe2++2Br-+2Cl22Fe3++Br2+4Cl-
D.Fe3++2I-Fe2++I2
9.(双选)我国“四大发明”在人类发展史上起到了非常重要的作用,其中黑火药的爆炸反应为2KNO3+S+3CK2S+N2↑+3CO2↑,该反应中被还原的元素是 ( )
A.C B.N C.S D.O
10.(双选)硫酸亚铁煅烧反应为2FeSO4SO2+Fe2O3+SO3,下列有关说法正确的是( )
A.生成一分子SO2转移2个电子
B.FeSO4中铁元素被还原
C.SO3是氧化产物
D.该反应中FeSO4既是氧化剂,又是还原剂
11.(双选)(2020北京顺义期末,改编)为了防止钢铁零件生锈,常采用化学处理使钢铁零件表面生成Fe3O4的致密保护层——“发蓝”。化学处理过程中其中一步的反应为3Fe+NaNO2+5NaOH3Na2FeO2+H2O+NH3↑。下列叙述不正确的是( )
A.上述反应涉及的物质中,Fe的还原性最强
B.Na2FeO2中Fe的化合价为+3价
C.上述反应中,铁是还原剂,NaNO2和NaOH是氧化剂
D.N的氧化性大于Fe的氧化性
12.氟利昂在常温下都是无色气体或易挥发液体,常用于制冷剂,但由于二氯二氟甲烷等CFC类制冷剂破坏大气臭氧层,已限制使用。F2用于合成氟利昂等冷却剂,化学历史上首次用化学方法制得F2的三步反应如下:
①KMnO4+KF+H2O2+HFK2MnF6+ +H2O
②SbCl5+5HFSbF5+5HCl
③2K2MnF6+4SbF54KSbF6+2MnF3+F2↑
请根据以上信息回答下列问题:
(1)反应①中空格上应填物质的化学式为 。
(2)反应②是否为氧化还原反应 (填“是”“否”或“无法确定”)。
(3)反应③中的氧化剂为 ,被氧化的元素为 。
13.化学反应按照不同的分类方法,可以分为化合反应、分解反应、置换反应、复分解反应,或者分为氧化还原反应和非氧化还原反应。有下列一组反应:
①CO2+C2CO
②Cu2(OH)2CO32CuO+H2O+CO2↑
③2NaOH+Cl2NaCl+NaClO+H2O
④2CO+O22CO2
⑤3Fe+4H2O(g)Fe3O4+4H2
⑥CuO+COCu+CO2
⑦4NH3+3O22N2+6H2O
⑧2H2O2H2↑+O2↑
⑨2Al+2NaOH+2H2O2NaAlO2+3H2↑
⑩SO2+H2OH2SO3
H2O2+SO22H++S
(1)其中属于化合反应的有 ,属于置换反应的有 。
(2)在化学反应前后元素的化合价没有变化的是 。
(3)上述反应中,既是分解反应又是氧化还原反应的是 。
(4)上述反应中,既是溶液中的离子反应,又是氧化还原反应的是 。
(5)根据你的理解,氧化还原反应的实质是 。
A.分子中的原子重新组合
B.氧的得失
C.电子的得失或共用电子对的偏移
D.元素化合价的改变
【创优】
1.饮用水中的N对人类健康会产生危害,为了降低饮用水中N的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将N还原为N2,其化学方程式为10Al+6NaNO3+4NaOH10NaAlO2+3N2↑+2H2O。
请回答下列问题:
(1)上述反应中, 元素的化合价升高,则该元素的原子 (填“得到”或“失去”)电子;而 元素的化合价降低,则该元素的原子被 (填“氧化”或“还原”)。
(2)用双线桥法表示出反应中电子转移的方向和数目。
2.凡是养鱼的人都知道一种很不错的消毒剂,这就是被称为当今第四代消毒产品的二氧化氯。其属于A1级别安全高效消毒剂之一,并且可以在极低的浓度下对病菌有杀灭作用,功效显而易见。
KClO3和浓盐酸在一定温度下反应生成黄绿色的易爆物二氧化氯。其变化可表述为
KClO3+ HCl(浓) KCl+ ClO2↑+ Cl2↑+
(1)请完成该化学方程式并配平(未知物化学式和系数填入框内)。
(2)浓盐酸在反应中显示出来的性质是 (填序号)。
①只有还原性 ②还原性和酸性 ③只有氧化性
④氧化性和酸性
(3)产生1分子Cl2,转移的电子为 个。
(4)ClO2具有很强的氧化性,因此常被用作消毒剂,其消毒效率(以单位质量得到的电子数表示)是Cl2的 倍(保留小数点后两位)。
参考答案:
【基础】
1.C
2.C
3.C
4.A
5.D
6.D
7.C
8.A
9.C
10.A
11.D
12.A
13.BC
14.
(1)KHCO3
(2)是 氧元素的化合价由-1价降为-2价,被还原
15.
(1)H2O2 (2)H2CrO4 Cr(OH)3
(3)
【提升】
1.C
2.B
3.D
4.A
5.A
6.B
7.A
8.BD
9.BC
10.AD
11.BC
12.
(1)O2 (2)否 (3)K2MnF6 F
13.
(1)①④⑩ ⑤⑦ (2)②⑩ (3)⑧ (4)③⑨ (5)C
【创优】
1.
(1)铝 失去 氮 还原
(2)+2H2O
2.
(1)2 4 2 2 1 2H2O
(2)② (3)2 (4)2.63
【基础】
1.反应3NO2+H2O2HNO3+NO中,当有6个电子发生转移时,被氧化的物质与被还原的物质的分子个数比为( )
A.1∶1 B.1∶2 C.2∶1 D.3∶1
2.在下列反应中,HCl被氧化的是( )
A.HCl+NaOHNaCl+H2O
B.Zn+2HClZnCl2+H2↑
C.4HCl(浓)+MnO2MnCl2+Cl2↑+2H2O
D.CuO+2HClCuCl2+H2O
3.下列反应属于氧化还原反应的是( )
A.CaCO3+2HClCaCl2+H2O+CO2↑
B.2NaHCO3Na2CO3+H2O+CO2↑
C.Cl2+2NaOHNaCl+NaClO+H2O
D.NaBr+AgNO3AgBr↓+NaNO3
4.氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既不是氧化剂也不是还原剂等。下列反应与C+H2O(g)CO+H2相比较,水的作用相同的是( )
A.3Fe+4H2O(g)Fe3O4+4H2
B.Na2O+H2O2NaOH
C.2F2+2H2O4HF+O2
D.3NO2+H2O2HNO3+NO
5.下列叙述正确的是( )
A.化合反应一定是氧化还原反应
B.氧化还原反应的本质是有元素化合价发生变化
C.还原剂就是反应中被还原的物质
D.氧化剂是所含元素化合价降低的物质
6.氧化还原反应与四个基本反应类型的关系如下图所示,则下列化学反应属于阴影部分的是( )
A.Cl2+2KBrBr2+2KCl
B.2NaHCO3Na2CO3+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O4Fe(OH)3
D.2Na2O2+2CO22Na2CO3+O2(提示:Na2O2中的氧元素显-1价)
7.根据下列反应的离子方程式:①2Fe3++2I-2Fe2++I2;②Br2+2Fe2+2Br-+2Fe3+,可判断各物质的氧化性由强到弱的顺序是( )
A.Fe3+、Br2、I2 B.Fe3+、I2、Br2
C.Br2、Fe3+、I2 D.Br2、I2、Fe3+
8.服用含硒元素(Se)的化合物亚硒酸钠(Na2SeO3),能消除人体内的活性氧,由此推断Na2SeO3的作用是 ( )
A.做还原剂
B.做氧化剂
C.既做氧化剂又做还原剂
D.既不做氧化剂又不做还原剂
9.我们生活在千变万化的物质世界里。下列变化中,没有发生氧化还原反应的是( )
10.下列物质间的转化一定需要加入氧化剂才能实现的是( )
A.C→CO2 B.H2O2→O2
C.SO2→S D.KMnO4→MnO2
吸入人体内的氧有2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀手”,
11.下列变化过程中,属于氧化反应的是( )
A.MnO2→Mn2+ B.CuO→CuCl2
C.Ag+→Ag2O D.Sn2+→Sn4+
12.用碱液吸收工业制硝酸尾气的化学方程式为NO+NO2+2NaOH2NaNO2+H2O,下列说法正确的是 ( )
A.NaNO2既是氧化产物又是还原产物
B.NaNO2既是氧化剂又是还原剂
C.反应中无元素化合价的变化
D.H2O是还原产物
13.(双选)田径比赛上使用的发令枪所用“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白烟。撞击时发生反应的化学方程式为5KClO3+6P3P2O5+5KCl,则下列有关叙述错误的是( )
A.上述反应中Cl的化合价由+5价变为-1价
B.P2O5是P被还原后所得的产物
C.该反应的氧化剂与还原剂的质量之比为5∶6
D.上述反应中消耗3个P时,转移15个e-
14.过氧化氢(H2O2)可作为采矿业的废液消毒剂,如消除采矿废液中有剧毒的氰化钾(KCN,其中N元素为-3价),化学方程式为KCN+H2O2+H2OA+NH3↑(已配平),请回答下列问题:
(1)生成物A的化学式是 。
(2)该反应是否是氧化还原反应 (填“是”或“不是”)。若是,请指出被还原的元素;若不是,请说明理由: 。
15.某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。
已知该反应中H2O2只发生如下过程:H2O2O2。
(1)该反应中的还原剂是 。
(2)该反应中,发生还原反应的过程是 → 。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目。
。
【提升】
1.照明弹内部有一个特别的照明装置,里面装着照明剂。它包含金属可燃物、氧化剂和黏合剂等数种物质。金属可燃物主要用镁粉和铝粉制成。镁粉和铝粉燃烧时,能产生几千度的高温、发射出耀眼的光芒。镁粉不仅可以在空气中燃烧,也可以在CO2中燃烧,反应的化学方程式为CO2+2MgC+2MgO,该反应属于( )
①化合反应 ②分解反应 ③置换反应 ④复分解反应
⑤氧化还原反应 ⑥离子反应 ⑦非氧化还原反应
A.①③⑦ B.②③⑥
C.③⑤ D.④⑥
2.下列反应中,氯元素全部被氧化的是( )
A.2P+3Cl22PCl3
B.2NaCl2Na+Cl2↑
C.NaOH+HClNaCl+H2O
D.2Cl2+2Ca(OH)2CaCl2+Ca(ClO)2+2H2O
3.下列叙述正确的是( )
A.元素的单质一定由氧化或还原该元素的化合物制得
B.在化学反应中,得电子越多的氧化剂,其氧化性就越强
C.阳离子只能得到电子被还原,阴离子只能失去电子被氧化
D.含有最高价元素的化合物不一定具有很强的氧化性
4.已知2M+5S2-+16H+2M2++5S↓+8H2O,则M中的x的值为( )
A.1 B.2 C.3 D.4
5.现有下列几个离子反应:
①Cr2+14H++6Cl-2Cr3++3Cl2↑+7H2O
②2Fe2++Cl22Fe3++2Cl-
③2Fe3++SO2+2H2O2Fe2++S+4H+
下列有关性质的比较中正确的是( )
A.氧化性:Cr2>Cl2>Fe3+
B.氧化性:Cl2>Fe3+>Cr2
C.还原性:SO2
6.纳米级Fe3O4可用于以太阳能为热源分解水制H2,过程如下图所示。下列说法中,不正确的是( )
A.过程Ⅰ的反应:2Fe3O46FeO+O2↑
B.过程Ⅱ的反应:2H2O2H2↑+O2↑
C.两个转化过程都发生了氧化还原反应
D.整个过程实现了太阳能向化学能的转化
7.下列氧化还原反应所标出的电子转移情况中没有错误的是( )
A.
B.
C.
D.
8.(双选)已知在相同条件下,下列几种微粒的还原性强弱顺序为Cl-
B.2Br-+S+4H+SO2+Br2+2H2O
C.2Fe2++2Br-+2Cl22Fe3++Br2+4Cl-
D.Fe3++2I-Fe2++I2
9.(双选)我国“四大发明”在人类发展史上起到了非常重要的作用,其中黑火药的爆炸反应为2KNO3+S+3CK2S+N2↑+3CO2↑,该反应中被还原的元素是 ( )
A.C B.N C.S D.O
10.(双选)硫酸亚铁煅烧反应为2FeSO4SO2+Fe2O3+SO3,下列有关说法正确的是( )
A.生成一分子SO2转移2个电子
B.FeSO4中铁元素被还原
C.SO3是氧化产物
D.该反应中FeSO4既是氧化剂,又是还原剂
11.(双选)(2020北京顺义期末,改编)为了防止钢铁零件生锈,常采用化学处理使钢铁零件表面生成Fe3O4的致密保护层——“发蓝”。化学处理过程中其中一步的反应为3Fe+NaNO2+5NaOH3Na2FeO2+H2O+NH3↑。下列叙述不正确的是( )
A.上述反应涉及的物质中,Fe的还原性最强
B.Na2FeO2中Fe的化合价为+3价
C.上述反应中,铁是还原剂,NaNO2和NaOH是氧化剂
D.N的氧化性大于Fe的氧化性
12.氟利昂在常温下都是无色气体或易挥发液体,常用于制冷剂,但由于二氯二氟甲烷等CFC类制冷剂破坏大气臭氧层,已限制使用。F2用于合成氟利昂等冷却剂,化学历史上首次用化学方法制得F2的三步反应如下:
①KMnO4+KF+H2O2+HFK2MnF6+ +H2O
②SbCl5+5HFSbF5+5HCl
③2K2MnF6+4SbF54KSbF6+2MnF3+F2↑
请根据以上信息回答下列问题:
(1)反应①中空格上应填物质的化学式为 。
(2)反应②是否为氧化还原反应 (填“是”“否”或“无法确定”)。
(3)反应③中的氧化剂为 ,被氧化的元素为 。
13.化学反应按照不同的分类方法,可以分为化合反应、分解反应、置换反应、复分解反应,或者分为氧化还原反应和非氧化还原反应。有下列一组反应:
①CO2+C2CO
②Cu2(OH)2CO32CuO+H2O+CO2↑
③2NaOH+Cl2NaCl+NaClO+H2O
④2CO+O22CO2
⑤3Fe+4H2O(g)Fe3O4+4H2
⑥CuO+COCu+CO2
⑦4NH3+3O22N2+6H2O
⑧2H2O2H2↑+O2↑
⑨2Al+2NaOH+2H2O2NaAlO2+3H2↑
⑩SO2+H2OH2SO3
H2O2+SO22H++S
(1)其中属于化合反应的有 ,属于置换反应的有 。
(2)在化学反应前后元素的化合价没有变化的是 。
(3)上述反应中,既是分解反应又是氧化还原反应的是 。
(4)上述反应中,既是溶液中的离子反应,又是氧化还原反应的是 。
(5)根据你的理解,氧化还原反应的实质是 。
A.分子中的原子重新组合
B.氧的得失
C.电子的得失或共用电子对的偏移
D.元素化合价的改变
【创优】
1.饮用水中的N对人类健康会产生危害,为了降低饮用水中N的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将N还原为N2,其化学方程式为10Al+6NaNO3+4NaOH10NaAlO2+3N2↑+2H2O。
请回答下列问题:
(1)上述反应中, 元素的化合价升高,则该元素的原子 (填“得到”或“失去”)电子;而 元素的化合价降低,则该元素的原子被 (填“氧化”或“还原”)。
(2)用双线桥法表示出反应中电子转移的方向和数目。
2.凡是养鱼的人都知道一种很不错的消毒剂,这就是被称为当今第四代消毒产品的二氧化氯。其属于A1级别安全高效消毒剂之一,并且可以在极低的浓度下对病菌有杀灭作用,功效显而易见。
KClO3和浓盐酸在一定温度下反应生成黄绿色的易爆物二氧化氯。其变化可表述为
KClO3+ HCl(浓) KCl+ ClO2↑+ Cl2↑+
(1)请完成该化学方程式并配平(未知物化学式和系数填入框内)。
(2)浓盐酸在反应中显示出来的性质是 (填序号)。
①只有还原性 ②还原性和酸性 ③只有氧化性
④氧化性和酸性
(3)产生1分子Cl2,转移的电子为 个。
(4)ClO2具有很强的氧化性,因此常被用作消毒剂,其消毒效率(以单位质量得到的电子数表示)是Cl2的 倍(保留小数点后两位)。
参考答案:
【基础】
1.C
2.C
3.C
4.A
5.D
6.D
7.C
8.A
9.C
10.A
11.D
12.A
13.BC
14.
(1)KHCO3
(2)是 氧元素的化合价由-1价降为-2价,被还原
15.
(1)H2O2 (2)H2CrO4 Cr(OH)3
(3)
【提升】
1.C
2.B
3.D
4.A
5.A
6.B
7.A
8.BD
9.BC
10.AD
11.BC
12.
(1)O2 (2)否 (3)K2MnF6 F
13.
(1)①④⑩ ⑤⑦ (2)②⑩ (3)⑧ (4)③⑨ (5)C
【创优】
1.
(1)铝 失去 氮 还原
(2)+2H2O
2.
(1)2 4 2 2 1 2H2O
(2)② (3)2 (4)2.63
