人教版必修一(2019)-2.2《氯及其化合物》分层训练(含答案)
文档属性
| 名称 | 人教版必修一(2019)-2.2《氯及其化合物》分层训练(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-11 09:06:01 | ||
图片预览



文档简介
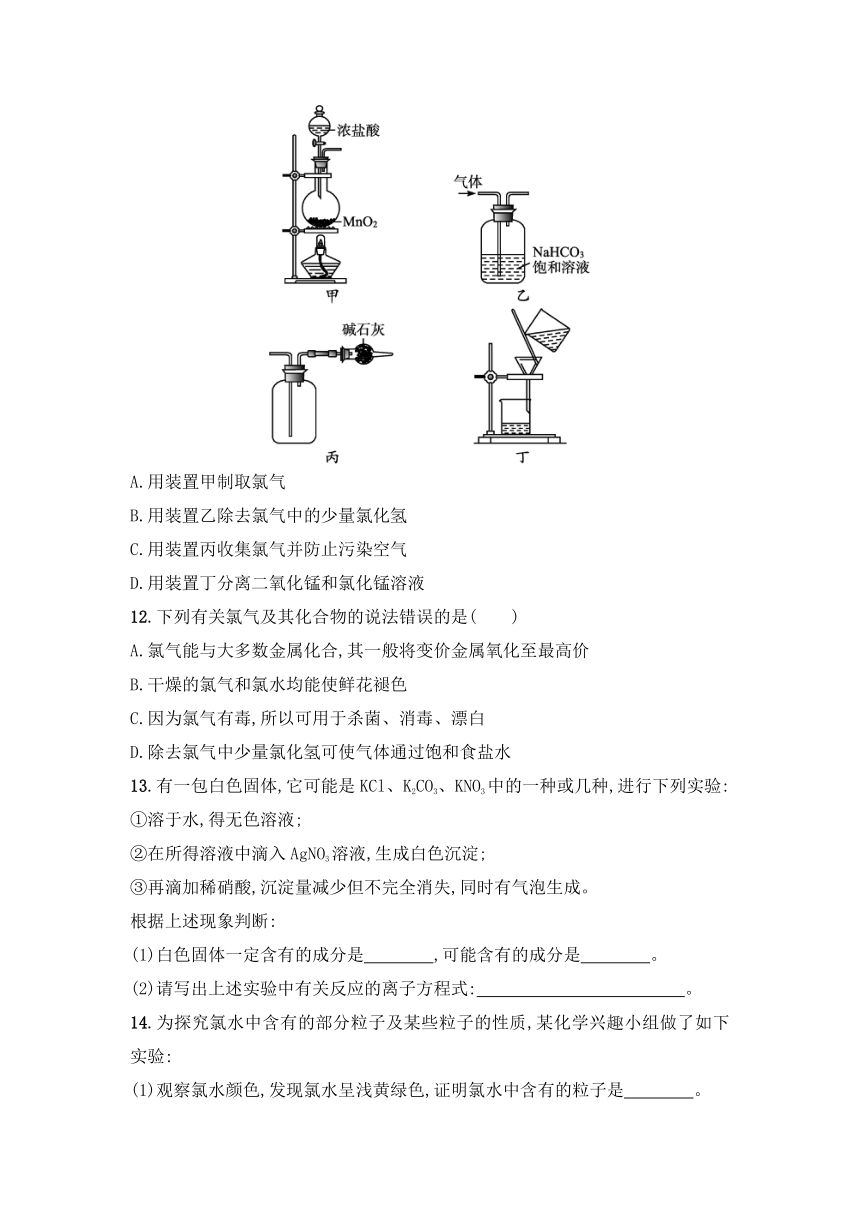
《氯及其化合物》分层训练
【基础】
1.向盛有氯气的集气瓶中,注入约五分之一容器体积的下列液体并轻轻振荡,观察到的现象记录如图所示。判断瓶中注入的液体是( )
A.AgNO3溶液 B.NaOH溶液
C.水 D.FeCl2溶液
2.检验某溶液中是否含有Cl-,正确的操作是( )
A.取样,滴加AgNO3溶液,看是否有白色沉淀生成
B.取样,先加盐酸酸化,再加入AgNO3溶液,看是否有白色沉淀生成
C.取样,先加稀硫酸酸化,再加入AgNO3溶液,看是否有白色沉淀生成
D.取样,加少量AgNO3溶液,有白色沉淀;再加稀硝酸,看白色沉淀是否消失
3.下列实验过程中,不会产生气体的是( )
4.检验氯化氢气体中是否混有Cl2,可采用的方法是( )
A.用干燥的蓝色石蕊试纸
B.用干燥有色布条
C.将气体通入AgNO3溶液
D.用湿润的淀粉碘化钾试纸
5.下列有关反应的离子方程式不正确的是( )
A.氯气与冷的石灰乳:Cl2+Ca(OH)2Ca2++ H2O+ Cl-+ ClO-
B.FeCl3溶液中加入Cu片:2Fe3++Cu2Fe2++Cu2+
C.氯气溶于水:Cl2+H2OH++HClO+Cl-
D.过氧化钠投入水中:2Na2O2+2H2OO2↑+2Na++2OH-
6.将适量物质分别滴加到干燥的红色布条上,不能使其褪色的是( )
A.新制的氯水 B.“84”消毒液
C.液氯 D.次氯酸溶液
7.实验室用下列两种方法制氯气:①用含HCl 146 g的浓盐酸与足量的MnO2反应;②用87 g MnO2与足量浓盐酸反应。所得的氯气( )
A.①比②多 B.②比①多
C.一样多 D.无法比较
8.欲除去Cl2中的少量HCl气体,可选用( )
A.NaOH溶液 B.饱和食盐水
C.浓硫酸 D.石灰水
9.某化学兴趣小组利用MnO2和浓盐酸及如图装置制备Cl2。下列分析中不正确的是( )
A.①中可用分液漏斗代替长颈漏斗
B.①中缺少加热装置
C.②中盛放的NaOH溶液可以净化氯气
D.④中盛放的NaOH溶液可以吸收尾气
10.下列关于Cl2的描述中正确的是( )
A.Cl2以液态形式存在时可称作氯水或液氯
B.红热的铜丝在Cl2中燃烧,生成蓝色固体CuCl2
C.有Cl2参加的化学反应必须在溶液中进行
D.钠在Cl2中燃烧生成白色固体
11.下列装置应用于实验室制取氯气并回收氯化锰溶液,不能达到实验目的的是( )
A.用装置甲制取氯气
B.用装置乙除去氯气中的少量氯化氢
C.用装置丙收集氯气并防止污染空气
D.用装置丁分离二氧化锰和氯化锰溶液
12.下列有关氯气及其化合物的说法错误的是( )
A.氯气能与大多数金属化合,其一般将变价金属氧化至最高价
B.干燥的氯气和氯水均能使鲜花褪色
C.因为氯气有毒,所以可用于杀菌、消毒、漂白
D.除去氯气中少量氯化氢可使气体通过饱和食盐水
13.有一包白色固体,它可能是KCl、K2CO3、KNO3中的一种或几种,进行下列实验:
①溶于水,得无色溶液;
②在所得溶液中滴入AgNO3溶液,生成白色沉淀;
③再滴加稀硝酸,沉淀量减少但不完全消失,同时有气泡生成。
根据上述现象判断:
(1)白色固体一定含有的成分是 ,可能含有的成分是 。
(2)请写出上述实验中有关反应的离子方程式: 。
14.为探究氯水中含有的部分粒子及某些粒子的性质,某化学兴趣小组做了如下实验:
(1)观察氯水颜色,发现氯水呈浅黄绿色,证明氯水中含有的粒子是 。
(2)向氯水中滴入碳酸钠溶液,有气体生成,说明氯水中含有的粒子是 。
(3)盛有氯水的试管中的有色布条褪色,说明氯水中含有的粒子是 。
(4)将紫色石蕊溶液滴入新制氯水中,溶液显红色,起作用的微粒是 ,过一会儿,溶液的颜色褪去,起作用的微粒是 。
(5)向氯水中滴加AgNO3溶液有白色沉淀生成,证明氯水中含有的粒子是 。
(6)氯水经光照后,颜色逐渐消失,放出的无色气体是 ,溶液的酸性
(填“增强”“不变”或“减弱”)。
(7)将Cl2通入水中,所得溶液中具有氧化性的含氯微粒是 。
【提升】
1.在新制氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列实验现象和结论一致且正确的是( )
A.加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在
B.溶液呈浅黄绿色,且有刺激性气味,说明有Cl2存在
C.先加入盐酸酸化,再加入AgNO3溶液产生白色沉淀,说明有Cl-存在
D.加入NaOH溶液,氯水浅黄绿色消失,说明有HClO存在
2.为了证明氯酸钾晶体中含有氯元素,选用下面给出的试剂和操作进行验证。其操作顺序正确的是( )
①滴加AgNO3溶液 ②加水溶解 ③过滤、取滤液 ④与二氧化锰混合加热
⑤加稀硝酸 ⑥与浓盐酸反应 ⑦与NaOH溶液混合加热
A.⑥⑦①⑤ B.⑥⑦
C.④②③①⑤ D.②①⑤
3.现有盐酸、NaCl溶液、NaOH溶液和新制氯水,可用来区别它们的一种试剂是( )
A.AgNO3溶液 B.酚酞溶液
C.紫色石蕊溶液 D.饱和食盐水
4.下列物质转化不能通过一步反应直接实现的是( )
FeCl2Cl2Ca(ClO)2HClOO2
A.① B.② C.③ D.④
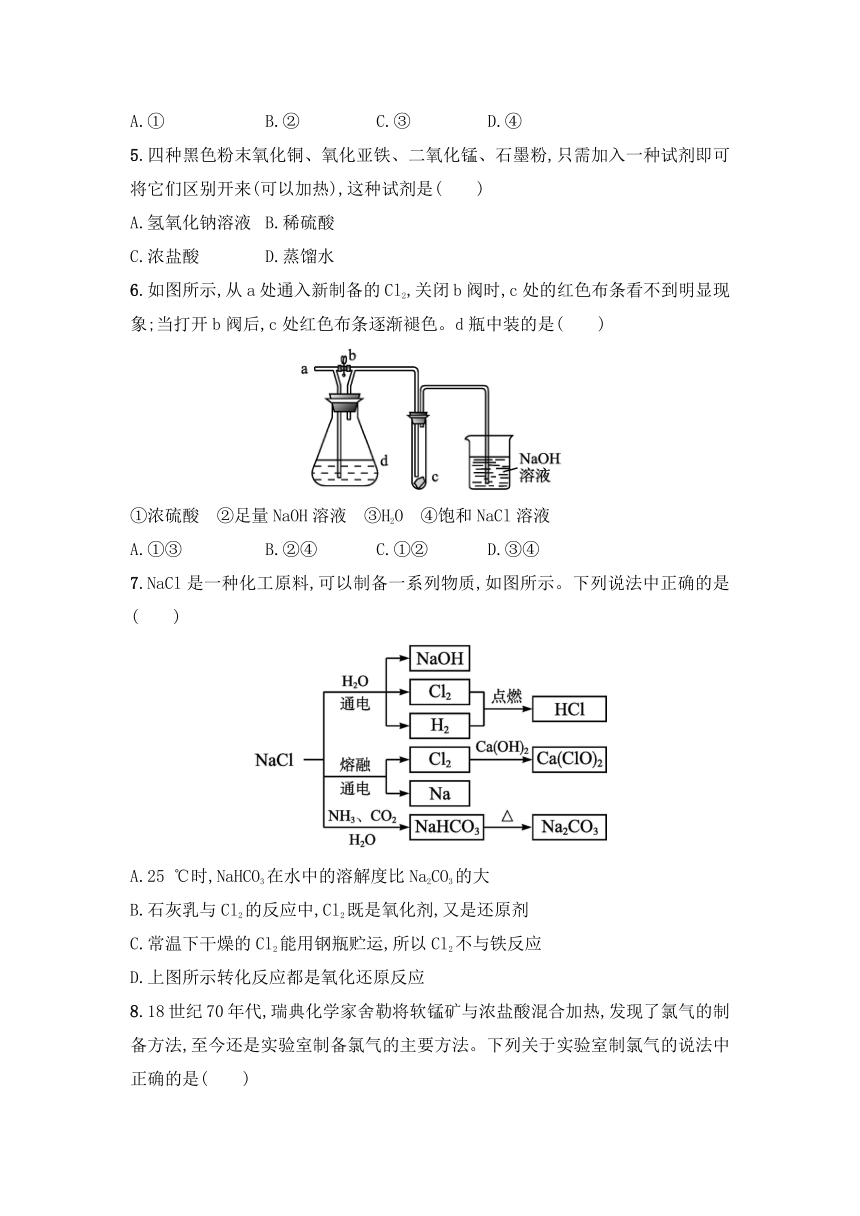
5.四种黑色粉末氧化铜、氧化亚铁、二氧化锰、石墨粉,只需加入一种试剂即可将它们区别开来(可以加热),这种试剂是( )
A.氢氧化钠溶液 B.稀硫酸
C.浓盐酸 D.蒸馏水
6.如图所示,从a处通入新制备的Cl2,关闭b阀时,c处的红色布条看不到明显现象;当打开b阀后,c处红色布条逐渐褪色。d瓶中装的是( )
①浓硫酸 ②足量NaOH溶液 ③H2O ④饱和NaCl溶液
A.①③ B.②④ C.①② D.③④
7.NaCl是一种化工原料,可以制备一系列物质,如图所示。下列说法中正确的是( )
A.25 ℃时,NaHCO3在水中的溶解度比Na2CO3的大
B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂
C.常温下干燥的Cl2能用钢瓶贮运,所以Cl2不与铁反应
D.上图所示转化反应都是氧化还原反应
8.18世纪70年代,瑞典化学家舍勒将软锰矿与浓盐酸混合加热,发现了氯气的制备方法,至今还是实验室制备氯气的主要方法。下列关于实验室制氯气的说法中正确的是( )
A.收集氯气时,可采用湿润的KI淀粉试纸进行验满
B.将87 g MnO2和足量浓盐酸反应,与将含有146 g HCl的浓盐酸与足量MnO2反应制得的氯气一样多
C.为防止氯气污染环境,必须进行尾气处理,可选用澄清石灰水
D.浓盐酸在反应中起到酸和氧化剂的作用
9.(双选)三氯化碘(ICl3)在药物合成中用途非常广泛,其熔点为33 ℃,沸点为73 ℃,遇水易反应。实验室可用下图装置(部分夹持装置已略去)制取ICl3,制备的反应原理:I2+3Cl22ICl3。下列说法正确的是( )
A.利用装置甲制备氯气选用的药品为二氧化锰和浓盐酸
B.装置乙中长颈漏斗液面上升说明丙装置可能发生堵塞
C.装置丙中氯化钙的作用是干燥Cl2
D.装置丁中生成ICl3,其中碘元素的化合价为-3价
10.(双选)已知NaClO溶液与CO2气体能发生如下反应:NaClO+H2O+CO2NaHCO3+HClO,下列叙述错误的是( )
A.HClO比H2CO3酸性强
B.向漂白粉溶液中加少量盐酸可增强漂白性
C.向漂白粉溶液中通少量Cl2可增强漂白性
D.向漂白粉溶液中通CO2气体,无明显现象
11.(双选)下列关于实验室制取Cl2的说法正确的是( )
A.将混有HCl杂质的Cl2通过盛有饱和NaHCO3溶液的洗气瓶除去杂质
B.实验室制取Cl2的反应中,浓盐酸起到酸性和还原剂作用
C.实验室用右图装置除去Cl2中少量的HCl
D.实验室制备Cl2,可用排饱和食盐水集气法收集
12.在实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如图:
(1)连接上述仪器的正确顺序(填各接口处的字母): 接 ; 接 ; 接 ; 接 。
(2)装置中,饱和食盐水的作用是 ;NaOH溶液的作用是 。
(3)化学实验中常用湿润的KI淀粉试纸检验是否有Cl2产生。如果有Cl2产生,可观察到 ,反应的化学方程式为 。
(4)写出下列化学反应的化学方程式:
①气体发生装置中进行的反应: 。
②NaOH溶液中发生的反应: 。
13.由于用氯气对饮用水消毒会使水中的有机物发生氯代反应,生成含氯有机化合物,对人体有害,世界环保联盟即将全面禁止这种消毒方法,建议采用具有强氧化性的广谱高效消毒剂二氧化氯(ClO2)。ClO2极易爆炸,生产和使用时应尽量用稀有气体稀释,避免光照、振动或加热。
(1)在ClO2分子中,氯元素的化合价是 价。
(2)欧洲一些国家用NaClO3氧化浓盐酸来制取ClO2,同时有Cl2生成,且Cl2分子的数目为ClO2分子数目的一半。表示这一反应的化学方程式是 。
(3)我国广泛采用经干燥空气稀释的氯气通入填有固体氯酸钠(NaClO3)的柱内制得ClO2,这一反应的化学方程式是 ,和欧洲的方法相比,我国这一方法的主要优点是 。
14.Cl2是一种重要的化工原料,下图是一些含氯产品。
(1)①中钢瓶上应贴的标签为 。
A.腐蚀品 B.爆炸品
C.有毒品 D.易燃品
(2)工业上利用Cl2制盐酸,其化学方程式为 。Cl2溶于水可制得氯水,检验一瓶氯水是否已经完全变质,可选用的试剂是 。
A.硝酸银溶液 B.酚酞溶液
C.碳酸钠溶液 D.紫色石蕊溶液
(3)将8.7 g MnO2与足量浓盐酸混合加热,被氧化的HCl的质量是 g。
【创优】
1.为了探究新制饱和氯水的组成和性质而进行了下列科学实验,请根据要求回答问题:
(1)请写出新制饱和氯水中含氯微粒的化学式: 。
(2)若不再进行更多的实验,请说明能快速判断氯水中含有Cl2的主要依据: 。
(3)取适量新制饱和氯水滴入品红溶液后褪色,可得出氯气与水反应的产物HClO具有漂白性,请你评价该结论是否合理 。若不合理,请说明理由(若合理,则无需填写): 。
(4)先观察了氯水的外观性质以后,又用胶头滴管将该氯水逐滴滴入含有酚酞的NaOH溶液中,边滴边振荡,并连续观察现象,发现溶液的红色逐渐褪去而得无色溶液。根据预测,实验中溶液红色褪去的原因可能有两种,请用简要的文字说明:
① 。
② 。
他们又要通过实验进一步探究溶液红色褪去的原因究竟是上述中的①还是②。
[实验步骤]
a.取试管内的无色溶液3 mL盛于另一支洁净的试管中;
b. ,振荡试管。
[实验现象及结论]
Ⅰ.若 ,则证明溶液红色褪去的原因是①而不是②;
Ⅱ.若 ,则证明溶液红色褪去的原因是②而不是①。
2.2020年新冠疫情期间,常用的消毒剂有医用酒精和“84”消毒液等,使用酒精进行环境消毒时要避免明火。使用“84”消毒液时要避免与洁厕剂混用,两者混用会产生氯气,引起中毒。
某化学兴趣小组尝试利用“84”消毒液与硫酸溶液反应制取氯气,反应的化学方程式为NaClO+NaCl+H2SO4Na2SO4+Cl2↑+H2O。为探究氯气的性质,某同学设计了如下所示的实验装置。
请回答:
(1)在该实验中,制取氯气的装置是 (填字母)。
(2)装置B、C中依次放入的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是 ,请提出合理的改进方法: 。
(3)写出氯气与NaOH溶液反应的离子方程式: 。
为验证尾气吸收后的溶液中存在Cl-,正确的操作是 。
(4)Cl2通入饱和NaHCO3溶液产生无色气体,已知酸性HCl>H2CO3>HClO,该实验证明Cl2与H2O反应的产物中含有 。
参考答案:
【基础】
1.C
2.D
3.C
4.D
5.D
6.C
7.B
8.B
9.C
10.D
11.B
12.C
13.
(1)KCl和K2CO3 KNO3
(2)Ag++Cl-AgCl↓,2Ag++CAg2CO3↓,Ag2CO3+2H+2Ag++H2O+CO2↑
14.
(1)Cl2 (2)H+ (3)HClO (4)H+ HClO
(5)Cl- (6)O2 增强 (7)Cl2、ClO-、HClO
【提升】
1.B
2.C
3.C
4.A
5.C
6.C
7.B
8.A
9.BC
10.AD
11.BD
12.
(1)E C D A B H G F
(2)除去氯气中的HCl杂质 吸收多余的氯气
(3)试纸变蓝 2KI+Cl22KCl+I2
(4)①MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O ②2NaOH+Cl2NaCl+NaClO+H2O
13.
(1)+4
(2)2NaClO3+4HCl(浓)2NaCl+2ClO2↑+Cl2↑+2H2O
(3)2NaClO3+Cl22NaClO+2ClO2 副产物少,原料利用率高
14.
(1)C (2)H2+Cl22HCl D (3)7.3
【创优】
1.
(1)Cl2、Cl-、HClO、ClO-
(2)氯水显浅黄绿色
(3)不合理 没有事先证明干燥的氯气和盐酸无漂白性
(4)①HCl和HClO中和了NaOH ②HClO氧化了酚酞
[实验步骤]b.再向试管内滴加2滴NaOH溶液
[实验现象及结论]Ⅰ.溶液恢复红色 Ⅱ.溶液仍为无色
2.
(1)c
(2)Cl2中混有少量H2O(g) 在A~B之间增加装有浓硫酸的洗气瓶
(3)Cl2+2OH-Cl-+ClO-+H2O 取少量烧杯内吸收Cl2后的溶液,加入足量的稀硝酸酸化,再加入AgNO3溶液,若有白色沉淀生成,证明其中含有Cl-
(4)HCl
【基础】
1.向盛有氯气的集气瓶中,注入约五分之一容器体积的下列液体并轻轻振荡,观察到的现象记录如图所示。判断瓶中注入的液体是( )
A.AgNO3溶液 B.NaOH溶液
C.水 D.FeCl2溶液
2.检验某溶液中是否含有Cl-,正确的操作是( )
A.取样,滴加AgNO3溶液,看是否有白色沉淀生成
B.取样,先加盐酸酸化,再加入AgNO3溶液,看是否有白色沉淀生成
C.取样,先加稀硫酸酸化,再加入AgNO3溶液,看是否有白色沉淀生成
D.取样,加少量AgNO3溶液,有白色沉淀;再加稀硝酸,看白色沉淀是否消失
3.下列实验过程中,不会产生气体的是( )
4.检验氯化氢气体中是否混有Cl2,可采用的方法是( )
A.用干燥的蓝色石蕊试纸
B.用干燥有色布条
C.将气体通入AgNO3溶液
D.用湿润的淀粉碘化钾试纸
5.下列有关反应的离子方程式不正确的是( )
A.氯气与冷的石灰乳:Cl2+Ca(OH)2Ca2++ H2O+ Cl-+ ClO-
B.FeCl3溶液中加入Cu片:2Fe3++Cu2Fe2++Cu2+
C.氯气溶于水:Cl2+H2OH++HClO+Cl-
D.过氧化钠投入水中:2Na2O2+2H2OO2↑+2Na++2OH-
6.将适量物质分别滴加到干燥的红色布条上,不能使其褪色的是( )
A.新制的氯水 B.“84”消毒液
C.液氯 D.次氯酸溶液
7.实验室用下列两种方法制氯气:①用含HCl 146 g的浓盐酸与足量的MnO2反应;②用87 g MnO2与足量浓盐酸反应。所得的氯气( )
A.①比②多 B.②比①多
C.一样多 D.无法比较
8.欲除去Cl2中的少量HCl气体,可选用( )
A.NaOH溶液 B.饱和食盐水
C.浓硫酸 D.石灰水
9.某化学兴趣小组利用MnO2和浓盐酸及如图装置制备Cl2。下列分析中不正确的是( )
A.①中可用分液漏斗代替长颈漏斗
B.①中缺少加热装置
C.②中盛放的NaOH溶液可以净化氯气
D.④中盛放的NaOH溶液可以吸收尾气
10.下列关于Cl2的描述中正确的是( )
A.Cl2以液态形式存在时可称作氯水或液氯
B.红热的铜丝在Cl2中燃烧,生成蓝色固体CuCl2
C.有Cl2参加的化学反应必须在溶液中进行
D.钠在Cl2中燃烧生成白色固体
11.下列装置应用于实验室制取氯气并回收氯化锰溶液,不能达到实验目的的是( )
A.用装置甲制取氯气
B.用装置乙除去氯气中的少量氯化氢
C.用装置丙收集氯气并防止污染空气
D.用装置丁分离二氧化锰和氯化锰溶液
12.下列有关氯气及其化合物的说法错误的是( )
A.氯气能与大多数金属化合,其一般将变价金属氧化至最高价
B.干燥的氯气和氯水均能使鲜花褪色
C.因为氯气有毒,所以可用于杀菌、消毒、漂白
D.除去氯气中少量氯化氢可使气体通过饱和食盐水
13.有一包白色固体,它可能是KCl、K2CO3、KNO3中的一种或几种,进行下列实验:
①溶于水,得无色溶液;
②在所得溶液中滴入AgNO3溶液,生成白色沉淀;
③再滴加稀硝酸,沉淀量减少但不完全消失,同时有气泡生成。
根据上述现象判断:
(1)白色固体一定含有的成分是 ,可能含有的成分是 。
(2)请写出上述实验中有关反应的离子方程式: 。
14.为探究氯水中含有的部分粒子及某些粒子的性质,某化学兴趣小组做了如下实验:
(1)观察氯水颜色,发现氯水呈浅黄绿色,证明氯水中含有的粒子是 。
(2)向氯水中滴入碳酸钠溶液,有气体生成,说明氯水中含有的粒子是 。
(3)盛有氯水的试管中的有色布条褪色,说明氯水中含有的粒子是 。
(4)将紫色石蕊溶液滴入新制氯水中,溶液显红色,起作用的微粒是 ,过一会儿,溶液的颜色褪去,起作用的微粒是 。
(5)向氯水中滴加AgNO3溶液有白色沉淀生成,证明氯水中含有的粒子是 。
(6)氯水经光照后,颜色逐渐消失,放出的无色气体是 ,溶液的酸性
(填“增强”“不变”或“减弱”)。
(7)将Cl2通入水中,所得溶液中具有氧化性的含氯微粒是 。
【提升】
1.在新制氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列实验现象和结论一致且正确的是( )
A.加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在
B.溶液呈浅黄绿色,且有刺激性气味,说明有Cl2存在
C.先加入盐酸酸化,再加入AgNO3溶液产生白色沉淀,说明有Cl-存在
D.加入NaOH溶液,氯水浅黄绿色消失,说明有HClO存在
2.为了证明氯酸钾晶体中含有氯元素,选用下面给出的试剂和操作进行验证。其操作顺序正确的是( )
①滴加AgNO3溶液 ②加水溶解 ③过滤、取滤液 ④与二氧化锰混合加热
⑤加稀硝酸 ⑥与浓盐酸反应 ⑦与NaOH溶液混合加热
A.⑥⑦①⑤ B.⑥⑦
C.④②③①⑤ D.②①⑤
3.现有盐酸、NaCl溶液、NaOH溶液和新制氯水,可用来区别它们的一种试剂是( )
A.AgNO3溶液 B.酚酞溶液
C.紫色石蕊溶液 D.饱和食盐水
4.下列物质转化不能通过一步反应直接实现的是( )
FeCl2Cl2Ca(ClO)2HClOO2
A.① B.② C.③ D.④
5.四种黑色粉末氧化铜、氧化亚铁、二氧化锰、石墨粉,只需加入一种试剂即可将它们区别开来(可以加热),这种试剂是( )
A.氢氧化钠溶液 B.稀硫酸
C.浓盐酸 D.蒸馏水
6.如图所示,从a处通入新制备的Cl2,关闭b阀时,c处的红色布条看不到明显现象;当打开b阀后,c处红色布条逐渐褪色。d瓶中装的是( )
①浓硫酸 ②足量NaOH溶液 ③H2O ④饱和NaCl溶液
A.①③ B.②④ C.①② D.③④
7.NaCl是一种化工原料,可以制备一系列物质,如图所示。下列说法中正确的是( )
A.25 ℃时,NaHCO3在水中的溶解度比Na2CO3的大
B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂
C.常温下干燥的Cl2能用钢瓶贮运,所以Cl2不与铁反应
D.上图所示转化反应都是氧化还原反应
8.18世纪70年代,瑞典化学家舍勒将软锰矿与浓盐酸混合加热,发现了氯气的制备方法,至今还是实验室制备氯气的主要方法。下列关于实验室制氯气的说法中正确的是( )
A.收集氯气时,可采用湿润的KI淀粉试纸进行验满
B.将87 g MnO2和足量浓盐酸反应,与将含有146 g HCl的浓盐酸与足量MnO2反应制得的氯气一样多
C.为防止氯气污染环境,必须进行尾气处理,可选用澄清石灰水
D.浓盐酸在反应中起到酸和氧化剂的作用
9.(双选)三氯化碘(ICl3)在药物合成中用途非常广泛,其熔点为33 ℃,沸点为73 ℃,遇水易反应。实验室可用下图装置(部分夹持装置已略去)制取ICl3,制备的反应原理:I2+3Cl22ICl3。下列说法正确的是( )
A.利用装置甲制备氯气选用的药品为二氧化锰和浓盐酸
B.装置乙中长颈漏斗液面上升说明丙装置可能发生堵塞
C.装置丙中氯化钙的作用是干燥Cl2
D.装置丁中生成ICl3,其中碘元素的化合价为-3价
10.(双选)已知NaClO溶液与CO2气体能发生如下反应:NaClO+H2O+CO2NaHCO3+HClO,下列叙述错误的是( )
A.HClO比H2CO3酸性强
B.向漂白粉溶液中加少量盐酸可增强漂白性
C.向漂白粉溶液中通少量Cl2可增强漂白性
D.向漂白粉溶液中通CO2气体,无明显现象
11.(双选)下列关于实验室制取Cl2的说法正确的是( )
A.将混有HCl杂质的Cl2通过盛有饱和NaHCO3溶液的洗气瓶除去杂质
B.实验室制取Cl2的反应中,浓盐酸起到酸性和还原剂作用
C.实验室用右图装置除去Cl2中少量的HCl
D.实验室制备Cl2,可用排饱和食盐水集气法收集
12.在实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如图:
(1)连接上述仪器的正确顺序(填各接口处的字母): 接 ; 接 ; 接 ; 接 。
(2)装置中,饱和食盐水的作用是 ;NaOH溶液的作用是 。
(3)化学实验中常用湿润的KI淀粉试纸检验是否有Cl2产生。如果有Cl2产生,可观察到 ,反应的化学方程式为 。
(4)写出下列化学反应的化学方程式:
①气体发生装置中进行的反应: 。
②NaOH溶液中发生的反应: 。
13.由于用氯气对饮用水消毒会使水中的有机物发生氯代反应,生成含氯有机化合物,对人体有害,世界环保联盟即将全面禁止这种消毒方法,建议采用具有强氧化性的广谱高效消毒剂二氧化氯(ClO2)。ClO2极易爆炸,生产和使用时应尽量用稀有气体稀释,避免光照、振动或加热。
(1)在ClO2分子中,氯元素的化合价是 价。
(2)欧洲一些国家用NaClO3氧化浓盐酸来制取ClO2,同时有Cl2生成,且Cl2分子的数目为ClO2分子数目的一半。表示这一反应的化学方程式是 。
(3)我国广泛采用经干燥空气稀释的氯气通入填有固体氯酸钠(NaClO3)的柱内制得ClO2,这一反应的化学方程式是 ,和欧洲的方法相比,我国这一方法的主要优点是 。
14.Cl2是一种重要的化工原料,下图是一些含氯产品。
(1)①中钢瓶上应贴的标签为 。
A.腐蚀品 B.爆炸品
C.有毒品 D.易燃品
(2)工业上利用Cl2制盐酸,其化学方程式为 。Cl2溶于水可制得氯水,检验一瓶氯水是否已经完全变质,可选用的试剂是 。
A.硝酸银溶液 B.酚酞溶液
C.碳酸钠溶液 D.紫色石蕊溶液
(3)将8.7 g MnO2与足量浓盐酸混合加热,被氧化的HCl的质量是 g。
【创优】
1.为了探究新制饱和氯水的组成和性质而进行了下列科学实验,请根据要求回答问题:
(1)请写出新制饱和氯水中含氯微粒的化学式: 。
(2)若不再进行更多的实验,请说明能快速判断氯水中含有Cl2的主要依据: 。
(3)取适量新制饱和氯水滴入品红溶液后褪色,可得出氯气与水反应的产物HClO具有漂白性,请你评价该结论是否合理 。若不合理,请说明理由(若合理,则无需填写): 。
(4)先观察了氯水的外观性质以后,又用胶头滴管将该氯水逐滴滴入含有酚酞的NaOH溶液中,边滴边振荡,并连续观察现象,发现溶液的红色逐渐褪去而得无色溶液。根据预测,实验中溶液红色褪去的原因可能有两种,请用简要的文字说明:
① 。
② 。
他们又要通过实验进一步探究溶液红色褪去的原因究竟是上述中的①还是②。
[实验步骤]
a.取试管内的无色溶液3 mL盛于另一支洁净的试管中;
b. ,振荡试管。
[实验现象及结论]
Ⅰ.若 ,则证明溶液红色褪去的原因是①而不是②;
Ⅱ.若 ,则证明溶液红色褪去的原因是②而不是①。
2.2020年新冠疫情期间,常用的消毒剂有医用酒精和“84”消毒液等,使用酒精进行环境消毒时要避免明火。使用“84”消毒液时要避免与洁厕剂混用,两者混用会产生氯气,引起中毒。
某化学兴趣小组尝试利用“84”消毒液与硫酸溶液反应制取氯气,反应的化学方程式为NaClO+NaCl+H2SO4Na2SO4+Cl2↑+H2O。为探究氯气的性质,某同学设计了如下所示的实验装置。
请回答:
(1)在该实验中,制取氯气的装置是 (填字母)。
(2)装置B、C中依次放入的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是 ,请提出合理的改进方法: 。
(3)写出氯气与NaOH溶液反应的离子方程式: 。
为验证尾气吸收后的溶液中存在Cl-,正确的操作是 。
(4)Cl2通入饱和NaHCO3溶液产生无色气体,已知酸性HCl>H2CO3>HClO,该实验证明Cl2与H2O反应的产物中含有 。
参考答案:
【基础】
1.C
2.D
3.C
4.D
5.D
6.C
7.B
8.B
9.C
10.D
11.B
12.C
13.
(1)KCl和K2CO3 KNO3
(2)Ag++Cl-AgCl↓,2Ag++CAg2CO3↓,Ag2CO3+2H+2Ag++H2O+CO2↑
14.
(1)Cl2 (2)H+ (3)HClO (4)H+ HClO
(5)Cl- (6)O2 增强 (7)Cl2、ClO-、HClO
【提升】
1.B
2.C
3.C
4.A
5.C
6.C
7.B
8.A
9.BC
10.AD
11.BD
12.
(1)E C D A B H G F
(2)除去氯气中的HCl杂质 吸收多余的氯气
(3)试纸变蓝 2KI+Cl22KCl+I2
(4)①MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O ②2NaOH+Cl2NaCl+NaClO+H2O
13.
(1)+4
(2)2NaClO3+4HCl(浓)2NaCl+2ClO2↑+Cl2↑+2H2O
(3)2NaClO3+Cl22NaClO+2ClO2 副产物少,原料利用率高
14.
(1)C (2)H2+Cl22HCl D (3)7.3
【创优】
1.
(1)Cl2、Cl-、HClO、ClO-
(2)氯水显浅黄绿色
(3)不合理 没有事先证明干燥的氯气和盐酸无漂白性
(4)①HCl和HClO中和了NaOH ②HClO氧化了酚酞
[实验步骤]b.再向试管内滴加2滴NaOH溶液
[实验现象及结论]Ⅰ.溶液恢复红色 Ⅱ.溶液仍为无色
2.
(1)c
(2)Cl2中混有少量H2O(g) 在A~B之间增加装有浓硫酸的洗气瓶
(3)Cl2+2OH-Cl-+ClO-+H2O 取少量烧杯内吸收Cl2后的溶液,加入足量的稀硝酸酸化,再加入AgNO3溶液,若有白色沉淀生成,证明其中含有Cl-
(4)HCl
