新疆维吾尔自治区疏附县第一中学2021-2022学年高二上学期第二次月考(12月)化学试题(Word版含答案)
文档属性
| 名称 | 新疆维吾尔自治区疏附县第一中学2021-2022学年高二上学期第二次月考(12月)化学试题(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 391.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-12 17:38:28 | ||
图片预览



文档简介
疏附县第一中学2021-2022学年高二上学期第二次月考
化学试题
一、选择题:本题共18小题,每小题3分,共54分.在每小题给出的四个选项中,只有一项是符合题目要求的.
1.纵观古今,化学与生活皆有着密切联系。下列说法正确的是
A.“嫘祖栽桑蚕吐丝,抽丝织作绣神奇”中的“丝”与“新疆棉”成分不相同
B.“红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并无涩味”文中的“气”指氧气
C.我国发射的“嫦娥五号”月球探测器中使用的碳纤维是一种新型有机高分子材料
D.“复兴号”高铁上用到的铁合金利用了铁合金硬度小等特点
2.下列反应不能用划线反应物所具有的类别通性解释的是
A.碱:NaOH + HNO3 =NaNO3 + H2O
B.金属单质:Zn + CuSO4 =Cu + ZnSO4
C.酸:HCl + NaClO =NaCl + HClO
D.酸性氧化物:CO2 + C=2CO
3.一定能在下列溶液中大量共存的离子组是
A.含有大量Al3+的溶液:Na+、NH、SO、Cl-
B.碱性溶液:Na+、Ca2+、SO、CO
C.含有大量Fe3+的溶液:Na+、Mg2+、NO、SCN-
D.含有大量NO的溶液:H+、Fe2+、SO、Cl-
4.化学与生产、生活、科技、环境等密切相关。下列说法正确的是
A.为推动生态文明建设,我国近年来大力发展核电、光电、风电、水电,电能属于一次能源
B.打印机墨粉中常加有Fe3O4,这是利用了其有颜色和具有磁性的特点,可用替代Fe3O4
C.“天和”号核心舱上使用了目前世界上最先进的三结砷化镓太阳能电池翼,砷化镓属于半导体材料
D.工业上通过将石灰石、石英、纯碱混合熔融主要通过发生氧化还原反应制备普通玻璃。
5.对于某些离子的检验及结论表述正确的是
A.加稀盐酸产生无色气体,将气体通入澄清石灰水中产生白色浑浊,则样品含有
B.加入盐酸无现象后,再加氯化钡溶液有白色沉淀产生,则样品中含有
C.加入NaOH溶液并加热,产生能使湿润的蓝色石蕊试纸变红的气体,则样品中含有
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,则样品中含有Ca2+或Ba2+
6.NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,22.4 L CCl4中含有的分子数为NA
B.18 g D2O和18 g H2O中含有的质子数均为10 NA
C.0.5 mol·L-1 硫酸溶液中含有的H+数为NA
D.0.1 mol的11B中,含有0.6 NA个中子
7.下列离子方程式对应正确的是
A.过量通入溶液中:
B.中投入固体:
C.少量双氧水滴入酸性溶液中:
D.在强碱性溶液中次氯酸钠与反应生成
8.下列有关物质的性质和应用说法不正确的是
A.Na-K合金可用作快中子反应堆导热剂 B.ClO2是一种比Cl2更优良的杀菌消毒剂
C.氧化镁是优质的耐高温材料 D.氯水显酸性,可用pH试纸测定氯水的pH
9.在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
A.新制氯水呈浅黄绿色且有刺激性气味,说明氯水中含
B.向氯水中加入固体,有气泡产生,说明氯水中含HClO
C.向氯水中加入石蕊溶液,溶液变红后褪色,说明水中含和HClO
D.向氯水中滴加硝酸酸化的溶液,产生白色沉淀,说明氯水中含有
10.下列各组内物质属同一类别的是
A.苛性钾、纯碱、烧碱、氢氧化钡 B.硫酸、亚硫酸、硝酸、碳酸
C.硫酸铵、醋酸钠、碳酸铵、醋酸 D.氧化钠、氧化钾、氧化铜、熟石灰
11.用代表阿伏伽德罗常数的值。下列叙述正确的是
A.用铅蓄电池电解氯化钠溶液得到标准状况下22.4L氢气时理论上铅蓄电池中消耗氢离子数目为
B.常温常压下,水蒸气通过Na2O2使其增重2g时,反应中转移的电子数为
C.常温常压下,22.4L HF所含的分子数目为
D.氢气与氯气反应生成标准状况下22.4L氯化氢,断裂化学键的总数为
12.工业上常用“碳氯法”制备,原理为。代表阿伏加德罗常数的值,下列叙述错误的是
A.反应中断裂键,转移的电子数为2
B.反应中消耗,生成的体积为(标准状况)
C.密度、体积均相同的和,的分子数更多
D.将溶于水配成溶液,阴离子总数大于0.2
13.下列判断不合理的一组是
①NO2是酸性氧化物
②根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
③不是所有物质都含有化学键
④根据反应条件是否需要加热将化学反应分为吸热反应和放热反应
⑤氯化氢溶于水的过程中发生了共价键的破坏,该过程属于化学变化
⑥CO2、PCl5分子中各原子都满足8电子稳定结构
A.①③④⑤ B.②④⑤⑥ C.①②④⑥ D.①②④⑤⑥
14.空气中的灰尘、硫酸、硝酸等颗粒物组成的气溶胶系统造成视觉障碍的叫霾。当水汽凝结加剧、空气湿度增大时,霾就会转化为雾。二氧化硫、氮氧化物和可吸入颗粒物这三项是雾霾的主要组成。以下说法不正确的是
A.雾霾天,汽车车灯照出“通路”的现象属于丁达尔效应
B.燃煤中加入生石灰可减少二氧化硫的排放
C.防雾霾口罩的原理与过滤类似,防雾霾效果好的口罩往往呼吸阻力较大
D.PM2.5是直径小于或等于2.5微米的污染物颗粒,完全属于胶体粒子的直径范围
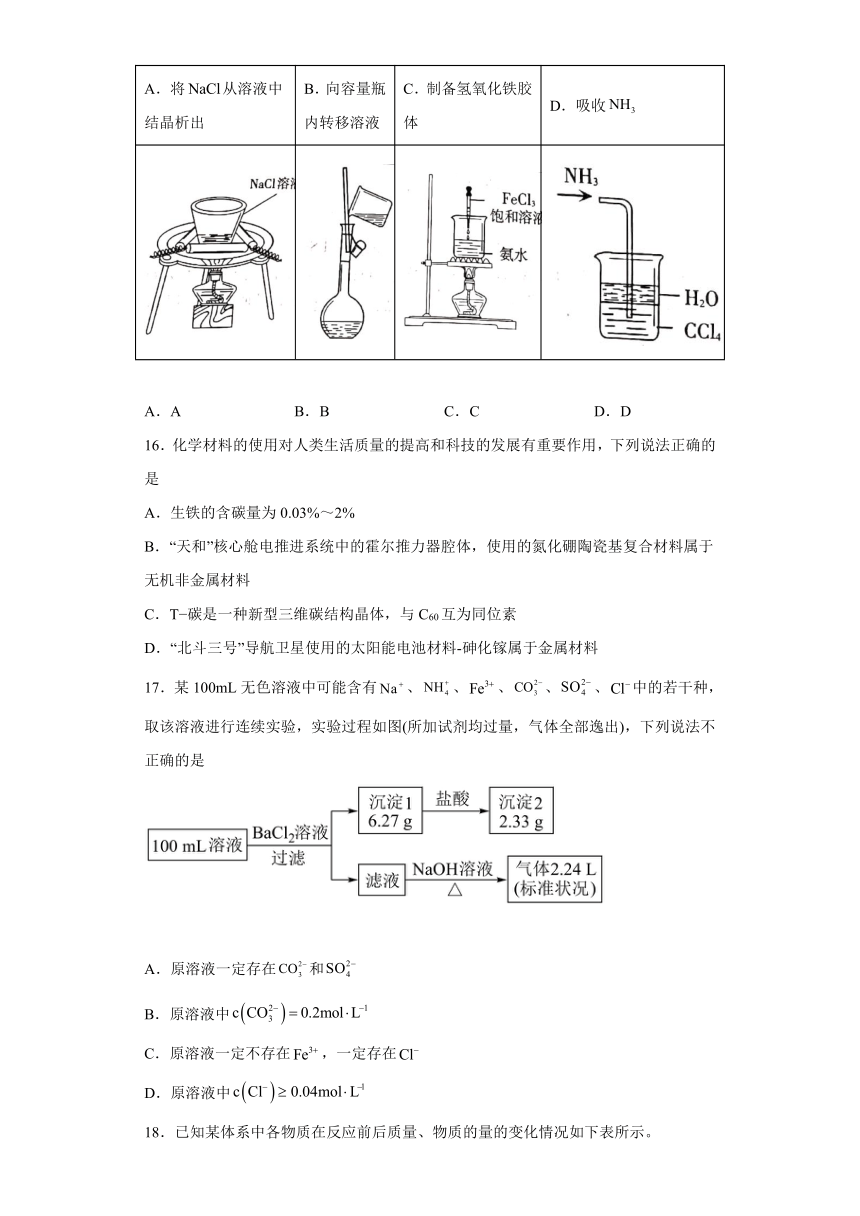
15.下列实验仪器、试剂、操作均正确,且能达到实验目的的是
A.将从溶液中结晶析出 B.向容量瓶内转移溶液 C.制备氢氧化铁胶体 D.吸收
A.A B.B C.C D.D
16.化学材料的使用对人类生活质量的提高和科技的发展有重要作用,下列说法正确的是
A.生铁的含碳量为0.03%~2%
B.“天和”核心舱电推进系统中的霍尔推力器腔体,使用的氮化硼陶瓷基复合材料属于无机非金属材料
C.T 碳是一种新型三维碳结构晶体,与C60互为同位素
D.“北斗三号”导航卫星使用的太阳能电池材料-砷化镓属于金属材料
17.某100mL无色溶液中可能含有、、、、、中的若干种,取该溶液进行连续实验,实验过程如图(所加试剂均过量,气体全部逸出),下列说法不正确的是
A.原溶液一定存在和
B.原溶液中
C.原溶液一定不存在,一定存在
D.原溶液中
18.已知某体系中各物质在反应前后质量、物质的量的变化情况如下表所示。
物质 X Y Z W
反应前质量 /g 1.7 3.4 3.4 1.4
反应前物质的量 /mol 0.05 0.2 0.05 0.05
反应后的质量 /g 0 1.7 …… 1.4
反应后物质的量 /mol …… …… …… ……
相关判断正确的是
A.该反应可以表示为X + 2Y=2Z B.W一定是该反应的催化剂
C.反应后Z的物质的量为0.1 mol D.X与Y的摩尔质量之比为1∶2
二、填空题(共46分)
19.无水四氯化锡可用于制作导电玻璃,导电玻璃广泛用于液晶显示屏、薄膜太阳能电池基底等。可用如图装置制备四氯化锡(部分夹持装置已略去):
有关信息如下表:
化学式
熔点/℃ 246
沸点/℃ 652 144
其他性质 无色晶体,易氧化 无色液体,易水解
回答下列问题:
(1)甲装置中仪器A的名称为___________。
(2)用甲装置制氯气,该反应的离子方程式为___________。
(3)将装置如图连接好,检查气密性,慢慢滴入浓盐酸,待观察到___________(填现象)后,开始加热丁装置,锡熔化后适当增大氯气流量,继续加热丁装置。
(4)如果缺少乙装置,丁装置中可能产生杂质,产生杂质的化学方程式为___________,以下试剂中可用于检测中是否含有的为___________(填字母)。
A.溶液 B.溶液(滴有KSCN)
C.溶液 D.溴水
(5)已装置的作用是___________。
20.利用下图所示装置进行铜与硝酸反应的实验。
(1)硝酸一般盛放在棕色试剂瓶中,请用化学方程式说明其原因:___________。
(2)使用稀硝酸进行实验:反应开始后,铜丝逐渐变细,有气泡产生,溶液变蓝。
①铜与稀硝酸反应的离子方程式为___________。
②实验中观察到试管中的气体略有红棕色,其原因是___________(用化学方程式表示)。
(3)使用浓硝酸进行实验:反应剧烈进行,铜丝逐渐变细,溶液变绿,试管上方出现红棕色气体。
①铜与浓硝酸反应的化学方程式为___________。
②某同学推测反应后溶液呈绿色的原因是在溶液中达到饱和,的饱和溶液呈黄色,硝酸铜溶液呈蓝色,两者混合后呈绿色。他取少量该绿色溶液,向其中加入适量水后溶液变为蓝色,可能的原因是___________(用化学方程式表示)。
21.A、B、C、D是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去)。
(1)若A是一种黄色单质固体,一定条件下B可以转化为C,则B→C的化学方程式为____________________。
(2)若A是一种活泼金属,C是淡黄色固体,则C的名称为_____________,C可用在矿山、坑道、潜水或宇宙飞船等缺氧的场合,将人们呼出的CO2再转换成O2,以供呼吸之用,请用化学方程式表示该反应原理_________________________________________。若生成1molO2,该反应转移电子的物质的量为_____________。
(3)若A为能使湿润的红色石蕊试纸变蓝的气体,C是红棕色气体。回答:
①A为_____________(填写化学式)。实验室用两种固体共热制取A,写出此化学方程式:_____________。
②D可以转化为B,写出D和铜单质反应生成B的离子方程式:____________________________________。
22.将一定质量的镁、铝合金,投入100mL一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加5mol/L NaOH溶液,生成的沉淀质量与加入NaOH溶液体积如图所示,由图中数据分析计算:(必须有计算过程,否则不得分)
(1)Al与NaOH反应的离子方程式_________________________
(2)铝的质量______________
(3)盐酸的物质的量浓度______________
答案
A 2.D 3.A 4.C 5.B 6.D 7.C 8.D 9.B 10.B 11.A 12.D 13.D 14.D 15.D 16.B 17.D 18.C
19.
(1)蒸馏烧瓶
(2)
(3)丁装置内充满黄绿色气体
(4) BD
(5)除去未反应的氯气,防止污染空气;防止水蒸气进入戊装置的试管中使产物水解
20.
(1)
(2)
(3)
21.
(1)
(2) 过氧化钠 2mol
(3) NH3
22.
(1)2Al+2OH-+2H2O=2AlO+3H2↑
(2)解:由图分析与氢氧化铝反应的NaOH的体积为180-160=20mL=0.02L,物质的量为0.02L×5mol/L=0.1mol,设原合金中有xmol的铝
、、
由方程式体现的关系可知,n(Al)=n[Al(OH)3] ,则x=0.1mol ,m(Al)=0.1mol×27g/mol=2.7g
(3)由图分析可知:加入160mL=0.16L的NaOH溶液时,沉淀完全,溶液中成分为NaCl,此时n(HCl)=n(NaOH) =0.16L×5mol/L=0.8mol, c(HCl)=n/V=0.8mol/L
化学试题
一、选择题:本题共18小题,每小题3分,共54分.在每小题给出的四个选项中,只有一项是符合题目要求的.
1.纵观古今,化学与生活皆有着密切联系。下列说法正确的是
A.“嫘祖栽桑蚕吐丝,抽丝织作绣神奇”中的“丝”与“新疆棉”成分不相同
B.“红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并无涩味”文中的“气”指氧气
C.我国发射的“嫦娥五号”月球探测器中使用的碳纤维是一种新型有机高分子材料
D.“复兴号”高铁上用到的铁合金利用了铁合金硬度小等特点
2.下列反应不能用划线反应物所具有的类别通性解释的是
A.碱:NaOH + HNO3 =NaNO3 + H2O
B.金属单质:Zn + CuSO4 =Cu + ZnSO4
C.酸:HCl + NaClO =NaCl + HClO
D.酸性氧化物:CO2 + C=2CO
3.一定能在下列溶液中大量共存的离子组是
A.含有大量Al3+的溶液:Na+、NH、SO、Cl-
B.碱性溶液:Na+、Ca2+、SO、CO
C.含有大量Fe3+的溶液:Na+、Mg2+、NO、SCN-
D.含有大量NO的溶液:H+、Fe2+、SO、Cl-
4.化学与生产、生活、科技、环境等密切相关。下列说法正确的是
A.为推动生态文明建设,我国近年来大力发展核电、光电、风电、水电,电能属于一次能源
B.打印机墨粉中常加有Fe3O4,这是利用了其有颜色和具有磁性的特点,可用替代Fe3O4
C.“天和”号核心舱上使用了目前世界上最先进的三结砷化镓太阳能电池翼,砷化镓属于半导体材料
D.工业上通过将石灰石、石英、纯碱混合熔融主要通过发生氧化还原反应制备普通玻璃。
5.对于某些离子的检验及结论表述正确的是
A.加稀盐酸产生无色气体,将气体通入澄清石灰水中产生白色浑浊,则样品含有
B.加入盐酸无现象后,再加氯化钡溶液有白色沉淀产生,则样品中含有
C.加入NaOH溶液并加热,产生能使湿润的蓝色石蕊试纸变红的气体,则样品中含有
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,则样品中含有Ca2+或Ba2+
6.NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,22.4 L CCl4中含有的分子数为NA
B.18 g D2O和18 g H2O中含有的质子数均为10 NA
C.0.5 mol·L-1 硫酸溶液中含有的H+数为NA
D.0.1 mol的11B中,含有0.6 NA个中子
7.下列离子方程式对应正确的是
A.过量通入溶液中:
B.中投入固体:
C.少量双氧水滴入酸性溶液中:
D.在强碱性溶液中次氯酸钠与反应生成
8.下列有关物质的性质和应用说法不正确的是
A.Na-K合金可用作快中子反应堆导热剂 B.ClO2是一种比Cl2更优良的杀菌消毒剂
C.氧化镁是优质的耐高温材料 D.氯水显酸性,可用pH试纸测定氯水的pH
9.在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
A.新制氯水呈浅黄绿色且有刺激性气味,说明氯水中含
B.向氯水中加入固体,有气泡产生,说明氯水中含HClO
C.向氯水中加入石蕊溶液,溶液变红后褪色,说明水中含和HClO
D.向氯水中滴加硝酸酸化的溶液,产生白色沉淀,说明氯水中含有
10.下列各组内物质属同一类别的是
A.苛性钾、纯碱、烧碱、氢氧化钡 B.硫酸、亚硫酸、硝酸、碳酸
C.硫酸铵、醋酸钠、碳酸铵、醋酸 D.氧化钠、氧化钾、氧化铜、熟石灰
11.用代表阿伏伽德罗常数的值。下列叙述正确的是
A.用铅蓄电池电解氯化钠溶液得到标准状况下22.4L氢气时理论上铅蓄电池中消耗氢离子数目为
B.常温常压下,水蒸气通过Na2O2使其增重2g时,反应中转移的电子数为
C.常温常压下,22.4L HF所含的分子数目为
D.氢气与氯气反应生成标准状况下22.4L氯化氢,断裂化学键的总数为
12.工业上常用“碳氯法”制备,原理为。代表阿伏加德罗常数的值,下列叙述错误的是
A.反应中断裂键,转移的电子数为2
B.反应中消耗,生成的体积为(标准状况)
C.密度、体积均相同的和,的分子数更多
D.将溶于水配成溶液,阴离子总数大于0.2
13.下列判断不合理的一组是
①NO2是酸性氧化物
②根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
③不是所有物质都含有化学键
④根据反应条件是否需要加热将化学反应分为吸热反应和放热反应
⑤氯化氢溶于水的过程中发生了共价键的破坏,该过程属于化学变化
⑥CO2、PCl5分子中各原子都满足8电子稳定结构
A.①③④⑤ B.②④⑤⑥ C.①②④⑥ D.①②④⑤⑥
14.空气中的灰尘、硫酸、硝酸等颗粒物组成的气溶胶系统造成视觉障碍的叫霾。当水汽凝结加剧、空气湿度增大时,霾就会转化为雾。二氧化硫、氮氧化物和可吸入颗粒物这三项是雾霾的主要组成。以下说法不正确的是
A.雾霾天,汽车车灯照出“通路”的现象属于丁达尔效应
B.燃煤中加入生石灰可减少二氧化硫的排放
C.防雾霾口罩的原理与过滤类似,防雾霾效果好的口罩往往呼吸阻力较大
D.PM2.5是直径小于或等于2.5微米的污染物颗粒,完全属于胶体粒子的直径范围
15.下列实验仪器、试剂、操作均正确,且能达到实验目的的是
A.将从溶液中结晶析出 B.向容量瓶内转移溶液 C.制备氢氧化铁胶体 D.吸收
A.A B.B C.C D.D
16.化学材料的使用对人类生活质量的提高和科技的发展有重要作用,下列说法正确的是
A.生铁的含碳量为0.03%~2%
B.“天和”核心舱电推进系统中的霍尔推力器腔体,使用的氮化硼陶瓷基复合材料属于无机非金属材料
C.T 碳是一种新型三维碳结构晶体,与C60互为同位素
D.“北斗三号”导航卫星使用的太阳能电池材料-砷化镓属于金属材料
17.某100mL无色溶液中可能含有、、、、、中的若干种,取该溶液进行连续实验,实验过程如图(所加试剂均过量,气体全部逸出),下列说法不正确的是
A.原溶液一定存在和
B.原溶液中
C.原溶液一定不存在,一定存在
D.原溶液中
18.已知某体系中各物质在反应前后质量、物质的量的变化情况如下表所示。
物质 X Y Z W
反应前质量 /g 1.7 3.4 3.4 1.4
反应前物质的量 /mol 0.05 0.2 0.05 0.05
反应后的质量 /g 0 1.7 …… 1.4
反应后物质的量 /mol …… …… …… ……
相关判断正确的是
A.该反应可以表示为X + 2Y=2Z B.W一定是该反应的催化剂
C.反应后Z的物质的量为0.1 mol D.X与Y的摩尔质量之比为1∶2
二、填空题(共46分)
19.无水四氯化锡可用于制作导电玻璃,导电玻璃广泛用于液晶显示屏、薄膜太阳能电池基底等。可用如图装置制备四氯化锡(部分夹持装置已略去):
有关信息如下表:
化学式
熔点/℃ 246
沸点/℃ 652 144
其他性质 无色晶体,易氧化 无色液体,易水解
回答下列问题:
(1)甲装置中仪器A的名称为___________。
(2)用甲装置制氯气,该反应的离子方程式为___________。
(3)将装置如图连接好,检查气密性,慢慢滴入浓盐酸,待观察到___________(填现象)后,开始加热丁装置,锡熔化后适当增大氯气流量,继续加热丁装置。
(4)如果缺少乙装置,丁装置中可能产生杂质,产生杂质的化学方程式为___________,以下试剂中可用于检测中是否含有的为___________(填字母)。
A.溶液 B.溶液(滴有KSCN)
C.溶液 D.溴水
(5)已装置的作用是___________。
20.利用下图所示装置进行铜与硝酸反应的实验。
(1)硝酸一般盛放在棕色试剂瓶中,请用化学方程式说明其原因:___________。
(2)使用稀硝酸进行实验:反应开始后,铜丝逐渐变细,有气泡产生,溶液变蓝。
①铜与稀硝酸反应的离子方程式为___________。
②实验中观察到试管中的气体略有红棕色,其原因是___________(用化学方程式表示)。
(3)使用浓硝酸进行实验:反应剧烈进行,铜丝逐渐变细,溶液变绿,试管上方出现红棕色气体。
①铜与浓硝酸反应的化学方程式为___________。
②某同学推测反应后溶液呈绿色的原因是在溶液中达到饱和,的饱和溶液呈黄色,硝酸铜溶液呈蓝色,两者混合后呈绿色。他取少量该绿色溶液,向其中加入适量水后溶液变为蓝色,可能的原因是___________(用化学方程式表示)。
21.A、B、C、D是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去)。
(1)若A是一种黄色单质固体,一定条件下B可以转化为C,则B→C的化学方程式为____________________。
(2)若A是一种活泼金属,C是淡黄色固体,则C的名称为_____________,C可用在矿山、坑道、潜水或宇宙飞船等缺氧的场合,将人们呼出的CO2再转换成O2,以供呼吸之用,请用化学方程式表示该反应原理_________________________________________。若生成1molO2,该反应转移电子的物质的量为_____________。
(3)若A为能使湿润的红色石蕊试纸变蓝的气体,C是红棕色气体。回答:
①A为_____________(填写化学式)。实验室用两种固体共热制取A,写出此化学方程式:_____________。
②D可以转化为B,写出D和铜单质反应生成B的离子方程式:____________________________________。
22.将一定质量的镁、铝合金,投入100mL一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加5mol/L NaOH溶液,生成的沉淀质量与加入NaOH溶液体积如图所示,由图中数据分析计算:(必须有计算过程,否则不得分)
(1)Al与NaOH反应的离子方程式_________________________
(2)铝的质量______________
(3)盐酸的物质的量浓度______________
答案
A 2.D 3.A 4.C 5.B 6.D 7.C 8.D 9.B 10.B 11.A 12.D 13.D 14.D 15.D 16.B 17.D 18.C
19.
(1)蒸馏烧瓶
(2)
(3)丁装置内充满黄绿色气体
(4) BD
(5)除去未反应的氯气,防止污染空气;防止水蒸气进入戊装置的试管中使产物水解
20.
(1)
(2)
(3)
21.
(1)
(2) 过氧化钠 2mol
(3) NH3
22.
(1)2Al+2OH-+2H2O=2AlO+3H2↑
(2)解:由图分析与氢氧化铝反应的NaOH的体积为180-160=20mL=0.02L,物质的量为0.02L×5mol/L=0.1mol,设原合金中有xmol的铝
、、
由方程式体现的关系可知,n(Al)=n[Al(OH)3] ,则x=0.1mol ,m(Al)=0.1mol×27g/mol=2.7g
(3)由图分析可知:加入160mL=0.16L的NaOH溶液时,沉淀完全,溶液中成分为NaCl,此时n(HCl)=n(NaOH) =0.16L×5mol/L=0.8mol, c(HCl)=n/V=0.8mol/L
同课章节目录
