高二化学《电能转化为化学能—电解》课件
文档属性
| 名称 | 高二化学《电能转化为化学能—电解》课件 |

|
|
| 格式 | zip | ||
| 文件大小 | 728.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-10-19 13:09:08 | ||
图片预览


文档简介
(共14张PPT)
第二节
电能转化为化学能—电解
第三课时
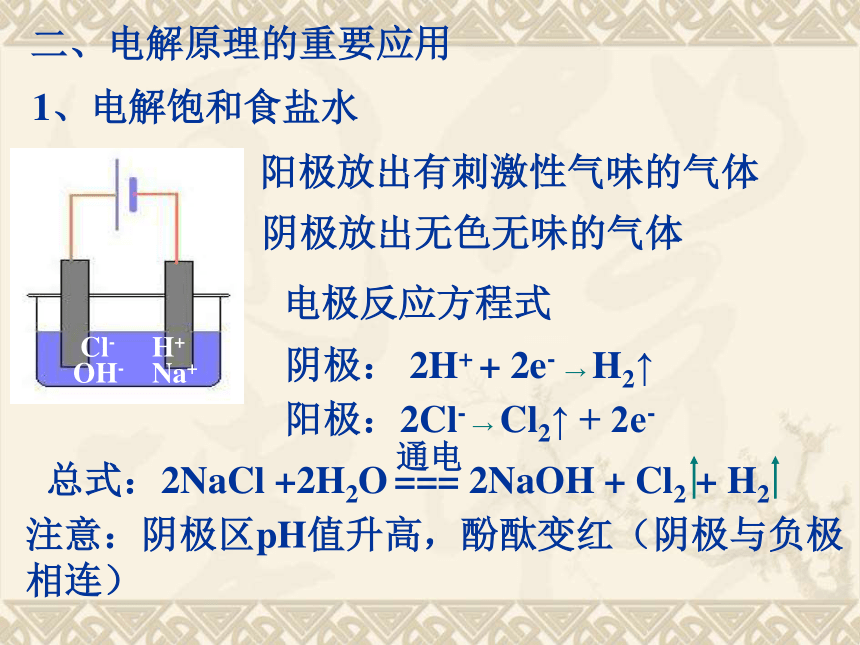
二、电解原理的重要应用
H+
Na+
Cl-
OH-
阳极放出有刺激性气味的气体
阴极放出无色无味的气体
1、电解饱和食盐水
电极反应方程式
阴极: 2H+ + 2e- → H2↑
阳极:2Cl- → Cl2↑ + 2e-
总式:2NaCl +2H2O === 2NaOH + Cl2 + H2
通电
注意:阴极区pH值升高,酚酞变红(阴极与负极相连)
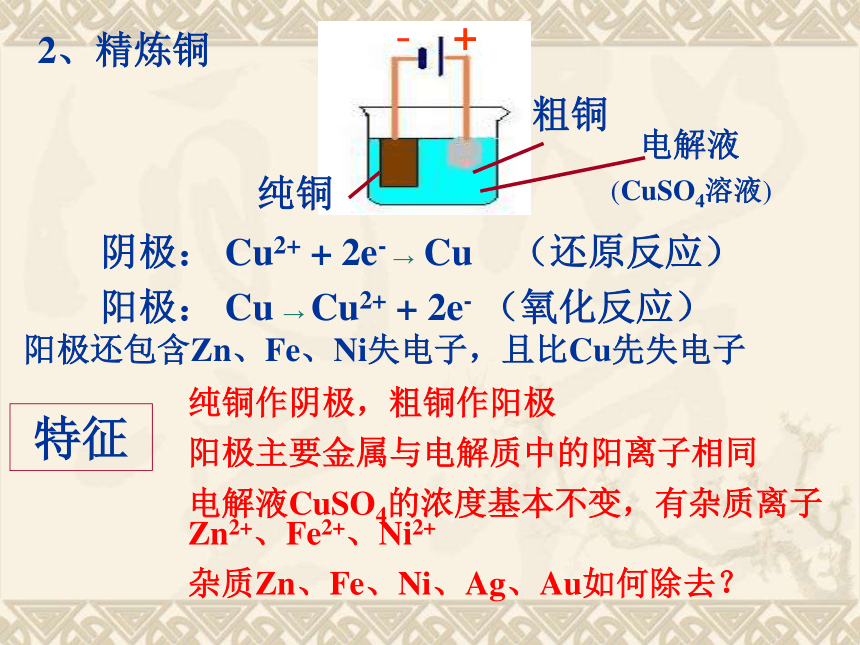
+
-
纯铜
粗铜
电解液
(CuSO4溶液)
阴极: Cu2+ + 2e- → Cu (还原反应)
阳极: Cu → Cu2+ + 2e- (氧化反应)
特征
纯铜作阴极,粗铜作阳极
阳极主要金属与电解质中的阳离子相同
电解液CuSO4的浓度基本不变,有杂质离子Zn2+、Fe2+、Ni2+
杂质Zn、Fe、Ni、Ag、Au如何除去?
2、精炼铜
阳极还包含Zn、Fe、Ni失电子,且比Cu先失电子
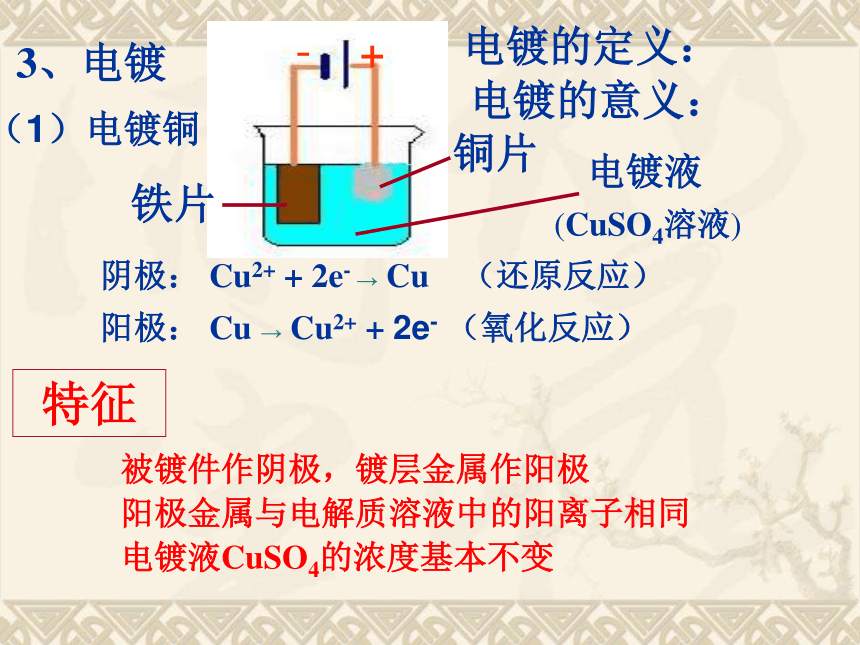
+
-
铁片
铜片
电镀液
(CuSO4溶液)
阴极: Cu2+ + 2e- → Cu (还原反应)
阳极: Cu → Cu2+ + 2e- (氧化反应)
特征
被镀件作阴极,镀层金属作阳极
阳极金属与电解质溶液中的阳离子相同
电镀液CuSO4的浓度基本不变
3、电镀
电镀的定义:
电镀的意义:
(1)电镀铜
+
-
铁片
锌片
电镀液
(ZnCl2溶液)
[Zn2+] [H+],则Zn2+放电
(2)电镀锌
阴极: Zn2+ + 2e- → Zn (还原反应)
因Zn2+离子浓度远大于H+离子浓度
阳极: Zn → Zn2+ + 2e- (氧化反应)
关于电镀的生产和污染及防治
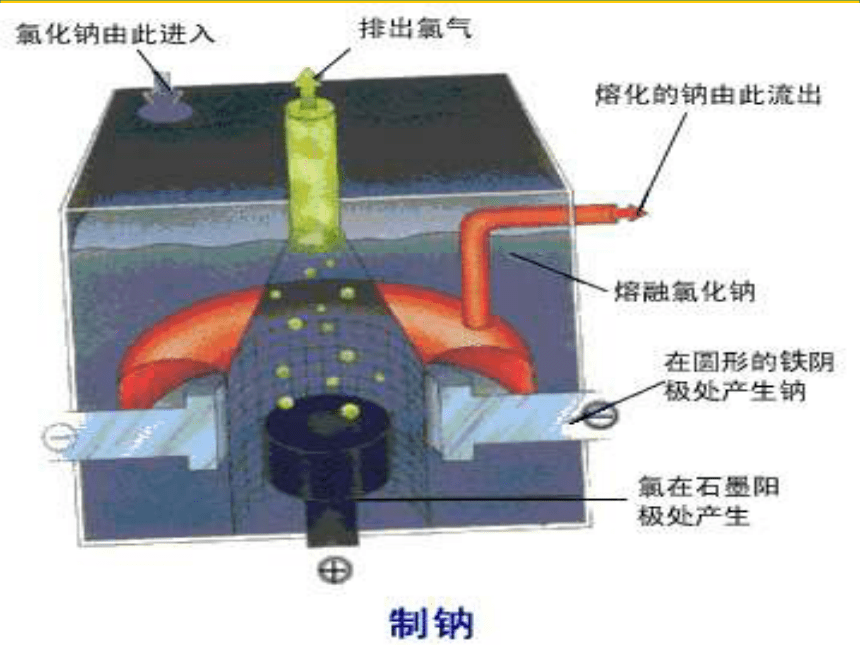
原电池、电解池、电镀池判定规律
若无外接电源, 可能是原电池,然后依据原
电池的形成条件分析判定,主要思路是“三看”
先看电极:两极为导体且活泼性不同
再看溶液:两极插入电解质溶液中
后看回路:形成闭合回路或两极接触
若有外接电源,两极插入电解质溶液中,
则可能是电解池或电镀池。当阳极金属与电解质溶液中的金属阳离子相同,则为电镀池,其余情况为电解池。
练习1:在50mL 0.2mol/L的硫酸铜溶液中插入两个电极,通电电解(不考虑水分蒸发),则:
⑴若两极均为铜片,试说明电解过程中溶液溶
质浓度将怎样变化?
⑵若阳极为纯锌,阴极为铜片,阳极反应式是 。
⑶如果两极均为铜片且不考虑H+在阴极上放电
当电路中有0.01mol电子通过时,阴极增重 g,
阴极上的电极反应式是 。
不变
0.32
Zn →Zn2+ +2e-
Cu2+ +2e-→Cu
练习2:下列叙述不正确的是 A.电解饱和食盐水时,用铁作阳极,Cl-发生氧化反应 B.电解法精炼铜时,纯铜作阴极,Cu2+发生还原反应 C.电镀铜时,金属铜作阳极,电镀液可用硫酸铜溶液 D.铜锌原电池中,锌作负极,电子从锌极流向铜极
A
练习3:某同学按右图所示的装置进行电解实验。下列说法正确的是 A、电解过程中,铜电极上有H2产生 B、电解初期,主反应方程式为:
Cu+H2SO4 CuSO4+H2↑ C、电解一定时间后,石墨电极上有铜析出 D、整个电解过程中,H+的浓度不断增大
BC
练习4:某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是 A、铅笔端作阳极,发生还原反应
B、铂片端作阴极,发生氧化反应 C、铅笔端有少量的氯气产生
D、a点是负极,b点是正极
D
第二节
电能转化为化学能—电解
第三课时
二、电解原理的重要应用
H+
Na+
Cl-
OH-
阳极放出有刺激性气味的气体
阴极放出无色无味的气体
1、电解饱和食盐水
电极反应方程式
阴极: 2H+ + 2e- → H2↑
阳极:2Cl- → Cl2↑ + 2e-
总式:2NaCl +2H2O === 2NaOH + Cl2 + H2
通电
注意:阴极区pH值升高,酚酞变红(阴极与负极相连)
+
-
纯铜
粗铜
电解液
(CuSO4溶液)
阴极: Cu2+ + 2e- → Cu (还原反应)
阳极: Cu → Cu2+ + 2e- (氧化反应)
特征
纯铜作阴极,粗铜作阳极
阳极主要金属与电解质中的阳离子相同
电解液CuSO4的浓度基本不变,有杂质离子Zn2+、Fe2+、Ni2+
杂质Zn、Fe、Ni、Ag、Au如何除去?
2、精炼铜
阳极还包含Zn、Fe、Ni失电子,且比Cu先失电子
+
-
铁片
铜片
电镀液
(CuSO4溶液)
阴极: Cu2+ + 2e- → Cu (还原反应)
阳极: Cu → Cu2+ + 2e- (氧化反应)
特征
被镀件作阴极,镀层金属作阳极
阳极金属与电解质溶液中的阳离子相同
电镀液CuSO4的浓度基本不变
3、电镀
电镀的定义:
电镀的意义:
(1)电镀铜
+
-
铁片
锌片
电镀液
(ZnCl2溶液)
[Zn2+] [H+],则Zn2+放电
(2)电镀锌
阴极: Zn2+ + 2e- → Zn (还原反应)
因Zn2+离子浓度远大于H+离子浓度
阳极: Zn → Zn2+ + 2e- (氧化反应)
关于电镀的生产和污染及防治
原电池、电解池、电镀池判定规律
若无外接电源, 可能是原电池,然后依据原
电池的形成条件分析判定,主要思路是“三看”
先看电极:两极为导体且活泼性不同
再看溶液:两极插入电解质溶液中
后看回路:形成闭合回路或两极接触
若有外接电源,两极插入电解质溶液中,
则可能是电解池或电镀池。当阳极金属与电解质溶液中的金属阳离子相同,则为电镀池,其余情况为电解池。
练习1:在50mL 0.2mol/L的硫酸铜溶液中插入两个电极,通电电解(不考虑水分蒸发),则:
⑴若两极均为铜片,试说明电解过程中溶液溶
质浓度将怎样变化?
⑵若阳极为纯锌,阴极为铜片,阳极反应式是 。
⑶如果两极均为铜片且不考虑H+在阴极上放电
当电路中有0.01mol电子通过时,阴极增重 g,
阴极上的电极反应式是 。
不变
0.32
Zn →Zn2+ +2e-
Cu2+ +2e-→Cu
练习2:下列叙述不正确的是 A.电解饱和食盐水时,用铁作阳极,Cl-发生氧化反应 B.电解法精炼铜时,纯铜作阴极,Cu2+发生还原反应 C.电镀铜时,金属铜作阳极,电镀液可用硫酸铜溶液 D.铜锌原电池中,锌作负极,电子从锌极流向铜极
A
练习3:某同学按右图所示的装置进行电解实验。下列说法正确的是 A、电解过程中,铜电极上有H2产生 B、电解初期,主反应方程式为:
Cu+H2SO4 CuSO4+H2↑ C、电解一定时间后,石墨电极上有铜析出 D、整个电解过程中,H+的浓度不断增大
BC
练习4:某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是 A、铅笔端作阳极,发生还原反应
B、铂片端作阴极,发生氧化反应 C、铅笔端有少量的氯气产生
D、a点是负极,b点是正极
D
