1.3.2气体摩尔体积(教学课件)高中化学鲁科版(2019)必修第一册
文档属性
| 名称 | 1.3.2气体摩尔体积(教学课件)高中化学鲁科版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-13 13:26:58 | ||
图片预览







文档简介
(共62张PPT)
鲁科版必修第一册
第3节 化学中常用的物理量—物质的量
第二课时 气体摩尔体积
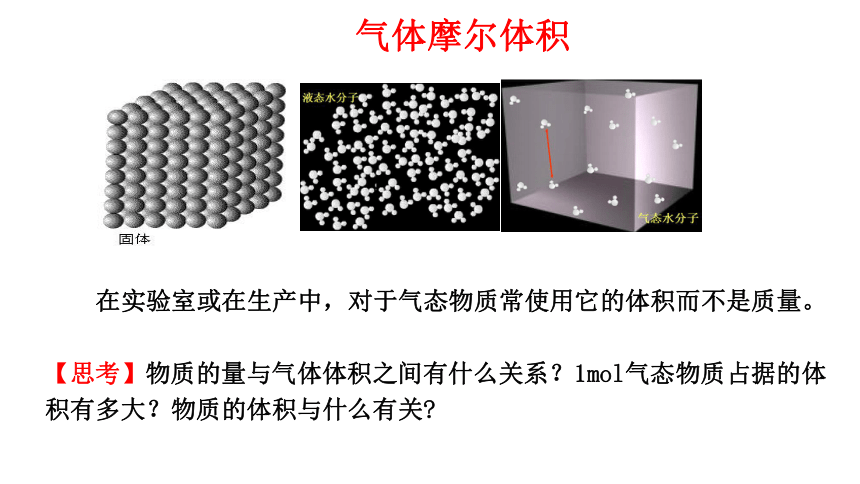
在实验室或在生产中,对于气态物质常使用它的体积而不是质量。
【思考】物质的量与气体体积之间有什么关系?1mol气态物质占据的体积有多大?物质的体积与什么有关
气体摩尔体积
1.理解气体摩尔体积的概念。
2.掌握物质的量、气体摩尔体积、气体体积之间的关系。
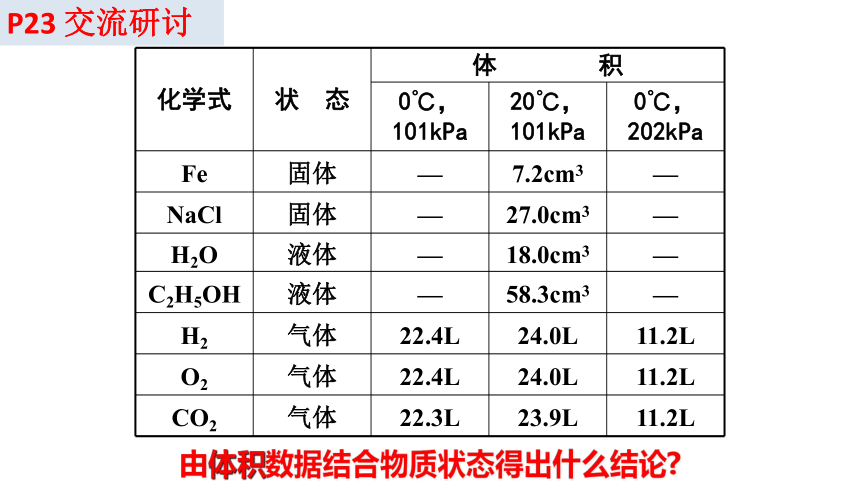
化学式 状 态 体 积 0℃,101kPa 20℃,101kPa 0℃,202kPa
Fe 固体 — 7.2cm3 —
NaCl 固体 — 27.0cm3 —
H2O 液体 — 18.0cm3 —
C2H5OH 液体 — 58.3cm3 —
H2 气体 22.4L 24.0L 11.2L
O2 气体 22.4L 24.0L 11.2L
CO2 气体 22.3L 23.9L 11.2L
P23 交流研讨
由体积数据结合物质状态得出什么结论
在相同的温度和压强下,1mol任何气体所占的体积 近似相等。
利用表中数据可以得出:
同种气体的体积随温度、压强的改变而改变。
在相同条件下,1mol气体所占体积比1mol固体或液体所占的体积大得多。
在相同的温度和压强下,1mol的不同固体或液体的体积是不同的。
1. 为什么1mol不同状态的物质体积不同;
2. 为什么1mol不同物质的气体体积近似相等,且比固、液物质体积大的多;
3. 影响物质体积的因素究竟是什么?
1mol几种不同物质的体积
网
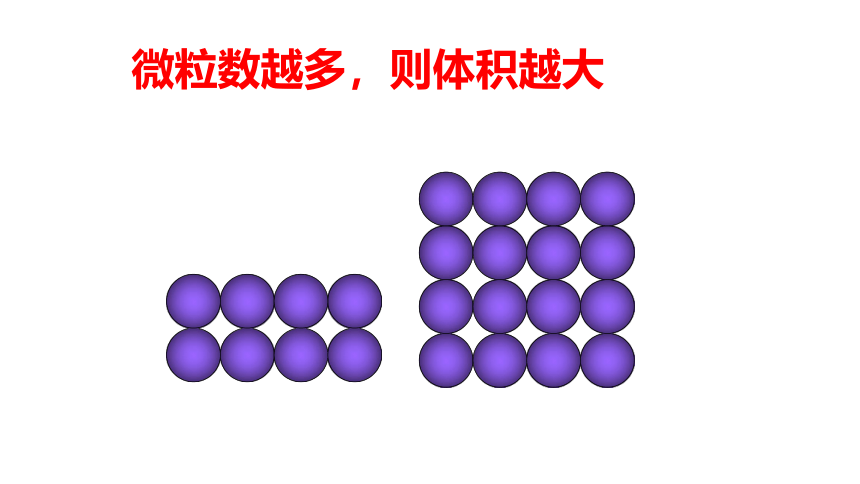
微粒数越多,则体积越大
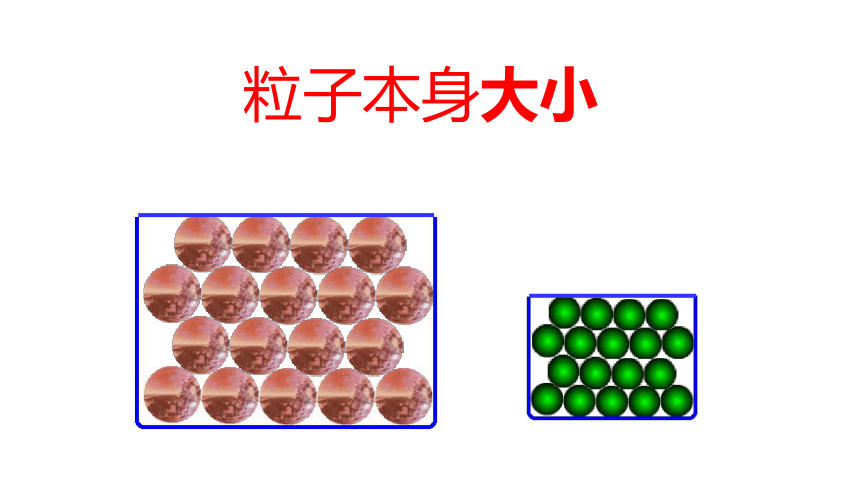
粒子本身大小
粒子间的距离
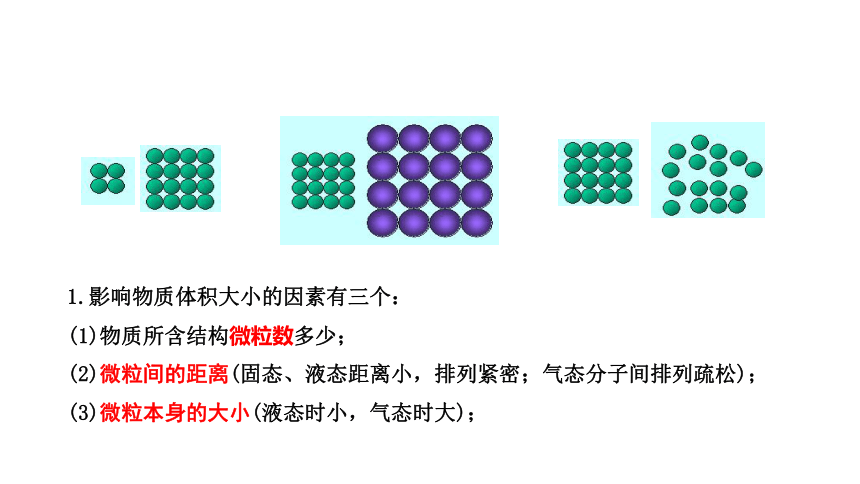
1.影响物质体积大小的因素有三个:
(1)物质所含结构微粒数多少;
(2)微粒间的距离(固态、液态距离小,排列紧密;气态分子间排列疏松);
(3)微粒本身的大小(液态时小,气态时大);
构成固态结构微粒间的距离很小
构成液态结构微粒间的距离也小
近似相等
温度
压强
2.影响固(液)体积大小的主要因素:
(1).粒子数目;
(2).粒子的大小;
在相同的温度和压强下,1mol的不同固体或液体的体积是不同的。
气 体 体 积
气体分子在不断的运动着,它们倾向于充满空间的任何角落。
气体体积实际是指气体分子所能达到的空间,它远大于气体分子
本身体积的总和。
气体的体积总是和温度、压强联系在一起的,受热易膨胀,
加压易收缩。
3.影响气体体积大小的主要因素:
(1).粒子数目;
(2).粒子间的距离
气体分子间距离很大
温度、 压强 化学式 0℃ 101kPa 20℃ 101kPa 0℃ 202kPa
273℃ 202kPa
H2
O2
CO2
24.0L
24.0L
23.9L
22.4L
22.4L
22.4L
11.2L
11.2L
11.2L
观察1mol气体的体积,总结规律
【小结】一定温度、压强下,1mol任何气体所占的体积相同。
22.4L
22.4L
22.3L
3.影响气体体积大小的主要因素:
(1).粒子数目;
(2).粒子间的距离
当分子数目相同时,气体体积的大小主要取决于气体分子之间的距离,而不是分子本身的大小;而气体之间的距离与温度、压强有关,当T、P相同时,气体分子之间的距离相等,体积相同。
科
气体
同温同压下:
1、分子数目
2、分子本身大小
3、分子间距离
结论:同温同压下1mol任何气体的体积约相等
相等
忽略
相等
1mol
二、气体摩尔体积
1.概念:单位物质的量的气体所占有的体积叫作气体摩尔体积。
2.符号:Vm
3.定义式: Vm =V(气体)/n(气体)
4.单位:升/摩尔(L/mol或L·mol-1) ;米3/摩尔(m3/mol或m3 ·mol-1)。
5.气体在标准状况下的摩尔体积约是22.4L。
标准状况下1mol气体体积与足球体积大小的比较
0℃、101kPa
6.注意事项:
①.条件:是在标准状况(0℃、101kPa)下;
②.研究对象:任何气体,可以是单一气体也可以是混合气体;
③.物质的量:1mol;
④.所占体积:约为22.4L。
标准状况下,气体摩尔体积约为
22.4 L·mol-1。
注意哦!
即STP,指温度为0℃,压强为101kPa的状况
注意:
1、气体不同温度和压强下摩尔体积不同
2、气体的体积,在同温同压下只与气体的微粒数目有关而与气体分子的种类无关
讨论:
有人说:“非标准状况下,1mol气体的体积一定不是22.4L。”这一说法对吗?为什么?
×,物质应是气体
×,未指明条件标况
(1).在标准状况下,1 mol任何物质的体积都约为22.4 L。
(2).1 mol气体的体积约为22.4 L。
(3).在标准状况下,1 mol O2和N2混合气(任意比)的体积约为22.4 L。
√,气体体积与分子种类无关
(4).22.4 L气体所含分子数一定大于11.2 L气体所含的分子数。
×,未指明气体体积是否在相同条件下测定
(5).任何条件下,气体的摩尔体积都是22.4 L。
(6).只有在标准状况下,气体的摩尔体积才能是22.4 L。
×,在标况下
×,不一定
[练习]判断正误
学
练习1. 在标准状况下,2.2gCO2的体积是多少?
n(CO2)=
m [CO2]
M[CO2]
=
2.2 g
44g·mol -1
=
0.05mol
V(CO2) =
n(CO2)·Vm
= 0.05 mol×22.4 L / mol
= 1.12L
解:
n =
V
Vm
解:
=
0.112 L
22.4L·mol -1
= 0.005mol
n = m / M
M =
0.14 g
0.005 mol
= 28g/mol
练习2:标准状况下,112 mL 某气体的质量为 0.14g,则其摩尔质量为_______________,相对分子质量为___________。
N
n
m
÷NA
×M
×NA
÷M
V
(气体)
×22.4
(标况)
÷22.4
(标况)
N,n,m,V 之间的相互转化
质量(g)
物质的量
(mol)
微粒数
÷摩尔质量
×摩尔质量
×阿伏加德罗常数
气体体积
×气体摩
尔体 积
以0.012kg12C中所含的原子数目作为标准来衡量其他微粒集体所含微粒数目多少的物理量。
物质的量的单位, 1mol任何物质中都含有阿伏加德罗常数个微粒
6.02×1023mol-1, 6.02×1023是0.012kg12C所含的碳原子数。
单位物质的量的物质所具有的质量。在以g/mol为单位时,数值上等于该物质的相对原子质量或相对分子质量。
一定的温度和压强下,单位物质的量的气体所占的体积。STP时,约为22.4L/mol。
÷阿伏伽德罗常数
÷气体摩
尔体积
[思考]同温同压下,如果气体的体积相同则气体的物质的量是否也相同呢 所含的分子数呢
请阅读课本第25页资料在线内容!
2、相对密度:同温同压下,两种气体的密度之比。
克拉珀龙方程:P V= n R T
压强
atm
体积
L
物质的量
mol
常数
0.082
温度
K
PV = RT
m
M
PM = RT
m
V
PM =ρRT
同温同压下:
=
M1
M2
ρ1
ρ2
=相对密度
1.下列有关气体摩尔体积的描述中正确的是( )
A.1molH2的质量是1g,它所占的体积是22.4L
B.通常状况下的气体摩尔体积约为22.4L
C.标准状况下,1mol任何气体所占的体积都约为22.4L
D.相同物质的量的气体,气体摩尔体积也相同
C
2.下列说法正确的是( )
A.在标准状况下,1mol水的体积是22.4L
B.1molH2所占的体积约为22.4L
C.在标准状况下,NA个分子所占的体积约为22.4L
D.在标准状况下,1molNH3和CO混合气体所占的体积约为22.4L
D
3.下列叙述正确的是( )
A.同温同压下,相同体积的气体,其物质的量一定相等
B.任何条件下,等物质的量的甲烷和一氧化碳所含的分子数一定相等
C.1L一氧化碳气体一定比1L氧气的质量小
D.相同条件下的一氧化碳气体和氮气,若体积相等,则质量一定相等
A
4.在标况下
(1)0.5molHCl气体占有的体积是
(2)33.6LH2 的物质的量是
5.同温同压下,质量相同的N2、CO2、Cl2、 CH4、O2五种气体所占的体积由大到小的顺序是( )
CH4、N2、O2、CO2、Cl2
11.2L
1.5mol
一、有关气体密度的计算
2.气体的相对密度(D)
1.气体在标况下的密度
二、混合气体的平均摩尔质量(M)
A
例1:有SO2与CO2组成的混合气体,对H2的相对密度为27,求SO2与CO2的质量比 ( )
A 16:11 B 11:16 C 1:1 D 11:8
练习:
1.已知标况时某气体的密度ρ标(g·L-1),则该气体的摩尔质量M为 。
2.若相同条件下,气体1对气体2的相对密度D,则M1与M2及D的关系为 。
例题:150 ℃时碳酸铵完全分解产生气态混合物,求分解后所得气体的平均相对分子质量及其对H2的相对密度。
鲁科版必修第一册
第3节 化学中常用的物理量—物质的量
第二课时 气体摩尔体积
在实验室或在生产中,对于气态物质常使用它的体积而不是质量。
【思考】物质的量与气体体积之间有什么关系?1mol气态物质占据的体积有多大?物质的体积与什么有关
气体摩尔体积
1.理解气体摩尔体积的概念。
2.掌握物质的量、气体摩尔体积、气体体积之间的关系。
化学式 状 态 体 积 0℃,101kPa 20℃,101kPa 0℃,202kPa
Fe 固体 — 7.2cm3 —
NaCl 固体 — 27.0cm3 —
H2O 液体 — 18.0cm3 —
C2H5OH 液体 — 58.3cm3 —
H2 气体 22.4L 24.0L 11.2L
O2 气体 22.4L 24.0L 11.2L
CO2 气体 22.3L 23.9L 11.2L
P23 交流研讨
由体积数据结合物质状态得出什么结论
在相同的温度和压强下,1mol任何气体所占的体积 近似相等。
利用表中数据可以得出:
同种气体的体积随温度、压强的改变而改变。
在相同条件下,1mol气体所占体积比1mol固体或液体所占的体积大得多。
在相同的温度和压强下,1mol的不同固体或液体的体积是不同的。
1. 为什么1mol不同状态的物质体积不同;
2. 为什么1mol不同物质的气体体积近似相等,且比固、液物质体积大的多;
3. 影响物质体积的因素究竟是什么?
1mol几种不同物质的体积
网
微粒数越多,则体积越大
粒子本身大小
粒子间的距离
1.影响物质体积大小的因素有三个:
(1)物质所含结构微粒数多少;
(2)微粒间的距离(固态、液态距离小,排列紧密;气态分子间排列疏松);
(3)微粒本身的大小(液态时小,气态时大);
构成固态结构微粒间的距离很小
构成液态结构微粒间的距离也小
近似相等
温度
压强
2.影响固(液)体积大小的主要因素:
(1).粒子数目;
(2).粒子的大小;
在相同的温度和压强下,1mol的不同固体或液体的体积是不同的。
气 体 体 积
气体分子在不断的运动着,它们倾向于充满空间的任何角落。
气体体积实际是指气体分子所能达到的空间,它远大于气体分子
本身体积的总和。
气体的体积总是和温度、压强联系在一起的,受热易膨胀,
加压易收缩。
3.影响气体体积大小的主要因素:
(1).粒子数目;
(2).粒子间的距离
气体分子间距离很大
温度、 压强 化学式 0℃ 101kPa 20℃ 101kPa 0℃ 202kPa
273℃ 202kPa
H2
O2
CO2
24.0L
24.0L
23.9L
22.4L
22.4L
22.4L
11.2L
11.2L
11.2L
观察1mol气体的体积,总结规律
【小结】一定温度、压强下,1mol任何气体所占的体积相同。
22.4L
22.4L
22.3L
3.影响气体体积大小的主要因素:
(1).粒子数目;
(2).粒子间的距离
当分子数目相同时,气体体积的大小主要取决于气体分子之间的距离,而不是分子本身的大小;而气体之间的距离与温度、压强有关,当T、P相同时,气体分子之间的距离相等,体积相同。
科
气体
同温同压下:
1、分子数目
2、分子本身大小
3、分子间距离
结论:同温同压下1mol任何气体的体积约相等
相等
忽略
相等
1mol
二、气体摩尔体积
1.概念:单位物质的量的气体所占有的体积叫作气体摩尔体积。
2.符号:Vm
3.定义式: Vm =V(气体)/n(气体)
4.单位:升/摩尔(L/mol或L·mol-1) ;米3/摩尔(m3/mol或m3 ·mol-1)。
5.气体在标准状况下的摩尔体积约是22.4L。
标准状况下1mol气体体积与足球体积大小的比较
0℃、101kPa
6.注意事项:
①.条件:是在标准状况(0℃、101kPa)下;
②.研究对象:任何气体,可以是单一气体也可以是混合气体;
③.物质的量:1mol;
④.所占体积:约为22.4L。
标准状况下,气体摩尔体积约为
22.4 L·mol-1。
注意哦!
即STP,指温度为0℃,压强为101kPa的状况
注意:
1、气体不同温度和压强下摩尔体积不同
2、气体的体积,在同温同压下只与气体的微粒数目有关而与气体分子的种类无关
讨论:
有人说:“非标准状况下,1mol气体的体积一定不是22.4L。”这一说法对吗?为什么?
×,物质应是气体
×,未指明条件标况
(1).在标准状况下,1 mol任何物质的体积都约为22.4 L。
(2).1 mol气体的体积约为22.4 L。
(3).在标准状况下,1 mol O2和N2混合气(任意比)的体积约为22.4 L。
√,气体体积与分子种类无关
(4).22.4 L气体所含分子数一定大于11.2 L气体所含的分子数。
×,未指明气体体积是否在相同条件下测定
(5).任何条件下,气体的摩尔体积都是22.4 L。
(6).只有在标准状况下,气体的摩尔体积才能是22.4 L。
×,在标况下
×,不一定
[练习]判断正误
学
练习1. 在标准状况下,2.2gCO2的体积是多少?
n(CO2)=
m [CO2]
M[CO2]
=
2.2 g
44g·mol -1
=
0.05mol
V(CO2) =
n(CO2)·Vm
= 0.05 mol×22.4 L / mol
= 1.12L
解:
n =
V
Vm
解:
=
0.112 L
22.4L·mol -1
= 0.005mol
n = m / M
M =
0.14 g
0.005 mol
= 28g/mol
练习2:标准状况下,112 mL 某气体的质量为 0.14g,则其摩尔质量为_______________,相对分子质量为___________。
N
n
m
÷NA
×M
×NA
÷M
V
(气体)
×22.4
(标况)
÷22.4
(标况)
N,n,m,V 之间的相互转化
质量(g)
物质的量
(mol)
微粒数
÷摩尔质量
×摩尔质量
×阿伏加德罗常数
气体体积
×气体摩
尔体 积
以0.012kg12C中所含的原子数目作为标准来衡量其他微粒集体所含微粒数目多少的物理量。
物质的量的单位, 1mol任何物质中都含有阿伏加德罗常数个微粒
6.02×1023mol-1, 6.02×1023是0.012kg12C所含的碳原子数。
单位物质的量的物质所具有的质量。在以g/mol为单位时,数值上等于该物质的相对原子质量或相对分子质量。
一定的温度和压强下,单位物质的量的气体所占的体积。STP时,约为22.4L/mol。
÷阿伏伽德罗常数
÷气体摩
尔体积
[思考]同温同压下,如果气体的体积相同则气体的物质的量是否也相同呢 所含的分子数呢
请阅读课本第25页资料在线内容!
2、相对密度:同温同压下,两种气体的密度之比。
克拉珀龙方程:P V= n R T
压强
atm
体积
L
物质的量
mol
常数
0.082
温度
K
PV = RT
m
M
PM = RT
m
V
PM =ρRT
同温同压下:
=
M1
M2
ρ1
ρ2
=相对密度
1.下列有关气体摩尔体积的描述中正确的是( )
A.1molH2的质量是1g,它所占的体积是22.4L
B.通常状况下的气体摩尔体积约为22.4L
C.标准状况下,1mol任何气体所占的体积都约为22.4L
D.相同物质的量的气体,气体摩尔体积也相同
C
2.下列说法正确的是( )
A.在标准状况下,1mol水的体积是22.4L
B.1molH2所占的体积约为22.4L
C.在标准状况下,NA个分子所占的体积约为22.4L
D.在标准状况下,1molNH3和CO混合气体所占的体积约为22.4L
D
3.下列叙述正确的是( )
A.同温同压下,相同体积的气体,其物质的量一定相等
B.任何条件下,等物质的量的甲烷和一氧化碳所含的分子数一定相等
C.1L一氧化碳气体一定比1L氧气的质量小
D.相同条件下的一氧化碳气体和氮气,若体积相等,则质量一定相等
A
4.在标况下
(1)0.5molHCl气体占有的体积是
(2)33.6LH2 的物质的量是
5.同温同压下,质量相同的N2、CO2、Cl2、 CH4、O2五种气体所占的体积由大到小的顺序是( )
CH4、N2、O2、CO2、Cl2
11.2L
1.5mol
一、有关气体密度的计算
2.气体的相对密度(D)
1.气体在标况下的密度
二、混合气体的平均摩尔质量(M)
A
例1:有SO2与CO2组成的混合气体,对H2的相对密度为27,求SO2与CO2的质量比 ( )
A 16:11 B 11:16 C 1:1 D 11:8
练习:
1.已知标况时某气体的密度ρ标(g·L-1),则该气体的摩尔质量M为 。
2.若相同条件下,气体1对气体2的相对密度D,则M1与M2及D的关系为 。
例题:150 ℃时碳酸铵完全分解产生气态混合物,求分解后所得气体的平均相对分子质量及其对H2的相对密度。
