金属的性质
图片预览




文档简介
(共34张PPT)
第三章第一节
金属的化学性质
青铜器
铁器
铝合金
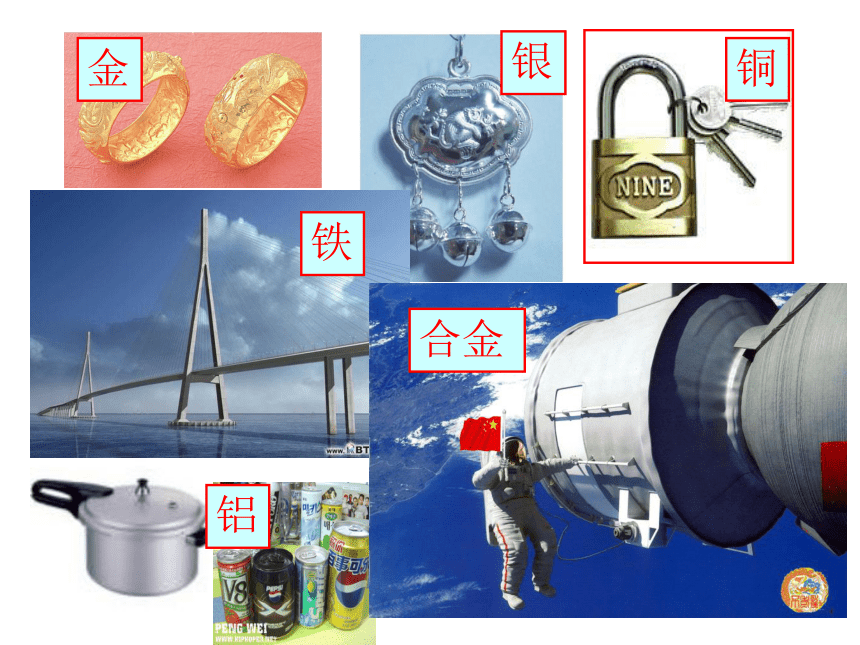
金
银
铜
铁
铝
合金
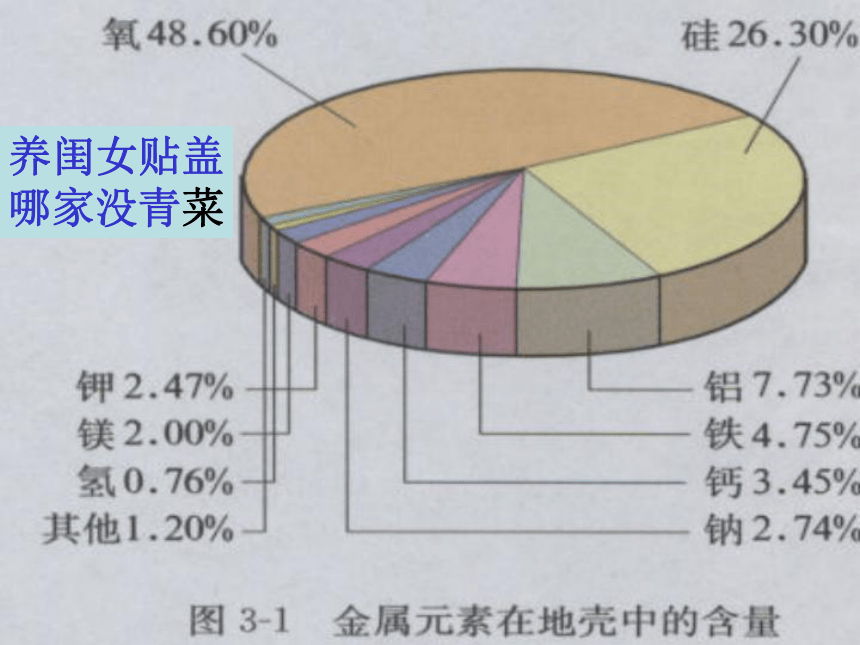
养闺女贴盖
哪家没青菜
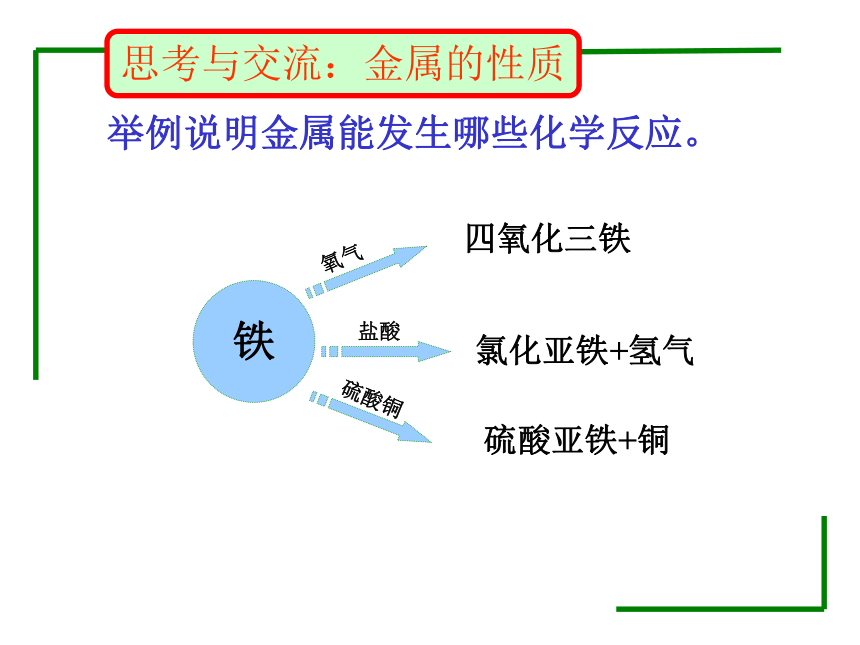
思考与交流:金属的性质
铁
氧气
盐酸
硫酸铜
四氧化三铁
氯化亚铁+氢气
硫酸亚铁+铜
举例说明金属能发生哪些化学反应。
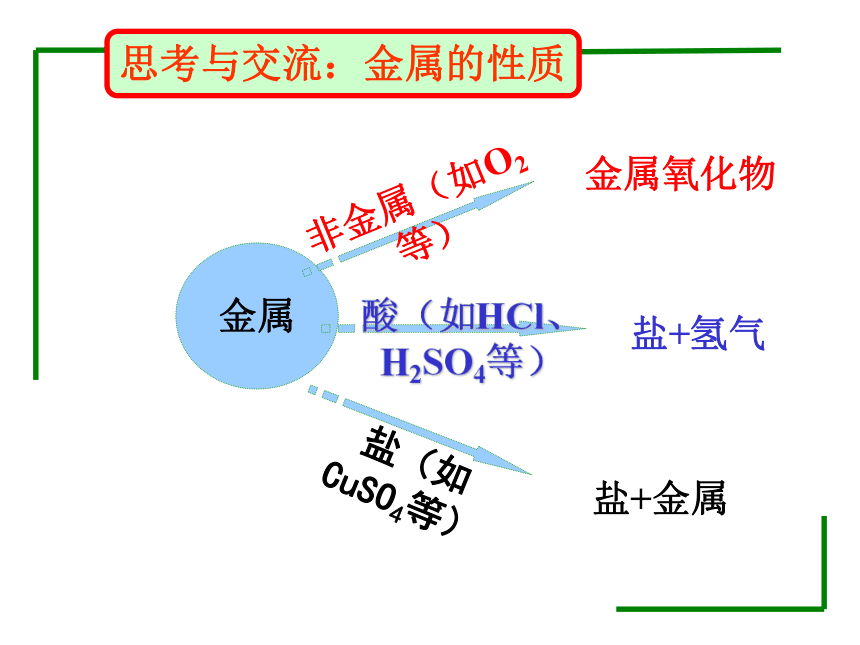
思考与交流:金属的性质
金属
非金属(如O2等)
酸(如HCl、H2SO4等)
盐(如CuSO4等)
金属氧化物
盐+氢气
盐+金属
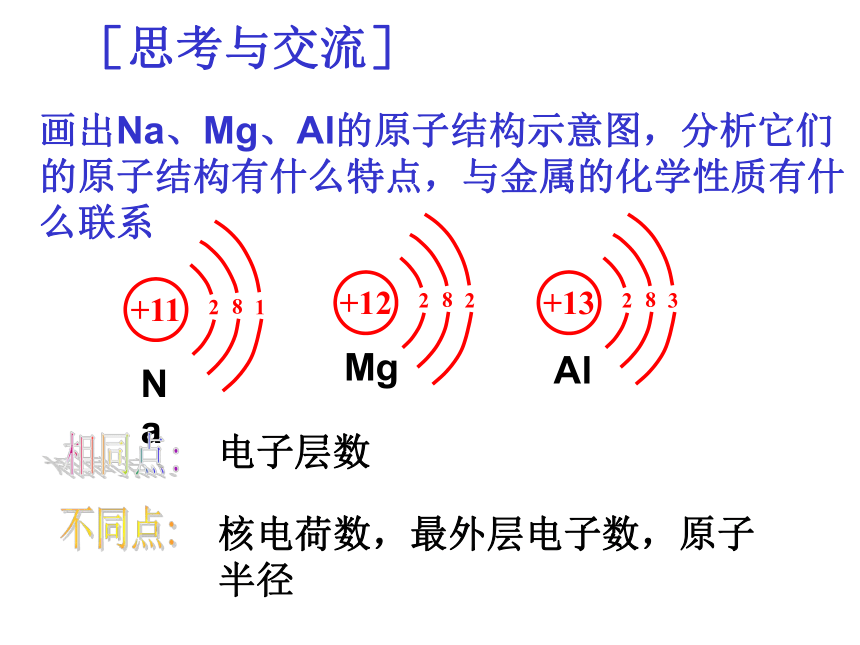
画出Na、Mg、Al的原子结构示意图,分析它们的原子结构有什么特点,与金属的化学性质有什么联系
[思考与交流]
Na
+13
2
8
3
+11
2
8
1
+12
2
8
2
Mg
Al
核电荷数,最外层电子数,原子半径
电子层数
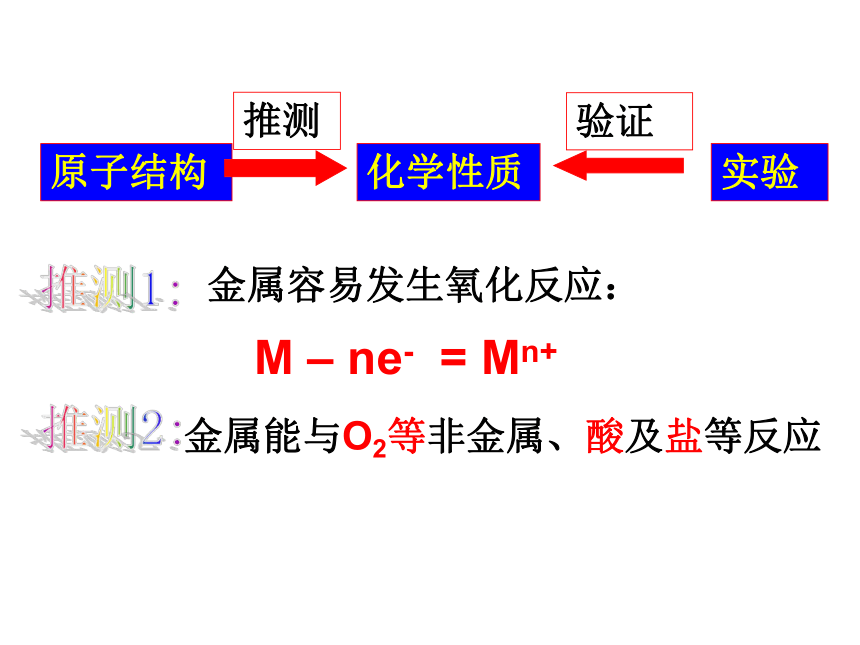
原子结构
化学性质
金属容易发生氧化反应:
金属能与O2等非金属、酸及盐等反应
实验
推测
验证
M – ne- = Mn+
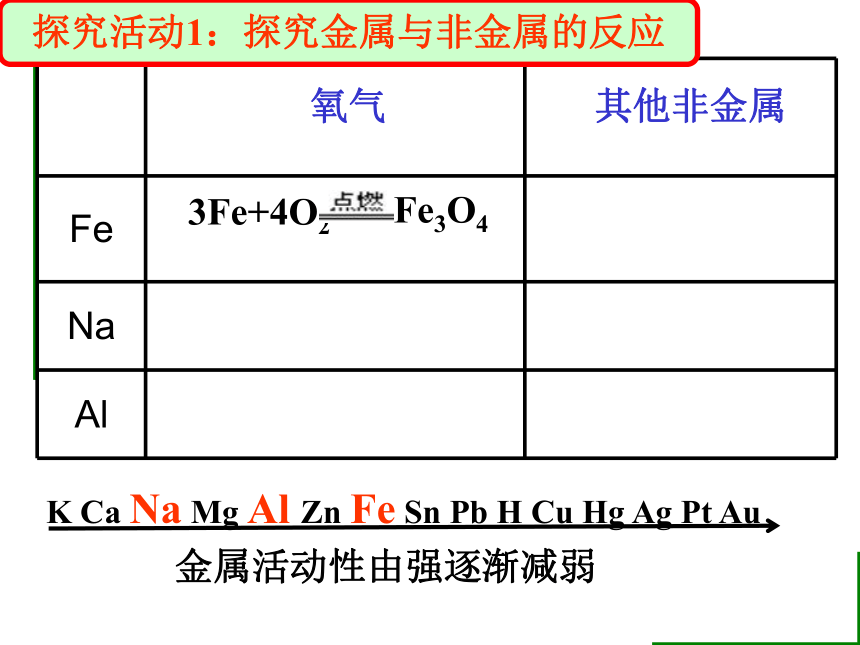
Fe
Na
Al
3Fe+4O2
Fe3O4
K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
氧气
其他非金属
探究活动1:探究金属与非金属的反应
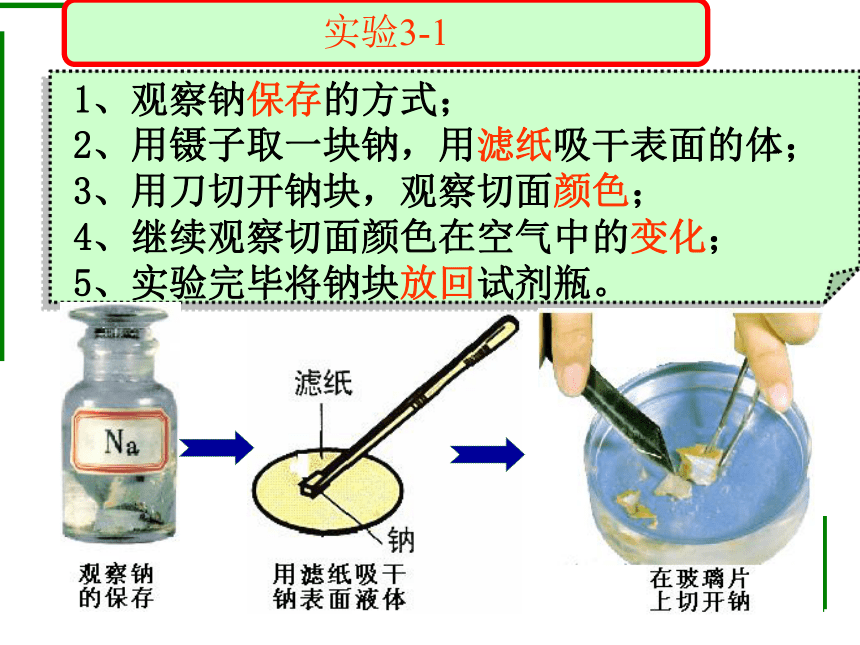
1、观察钠保存的方式;
2、用镊子取一块钠,用滤纸吸干表面的体;
3、用刀切开钠块,观察切面颜色;
4、继续观察切面颜色在空气中的变化;
5、实验完毕将钠块放回试剂瓶。
实验3-1
轻:密度比煤油大;
软:可以用刀切割;
白:银白色固体,有金属光泽;
……
银白色、有光泽
变暗
钠的物理性质
把一小块金属钠放在坩埚中,加
热,有什么现象?
钠在空气中加热时,熔化成________,燃烧时,发出___色火焰,在玻璃管内壁上有____色固体出现。
闪亮的小球
黄
淡黄
演示
实验
实验3-2
点燃
(淡黄色)
过氧化钠
+1 -2
+1 -1
==2Na2O (白色)
氧化钠
点燃:
2Na+O2 == Na2O2
常温:
4Na+O2
1. 与O2反应
Fe
Na
Al
3Fe+4O2
Fe3O4
氧气
其他非金属
4Na+O2=2Na2O
2Na+O2
Na2O2
科学探究:加热铝箔 P48
铝易与O2反应,加热时,铝熔化,由于外层的氧化膜为Al2O3,Al2O3的熔点比铝高,所以熔化的铝并不滴落。
Fe
Na
Al
3Fe+4O2
Fe3O4
氧气
其他非金属
4Na+O2=2Na2O
2Na+O2
Na2O2
Na2S
2Na+S
2Na+Cl2=2NaCl
探究活动2:探究金属与酸和水的反应
Fe+2HCl=
FeCl2+H2↑
2Al+6HCl =
2AlCl3+3H2↑
2Na+2HCl=
2NaCl+H2↑
与盐酸
Na
Al
Fe
与水
通常情况下不与水反应
探究活动2:探究金属与酸和水的反应
将一小块金属钠投入滴有酚酞的水中。
探究实验
1、用镊子取一块钠,用滤纸吸干表面的煤油;
2、将钠放在玻璃片上,切绿豆粒大小的钠块;
3、用烧杯取1/3杯水,然后滴加几滴酚酞;
4、将钠块投入水中;
5、仔细观察实验的现象。
探究
方案:
实验现象
原因及结论
钠浮在水面上
钠的密度比水小
立刻熔成一个闪亮的小球
钠的熔点较低,与水反应放热
在水面上四处游动
产生的气体推动金属钠来回游动
发出嘶嘶声音
剧烈反应,产生气体
溶液由无色变为红色
钠与水反应生成碱性物质
钠与水的反应
与水反应
现象:浮、熔、红、游、嘶
2Na+2H2O==2NaOH+H2↑
2e-
2Na+2H2O==2Na++2OH-+H2↑
2.金属与酸和水的反应
Fe Al Na
与盐酸
与水
Fe+2HCl=
FeCl2+H2↑
2Al+6HCl=
2AlCl3+3H2↑
2Na+2HCl=
2NaCl+H2↑
2Na+2H2O=
2NaOH+H2↑
通常情况下不与水反应
若酸过量,只考虑与酸反应
若钠过量,则过量的钠还要与水反应。
注意:
3Fe+4H2O(g)==== Fe3O4+4H2
△
科学探究:铁与水蒸气反应 P50
探究3:探究金属与盐的反应
Fe Al Na
与CuSO4
溶液
Fe+CuSO4=
FeSO4+Cu
2Al+3CuSO4=
Al2(SO4)3+3Cu
*钠与盐溶液反应时,
先与水反应,
不能置换盐中的金属。
2Na+2H2O==2NaOH+H2↑
CuSO4+2NaOH==Na2SO4 +Cu(OH)2↓
___+______________________________________________________
2Na+2H2O+CuSO4==Na2SO4 +Cu(OH)2 ↓ +H2 ↑
4. 钠与盐溶液的反应
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑
Al与强碱溶液反应化学方程式:
4.特殊反应:铝与氢氧化钠反应
2Al + 2OH- + 2H2O =2AlO2- + 3H2↑
①Al与NaOH水溶液的反应中Al显示什么性质?根据是什么?
②上述反应产物中的NaAlO2是如何产生的?
思考:
②以上反应不是一步反应,而是多步反应的结果: 2Al+6H2O=2Al(OH)3+3H2↑ Al(OH)3+NaOH=NaAlO2+2H2O,因而只有水为氧化剂。
①Al显还原性,因其化合价升高。
2.金属与酸和水的反应
Fe Al Na
与盐酸
与水
Fe+2HCl=FeCl2+H2↑
2Al+6HCl=2AlCl3+3H2↑
2Na+2HCl=2NaCl+H2↑
2Na+2H2O=2NaOH+H2↑
3Fe+4H2O(g)
Fe3O4+4 H2
1.本节课,你学到了哪些知识
2.本节课,你学会了哪些方法
相信你会总结
1.完成课本53页1-4题。
2.课外探究Na与硫酸铜溶液的反应。
课后学习
练一练
1.下列关于钠的叙述中,不正确的是( )
A.钠燃烧时发出黄色的火焰
B.钠燃烧时生成氧化钠
C.钠原子的最外层只有一个电子
D.钠很活泼易失去最外层上的电子
B
B
2.下列关于铝的叙述中,不正确的是( )
A.铝是地壳中含量最多的金属元素
B.在常温下,铝不能与氧气反应
C.铝是一种比较活泼的金属
D.在化学反应中,铝容易失去电子
练一练
3.将一小块钠投入一支盛有煤油和水的混和 物的试管中你能观察到什么现象呢
向一金属铝的易拉罐内充满CO2,然后向罐内注入足量NaOH溶液,立即用胶布严封罐口,过一段时间后,罐壁内凹而瘪,再过一段时间后,瘪了的罐壁重新鼓起,解释上述变化的实验现象: (1)罐壁内凹而瘪的原因: 反应方程式:
(2)罐壁重新鼓起的原因: 反应方程式:
解答:
动动脑?
(1)是因为CO2与NaOH反应生成Na2CO3,使得罐内气压小于外界大气压; (2)是因为过量的NaOH与铝罐反应生成H2,使罐内气压等于或大于外界大气压;
同学们 再见
第三章第一节
金属的化学性质
青铜器
铁器
铝合金
金
银
铜
铁
铝
合金
养闺女贴盖
哪家没青菜
思考与交流:金属的性质
铁
氧气
盐酸
硫酸铜
四氧化三铁
氯化亚铁+氢气
硫酸亚铁+铜
举例说明金属能发生哪些化学反应。
思考与交流:金属的性质
金属
非金属(如O2等)
酸(如HCl、H2SO4等)
盐(如CuSO4等)
金属氧化物
盐+氢气
盐+金属
画出Na、Mg、Al的原子结构示意图,分析它们的原子结构有什么特点,与金属的化学性质有什么联系
[思考与交流]
Na
+13
2
8
3
+11
2
8
1
+12
2
8
2
Mg
Al
核电荷数,最外层电子数,原子半径
电子层数
原子结构
化学性质
金属容易发生氧化反应:
金属能与O2等非金属、酸及盐等反应
实验
推测
验证
M – ne- = Mn+
Fe
Na
Al
3Fe+4O2
Fe3O4
K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
氧气
其他非金属
探究活动1:探究金属与非金属的反应
1、观察钠保存的方式;
2、用镊子取一块钠,用滤纸吸干表面的体;
3、用刀切开钠块,观察切面颜色;
4、继续观察切面颜色在空气中的变化;
5、实验完毕将钠块放回试剂瓶。
实验3-1
轻:密度比煤油大;
软:可以用刀切割;
白:银白色固体,有金属光泽;
……
银白色、有光泽
变暗
钠的物理性质
把一小块金属钠放在坩埚中,加
热,有什么现象?
钠在空气中加热时,熔化成________,燃烧时,发出___色火焰,在玻璃管内壁上有____色固体出现。
闪亮的小球
黄
淡黄
演示
实验
实验3-2
点燃
(淡黄色)
过氧化钠
+1 -2
+1 -1
==2Na2O (白色)
氧化钠
点燃:
2Na+O2 == Na2O2
常温:
4Na+O2
1. 与O2反应
Fe
Na
Al
3Fe+4O2
Fe3O4
氧气
其他非金属
4Na+O2=2Na2O
2Na+O2
Na2O2
科学探究:加热铝箔 P48
铝易与O2反应,加热时,铝熔化,由于外层的氧化膜为Al2O3,Al2O3的熔点比铝高,所以熔化的铝并不滴落。
Fe
Na
Al
3Fe+4O2
Fe3O4
氧气
其他非金属
4Na+O2=2Na2O
2Na+O2
Na2O2
Na2S
2Na+S
2Na+Cl2=2NaCl
探究活动2:探究金属与酸和水的反应
Fe+2HCl=
FeCl2+H2↑
2Al+6HCl =
2AlCl3+3H2↑
2Na+2HCl=
2NaCl+H2↑
与盐酸
Na
Al
Fe
与水
通常情况下不与水反应
探究活动2:探究金属与酸和水的反应
将一小块金属钠投入滴有酚酞的水中。
探究实验
1、用镊子取一块钠,用滤纸吸干表面的煤油;
2、将钠放在玻璃片上,切绿豆粒大小的钠块;
3、用烧杯取1/3杯水,然后滴加几滴酚酞;
4、将钠块投入水中;
5、仔细观察实验的现象。
探究
方案:
实验现象
原因及结论
钠浮在水面上
钠的密度比水小
立刻熔成一个闪亮的小球
钠的熔点较低,与水反应放热
在水面上四处游动
产生的气体推动金属钠来回游动
发出嘶嘶声音
剧烈反应,产生气体
溶液由无色变为红色
钠与水反应生成碱性物质
钠与水的反应
与水反应
现象:浮、熔、红、游、嘶
2Na+2H2O==2NaOH+H2↑
2e-
2Na+2H2O==2Na++2OH-+H2↑
2.金属与酸和水的反应
Fe Al Na
与盐酸
与水
Fe+2HCl=
FeCl2+H2↑
2Al+6HCl=
2AlCl3+3H2↑
2Na+2HCl=
2NaCl+H2↑
2Na+2H2O=
2NaOH+H2↑
通常情况下不与水反应
若酸过量,只考虑与酸反应
若钠过量,则过量的钠还要与水反应。
注意:
3Fe+4H2O(g)==== Fe3O4+4H2
△
科学探究:铁与水蒸气反应 P50
探究3:探究金属与盐的反应
Fe Al Na
与CuSO4
溶液
Fe+CuSO4=
FeSO4+Cu
2Al+3CuSO4=
Al2(SO4)3+3Cu
*钠与盐溶液反应时,
先与水反应,
不能置换盐中的金属。
2Na+2H2O==2NaOH+H2↑
CuSO4+2NaOH==Na2SO4 +Cu(OH)2↓
___+______________________________________________________
2Na+2H2O+CuSO4==Na2SO4 +Cu(OH)2 ↓ +H2 ↑
4. 钠与盐溶液的反应
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑
Al与强碱溶液反应化学方程式:
4.特殊反应:铝与氢氧化钠反应
2Al + 2OH- + 2H2O =2AlO2- + 3H2↑
①Al与NaOH水溶液的反应中Al显示什么性质?根据是什么?
②上述反应产物中的NaAlO2是如何产生的?
思考:
②以上反应不是一步反应,而是多步反应的结果: 2Al+6H2O=2Al(OH)3+3H2↑ Al(OH)3+NaOH=NaAlO2+2H2O,因而只有水为氧化剂。
①Al显还原性,因其化合价升高。
2.金属与酸和水的反应
Fe Al Na
与盐酸
与水
Fe+2HCl=FeCl2+H2↑
2Al+6HCl=2AlCl3+3H2↑
2Na+2HCl=2NaCl+H2↑
2Na+2H2O=2NaOH+H2↑
3Fe+4H2O(g)
Fe3O4+4 H2
1.本节课,你学到了哪些知识
2.本节课,你学会了哪些方法
相信你会总结
1.完成课本53页1-4题。
2.课外探究Na与硫酸铜溶液的反应。
课后学习
练一练
1.下列关于钠的叙述中,不正确的是( )
A.钠燃烧时发出黄色的火焰
B.钠燃烧时生成氧化钠
C.钠原子的最外层只有一个电子
D.钠很活泼易失去最外层上的电子
B
B
2.下列关于铝的叙述中,不正确的是( )
A.铝是地壳中含量最多的金属元素
B.在常温下,铝不能与氧气反应
C.铝是一种比较活泼的金属
D.在化学反应中,铝容易失去电子
练一练
3.将一小块钠投入一支盛有煤油和水的混和 物的试管中你能观察到什么现象呢
向一金属铝的易拉罐内充满CO2,然后向罐内注入足量NaOH溶液,立即用胶布严封罐口,过一段时间后,罐壁内凹而瘪,再过一段时间后,瘪了的罐壁重新鼓起,解释上述变化的实验现象: (1)罐壁内凹而瘪的原因: 反应方程式:
(2)罐壁重新鼓起的原因: 反应方程式:
解答:
动动脑?
(1)是因为CO2与NaOH反应生成Na2CO3,使得罐内气压小于外界大气压; (2)是因为过量的NaOH与铝罐反应生成H2,使罐内气压等于或大于外界大气压;
同学们 再见
