高中化学苏教版(2021) 选择性必修2 专题2 专题知识体系构建与核心素养提升
文档属性
| 名称 | 高中化学苏教版(2021) 选择性必修2 专题2 专题知识体系构建与核心素养提升 | 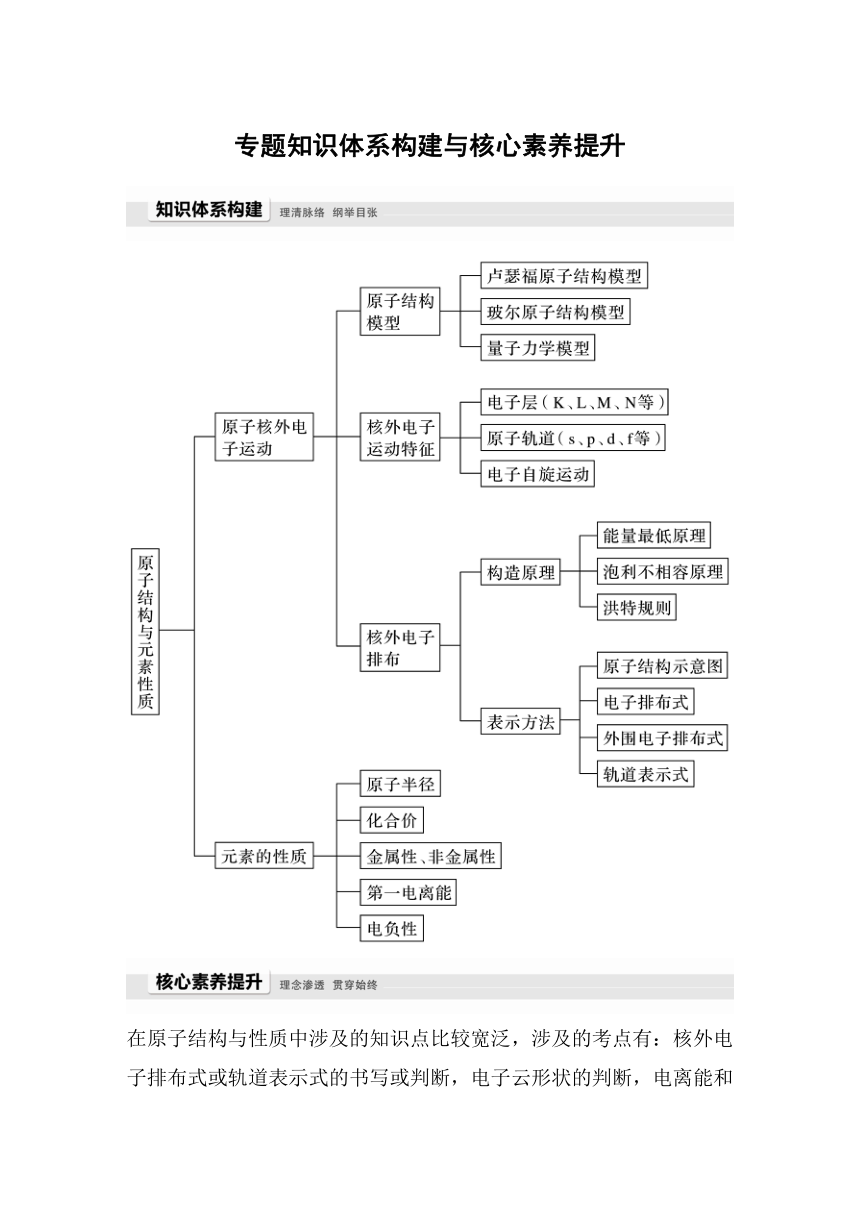 | |
| 格式 | docx | ||
| 文件大小 | 507.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-14 21:38:44 | ||
图片预览


文档简介
专题知识体系构建与核心素养提升
在原子结构与性质中涉及的知识点比较宽泛,涉及的考点有:核外电子排布式或轨道表示式的书写或判断,电子云形状的判断,电离能和电负性大小判断及应用等。下面从两个角度探讨原子结构与性质在高考中的考查。
角度一 基态原子的核外电子排布
1.[2020·全国卷Ⅱ,35(1)]基态Ti原子的核外电子排布式为________。
答案 1s22s22p63s23p63d24s2
2.[2019·全国卷Ⅱ,35(2)(3)](2)Fe成为阳离子时首先失去________轨道电子,Sm的外围电子排布式为4f66s2,Sm3+外围电子排布式为________。
(3)比较离子半径:F-________O2-(填“大于”“等于”或“小于”)。
答案 (2)4s 4f5 (3)小于
解析 (2)Fe的外围电子排布式为3d64s2,其阳离子Fe2+、Fe3+的外围电子排布式分别是3d6、3d5,二者均首先失去4s轨道上的电子;Sm失去3个电子成为Sm3+时,首先失去6s轨道上的电子,然后失去1个4f轨道上的电子,故Sm3+的外围电子排布式为4f5。(3)F-与O2-核外电子层结构相同,核电荷数越大,原子核对核外电子的吸引力越大,离子半径越小,故离子半径:F-3.[2019·全国卷Ⅲ,35(1)]在周期表中,与Li的化学性质最相似的邻族元素是________,该元素基态原子核外M层电子的自旋状态________(填“相同”或“相反”)。
答案 Mg 相反
解析 由元素周期表中的“对角线规则”可知,与Li的化学性质最相似的邻族元素是Mg;Mg为12号元素,M层只有2个电子,排布在3s轨道上,故M层的2个电子自旋状态相反。
4.[2018·全国卷Ⅰ,35(1)(2)](1)下列Li原子轨道表示式表示的状态中,能量最低和最高的分别为________、________(填字母)。
A.
B.
C.
D.
(2)Li+与H-具有相同的电子构型,r(Li+)小于r(H-),原因是_______________________。
答案 (1)D C (2)Li+核电荷数较大
5.[2018·全国卷Ⅱ,35(1)]基态Fe原子外围电子的轨道表达式为____________________,基态S原子电子占据最高能级的电子云轮廓图为________形。
答案 纺锤
6.[2018·全国卷Ⅲ,35(1)(2)](1)Zn原子核外电子排布式为____________________________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn)________I1(Cu)(填“大于”或“小于”)。原因是_______________________________。
答案 (1)[Ar]3d104s2(或1s22s22p63s23p63d104s2)
(2)大于 Zn原子核外电子排布为全满稳定结构,较难失电子
角度二 元素的电离能和电负性
7.(1)[2020·全国卷Ⅱ,35(3)节选]CaTiO3组成元素的电负性大小顺序是________________。
(2)[2019·全国卷Ⅲ,35(4)节选]NH4H2PO4中,电负性最高的元素是________。
答案 (1)O>Ti>Ca (2)O
解析 (1)一般来说,元素的非金属性越强,其电负性越大,因此组成CaTiO3的三种元素电负性的大小顺序为O>Ti>Ca。(2)H、N、P、O四种元素中O元素得电子的能力最强,故电负性最大。
8.[2017·江苏,21A(3)]C、H、O三种元素的电负性由小到大的顺序为______________。
答案 H9.[2017·全国卷Ⅱ,35(2)]元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第2周期部分元素的E1变化趋势如图所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是______________________________________;
氮元素的E1呈现异常的原因是___________________________________________________。
答案 同周期元素随着核电荷数的依次增大,原子半径逐渐变小,故结合一个电子释放出的能量依次增大 N的2p能级处于半充满状态,具有稳定性,故不易结合一个电子
在原子结构与性质中涉及的知识点比较宽泛,涉及的考点有:核外电子排布式或轨道表示式的书写或判断,电子云形状的判断,电离能和电负性大小判断及应用等。下面从两个角度探讨原子结构与性质在高考中的考查。
角度一 基态原子的核外电子排布
1.[2020·全国卷Ⅱ,35(1)]基态Ti原子的核外电子排布式为________。
答案 1s22s22p63s23p63d24s2
2.[2019·全国卷Ⅱ,35(2)(3)](2)Fe成为阳离子时首先失去________轨道电子,Sm的外围电子排布式为4f66s2,Sm3+外围电子排布式为________。
(3)比较离子半径:F-________O2-(填“大于”“等于”或“小于”)。
答案 (2)4s 4f5 (3)小于
解析 (2)Fe的外围电子排布式为3d64s2,其阳离子Fe2+、Fe3+的外围电子排布式分别是3d6、3d5,二者均首先失去4s轨道上的电子;Sm失去3个电子成为Sm3+时,首先失去6s轨道上的电子,然后失去1个4f轨道上的电子,故Sm3+的外围电子排布式为4f5。(3)F-与O2-核外电子层结构相同,核电荷数越大,原子核对核外电子的吸引力越大,离子半径越小,故离子半径:F-
答案 Mg 相反
解析 由元素周期表中的“对角线规则”可知,与Li的化学性质最相似的邻族元素是Mg;Mg为12号元素,M层只有2个电子,排布在3s轨道上,故M层的2个电子自旋状态相反。
4.[2018·全国卷Ⅰ,35(1)(2)](1)下列Li原子轨道表示式表示的状态中,能量最低和最高的分别为________、________(填字母)。
A.
B.
C.
D.
(2)Li+与H-具有相同的电子构型,r(Li+)小于r(H-),原因是_______________________。
答案 (1)D C (2)Li+核电荷数较大
5.[2018·全国卷Ⅱ,35(1)]基态Fe原子外围电子的轨道表达式为____________________,基态S原子电子占据最高能级的电子云轮廓图为________形。
答案 纺锤
6.[2018·全国卷Ⅲ,35(1)(2)](1)Zn原子核外电子排布式为____________________________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn)________I1(Cu)(填“大于”或“小于”)。原因是_______________________________。
答案 (1)[Ar]3d104s2(或1s22s22p63s23p63d104s2)
(2)大于 Zn原子核外电子排布为全满稳定结构,较难失电子
角度二 元素的电离能和电负性
7.(1)[2020·全国卷Ⅱ,35(3)节选]CaTiO3组成元素的电负性大小顺序是________________。
(2)[2019·全国卷Ⅲ,35(4)节选]NH4H2PO4中,电负性最高的元素是________。
答案 (1)O>Ti>Ca (2)O
解析 (1)一般来说,元素的非金属性越强,其电负性越大,因此组成CaTiO3的三种元素电负性的大小顺序为O>Ti>Ca。(2)H、N、P、O四种元素中O元素得电子的能力最强,故电负性最大。
8.[2017·江苏,21A(3)]C、H、O三种元素的电负性由小到大的顺序为______________。
答案 H
氮元素的E1呈现异常的原因是___________________________________________________。
答案 同周期元素随着核电荷数的依次增大,原子半径逐渐变小,故结合一个电子释放出的能量依次增大 N的2p能级处于半充满状态,具有稳定性,故不易结合一个电子
