高中化学苏教版(2021) 选择性必修2 专题3 第一单元 第2课时 金属晶体
文档属性
| 名称 | 高中化学苏教版(2021) 选择性必修2 专题3 第一单元 第2课时 金属晶体 |  | |
| 格式 | docx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-14 22:08:54 | ||
图片预览




文档简介
第2课时 金属晶体
[核心素养发展目标]
1.能从微观角度分析金属晶体中的构成微粒及粒子之间的相互作用,培养宏观辨识与微观探析的学科核心素养。
2.能利用金属晶体的通性判断晶体类型,进一步理解金属晶体中各微粒之间的作用力,理解金属晶体的堆积模型,并能用均摊法分析晶胞组成,强化证据推理与模型认知的学科核心素养。
一、金属晶体
1.概念
(1)晶体:内部粒子(原子、离子或分子)在空间呈现有规则的重复排列,外观具有规则几何外形的固体物质,通常条件下,金属单质及其合金属于晶体。
(2)晶胞:能够反映晶体结构特征的基本重复单位。金属晶体是金属晶胞在空间连续重复延伸而形成的。
(3)金属晶体:通过金属阳离子与自由电子之间的强烈的作用而形成的晶体。
2.金属材料——合金
(1)概念:将两种或两种以上的金属(或金属与非金属)共熔,制备出的特殊金属材料。
(2)性能
①合金的硬度一般都比组成它的纯金属大。
②多数合金的熔点低于组成它的任何一种组分金属。
③合金的导电性和导热性一般低于任一组分金属。
3.金属晶体的常见堆积方式
(1)金属原子在二维空间中放置的两种方式
金属晶体中的原子可看成直径相等的球体。把它们放置在平面上(即二维空间里),可有两种方式——a:非密置层,b:密置层(如下图所示)。
特别提醒 密置层放置时,平面的利用率比非密置层的高。
(2)金属晶体的原子在三维空间里的3种堆积方式
金属原子在三维空间按一定的规律堆积,有3种基本堆积方式(图中不同颜色的小球都代表同一种金属原子)。
堆积方式 图式 实例
简单立方堆积 钋
体心立方堆积 钠、钾、铬、钼、钨等
面心立方堆积 金、银、铜、铅等
1.晶体中一个原子周围距离相等且最近的原子的数目叫配位数,回答下列问题。
(1)非密置层和密置层的配位数分别为______、________________________________。
答案 4 6
(2)简单立方堆积、体心立方堆积和面心立方堆积的配位数分别为________、________、________。
答案 6 8 12
2.金属粉末往往没有金属光泽的原因是什么?
提示 金属粉末往往没有金属光泽,这是因为在粉末状时,金属的晶面分布在各个方向,非常杂乱,晶格排列也不规则,吸收可见光后辐射不出去,所以失去光泽。
1.对图中某金属晶体结构的模型进行分析,有关说法正确的是( )
A.该种堆积方式称为六方堆积
B.该种堆积方式称为体心立方堆积
C.该种堆积方式称为面心立方堆积
D.金属Mg就属于此种堆积方式
答案 C
解析 由图示知该堆积方式为面心立方堆积,A、B错误,C正确,Mg是六方堆积,D错误。
2.钠钾合金在通常状况下呈液态,可作为原子反应堆的导热剂。以下是对钠钾合金具有导热性的主要原因的分析,其中正确的是( )
A.钠钾合金的熔点很低
B.钠、钾原子的电离能都很小
C.钠钾合金中有自由电子
D.钠钾合金中有金属离子
答案 C
3.结合金属晶体的结构和性质,回答以下问题。
(1)已知下列金属晶体:Na、Po、K、Fe、Cu、Mg、Zn、Au,其堆积方式为
①简单立方堆积的是________;
②体心立方堆积的是________;
③六方堆积的是________;
④面心立方堆积的是________。
(2)根据下列叙述,判断一定为金属晶体的是________(填字母)。
A.由分子间作用力形成,熔点很低
B.由共价键结合形成网状晶体,熔点很高
C.固体有良好的导电性、导热性和延展性
答案 (1)①Po ②Na、K、Fe ③Mg、Zn ④Cu、Au
(2)C
解析 (1)简单立方堆积的空间利用率太低,只有金属Po采取这种方式。体心立方堆积是上层金属原子填入下层的金属原子形成的凹穴中,这种堆积方式的空间利用率比简单立方堆积的高,多数金属是这种堆积方式。六方堆积常见金属为Mg、Zn、Ti,面心立方堆积常见金属为Cu、Ag、Au。
二、均摊法分析晶胞的组成
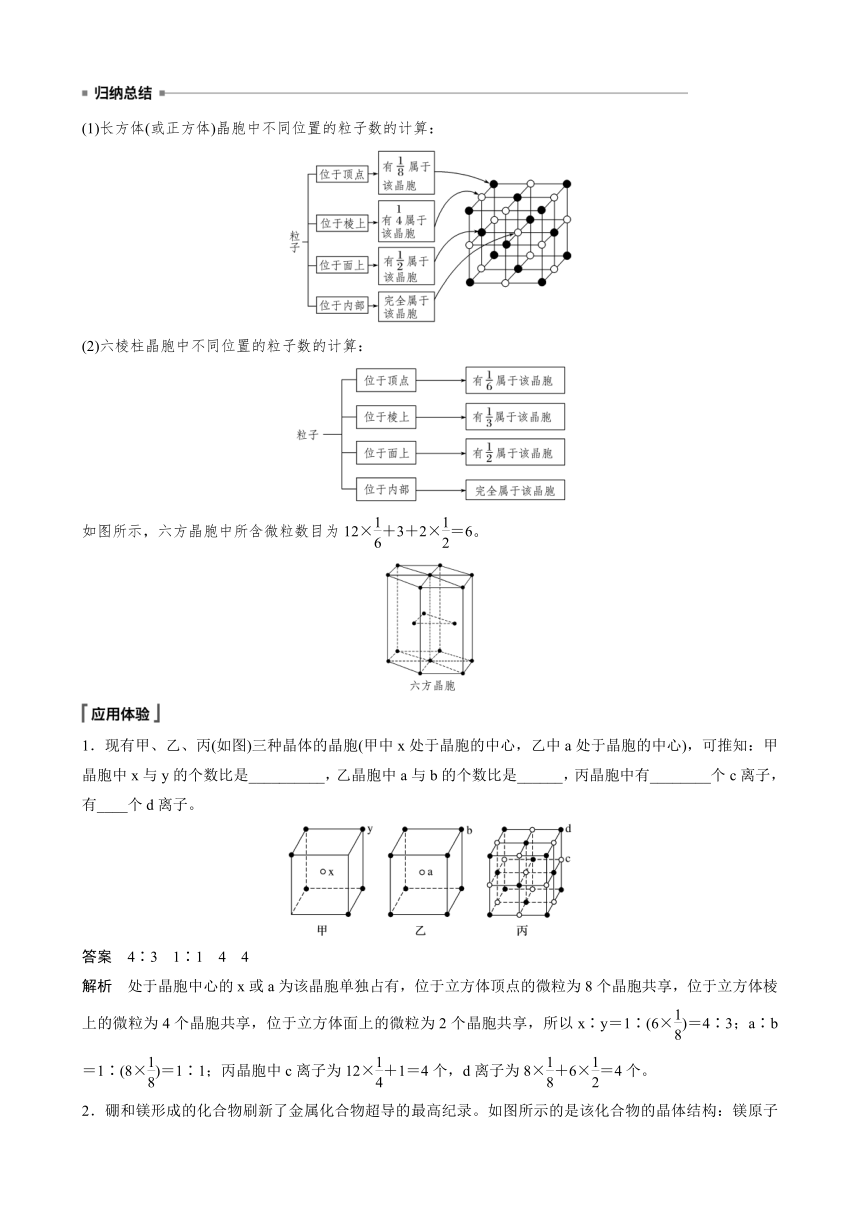
均摊法:指在一个晶胞中按比例均摊出该晶胞中的每个粒子,如某个粒子为n个晶胞所共有,则该粒子有属于该晶胞。如下图所示的晶胞中不同位置的粒子数的计算:
即:(1)处于立方体顶点上的原子为8个晶胞共享。
(2)处于立方体面上的原子为2个晶胞共享。
(3)处于立方体棱上的原子为4个晶胞共享。
(4)处于立方体体心的原子完全属于该晶胞。
填写①简单立方堆积、②体心立方堆积、③六方堆积每个晶胞中所含的原子数目。
(1)长方体(或正方体)晶胞中不同位置的粒子数的计算:
(2)六棱柱晶胞中不同位置的粒子数的计算:
如图所示,六方晶胞中所含微粒数目为12×+3+2×=6。
1.现有甲、乙、丙(如图)三种晶体的晶胞(甲中x处于晶胞的中心,乙中a处于晶胞的中心),可推知:甲晶胞中x与y的个数比是__________,乙晶胞中a与b的个数比是______,丙晶胞中有________个c离子,有____个d离子。
答案 4∶3 1∶1 4 4
解析 处于晶胞中心的x或a为该晶胞单独占有,位于立方体顶点的微粒为8个晶胞共享,位于立方体棱上的微粒为4个晶胞共享,位于立方体面上的微粒为2个晶胞共享,所以x∶y=1∶(6×)=4∶3;a∶b=1∶(8×)=1∶1;丙晶胞中c离子为12×+1=4个,d离子为8×+6×=4个。
2.硼和镁形成的化合物刷新了金属化合物超导的最高纪录。如图所示的是该化合物的晶体结构:镁原子间形成正六棱柱,且棱柱的上、下底面还各有一个镁原子;6个硼原子位于棱柱内。则该化合物的化学式为( )
A.MgB B.MgB2 C.Mg2B D.Mg3B2
答案 B
解析 棱柱内硼原子数为6,均属于这个晶胞。镁原子位于上、下面心(2个)及12个顶点,共有镁原子数为2×+12×=3,则镁、硼原子个数之比为1∶2。
1.下列有关晶胞的叙述正确的是( )
A.晶胞的结构是晶体的结构
B.不同的晶体中,晶胞的大小和形状都相同
C.晶胞中的任何一个粒子都属于该晶胞
D.已知晶胞的组成就可推知晶体的组成
答案 D
2.金属晶体堆积密度大,原子配位数高,能充分利用空间的原因是( )
A.金属原子的价电子数少
B.金属晶体中有自由电子
C.金属原子的原子半径大
D.金属键无方向性、饱和性
答案 D
3.铝钠合金有着广泛的应用,现有三种晶体:①铝、②钠、③铝钠合金,它们的熔点从低到高的顺序是( )
A.①②③ B.②①③
C.③②① D.③①②
答案 C
解析 三种晶体中,一般合金的熔点低于各组成金属单质的熔点,而铝与钠比较,钠的熔、沸点较低。
4.下列关于体心立方堆积晶胞结构(如图)的叙述正确的是( )
A.是密置层的一种堆积方式
B.晶胞是六棱柱
C.每个晶胞内含2个原子
D.每个晶胞内含6个原子
答案 C
解析 体心立方堆积晶体的晶胞为立方体,是非密置层的一种堆积方式,其晶胞内含有2个原子。
5.如图所示是晶体结构中具有代表性的最小重复单元(晶胞)的排列方式,图中—X、—Y、—Z。其对应的化学式不正确的是( )
答案 B
解析 A图中X、Y原(离)子的位置、数目完全等同,化学式为XY,正确;B图化学式应为XY,错误;C图中X的数目:4×+1=,Y的数目:4×=,化学式为X3Y,正确;D图中X的数目:8×=1,Y的数目:6×=3,Z位于内部,数目为1,化学式为XY3Z,正确。
6.有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )
A.①为简单立方堆积,②为六方最密堆积,③为体心立方堆积,④为面心立方最密堆积
B.每个晶胞含有的原子数分别为①1个,②2个,③2个,④4个
C.晶胞中原子的配位数分别为①6,②8,③8,④12
D.空间利用率的大小关系为①<②<③<④
答案 B
解析 ①为简单立方堆积,②为体心立方堆积,③为六方堆积,④为面心立方堆积,A项错误;每个晶胞含有的原子数分别为①8×=1,②8×+1=2,③8×+1=2,④8×+6×=4,B项正确;晶胞③中原子的配位数应为12,C项错误;四种晶体的空间利用率分别为52%、68%、74%、74%,D项错误,应为④=③>②>①。
7.(1)如图所示为二维平面晶体示意图,所表示的化学式为AX3的是________。
(2)如图为一个金属铜的晶胞,请完成以下各题。
①该晶胞“实际”拥有的铜原子数是______个。
②该晶胞称为______(填字母)。
A.六方晶胞
B.体心立方晶胞
C.面心立方晶胞
答案 (1)b (2)4 C
解析 (1)a中,每个黑球周围有6个白球,每个白球周围有3个黑球,白球与黑球个数比为2∶1,化学式为AX2;b中,每个黑球周围有6个白球,每个白球周围有2个黑球,白球与黑球个数比为3∶1,化学式为AX3。
题组一 金属晶体及堆积模型
1.下列关于金属晶体的叙述正确的是( )
A.用铂金做首饰不能用金属键理论解释
B.固态和熔融时易导电,熔点在1 000 ℃左右的晶体可能是金属晶体
C.Al、Na、Mg的熔点逐渐升高
D.金属晶体一定是无色透明的固体
答案 B
解析 用铂金做首饰利用了金属晶体的延展性,能用金属键理论解释,A错误;金属晶体在固态和熔融时能导电,其熔点差异很大,故题设条件下的晶体可能是金属晶体,B正确;一般来说,金属中单位体积内自由电子的数目越多,金属元素的原子半径越小,金属键越强,故金属键的强弱顺序为Al>Mg>Na,其熔点的高低顺序为Al>Mg>Na,C错误。
2.金属钠是体心立方堆积,下列关于钠晶体的判断合理的是( )
A.其熔点比金属铝的熔点高
B.一个钠的晶胞中,平均含有4个钠原子
C.该晶体中的自由电子在外加电场作用下可发生定向移动
D.该晶体中的钠离子在外加电场的作用下可发生定向移动
答案 C
解析 金属的原子半径越小,金属离子所带电荷数越多,金属键越强,金属熔化时破坏金属键,所以Al的金属键强度大于Na的金属键强度,所以Na的熔点比金属Al的熔点低,故A错误;晶胞中Na原子位于立方体的顶点和体心,则一个钠的晶胞中,平均含有的钠原子数为×8+1=2个,故B错误;自由电子在电场的作用下可以定向移动,金属晶体中存在自由移动的电子,所以该晶体中的自由电子在外加电场作用下可发生定向移动,故C正确;晶体中的钠离子不能自由移动,所以晶体中的钠离子在外加电场的作用下不能定向移动,故D错误。
3.(2020·北京承德月考)下列金属的晶体结构类型都属于面心立方最密堆积的是( )
A.Li、Na、Mg、Ca B.Li、Na、K、Rb
C.Pb、Ag、Cu、Au D.Be、Mg、Cu、Zn
答案 C
4.金属原子在二维空间里放置有如图所示的两种排列方式,下列说法正确的是( )
A.(a)为非密置层,配位数为6
B.(b)为密置层,配位数为4
C.(a)在三维空间里堆积可得六方堆积和面心立方堆积
D.(b)在三维空间里堆积仅得简单立方堆积
答案 C
解析 金属原子在二维空间里有两种排列方式,一种是密置层排列,另一种是非密置层排列。密置层排列的空间利用率高,原子的配位数为6,非密置层排列的空间利用率低,配位数为4。由此可知,(a)为密置层,(b)为非密置层。密置层在三维空间堆积可得到六方堆积和面心立方堆积两种堆积方式,非密置层在三维空间堆积可得到简单立方堆积和体心立方堆积两种堆积方式。
5.仔细观察如图,这种堆积方式是( )
A.体心立方堆积
B.简单立方堆积
C.六方堆积
D.面心立方堆积
答案 B
6.如图是金属晶体的面心立方晶胞示意图,在密堆积中处于同一密置层上的原子组合是( )
A.④⑤⑥⑩ B.②③④⑤⑥⑦
C.①④⑤⑥⑧ D.①② ⑧⑤
答案 B
解析 面心立方晶胞的体对角线是垂直于密置层面的直线,所以要找处于同一层上的原子,必须找出垂直于体对角线的面。
7.下列能够表示出每个晶胞中所含实际微粒个数的面心立方晶胞的是( )
答案 B
解析 A项和B项是面心立方晶胞,其中B项是经过切割后的面心立方晶胞,它能表示出此晶胞中所含微粒的实际数目,C项和D项是体心立方晶胞。
题组二 晶胞中微粒数目的计算
8.科学家把C60和K掺杂在一起制造出的物质具有超导性能,其晶胞结构如图所示。该物质中K和C60的个数之比为( )
A.1∶1 B.2∶1
C.3∶1 D.4∶1
答案 C
解析 根据均摊法可知,该晶胞中K的个数为2×6×=6,C60的个数为1+8×=2,所以该物质中K和C60的个数之比为6∶2=3∶1。
9.已知某化合物的晶体是由如图所示的最小结构单元密置堆积而成,下列关于该化合物的叙述错误的是( )
A.1 mol该化合物中含有1 mol Y
B.1 mol该化合物中含有3 mol Cu
C.1 mol该化合物中含有2 mol Ba
D.该化合物的化学式是YBa2Cu3O6
答案 D
解析 由图可知,白球代表的Y原子位于长方体的八个顶点上,大黑球代表的Ba原子位于长方体的四条棱上,灰球代表的Cu原子位于长方体的内部,小黑球代表的O原子有的位于长方体的内部、有的位于长方体的面上,运用均摊法可计算出Y原子个数为8×=1,Ba原子个数为8×=2,Cu原子个数为3,O原子个数为10×+2=7,故该化合物的化学式为YBa2Cu3O7。
10.金属晶体中金属原子有三种常见的堆积方式,a、b、c分别代表这三种晶体内晶胞的结构,其晶胞a、b、c内金属原子个数比为( )
A.3∶2∶1 B.11∶8∶4
C.9∶8∶4 D.21∶14∶9
答案 A
解析 a晶胞中,顶点的微粒被6个晶胞共享,所以a中原子个数为12×+2×+3=6;b中原子个数为8×+6×=4;c中原子个数为8×+1=2。
11.钇钡铜氧化合物晶胞的结构如图所示,则该化合物的化学式可能是( )
A.YBa2Cu3O4 B.YBa2Cu2O5
C.YBa2Cu3O5 D.YBaCu4O4
答案 C
解析 位于顶点的铜原子(最上层平面和最下层平面)共8个,这个晶胞中只分摊到8×=1个;位于棱上的也是8个,这个晶胞分摊到的是8×=2个,所以,每个晶胞单独含有的铜原子数为3个。氧原子位于晶胞面上(不含棱)的有7个,位于晶胞棱上的有6个,所以,每个晶胞单独含有的氧原子数为7×+6×=5个。所以该晶体每个晶胞中平均分摊到(即单独含有)的钇原子、钡原子、铜原子和氧原子个数分别为1、2、3、5,化学式为YBa2Cu3O5。
12.“神九”载人飞船上使用了锂镁合金和锂铝合金等合金材料,下列有关叙述不正确的是( )
A.飞船使用的合金材料,一般具有质量轻、强度高的特点
B.锂铝合金中铝、锂的金属性不如钠强
C.锂镁合金和锂铝合金性质相当稳定,不会与酸发生化学反应
D.锂镁合金是一种具有金属特性的物质,易导热、导电
答案 C
解析 A项,航天材料要符合质地轻、硬度大等基本要求;B项,根据碱金属元素性质递变规律可知Na的金属性比Li强,根据金属活动性顺序可知Na的金属性比铝强;C项,锂、镁按一定比例熔合而得到锂镁合金,具有活泼金属的性质,能与酸反应;D项,合金改变了金属内部结构,但仍具有金属的导热、导电性等性质。
13.铜是生活中比较常见的一种金属,而纳米铜能在空气中自燃,这是因为纳米铜的表面粒子数占总粒子数的比例较大。假设某纳米颗粒的大小和形状如图所示,则这种纳米颗粒的表面粒子数与总粒子数之比是( )
A.7∶11 B.1∶2 C.7∶8 D.26∶27
答案 A
解析 由该纳米颗粒的大小和形状结构图可知,表面粒子数为8个(顶点)+6个(面心)=14,而粒子总数为14+8=22,所以表面粒子数与总粒子数之比为14∶22=7∶11。
14.有一种钛原子和碳原子构成的气态团簇分子,如图所示,顶点和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式为( )
A.Ti14C13 B.TiC
C.Ti4C4 D.Ti4C3
答案 A
解析 由题意知该物质是气态团簇分子,故题目中图示应是该物质的一个完整的分子,由14个钛原子和13个碳原子构成。
15.请仔细观察下列几种物质的结构示意图,判断下列说法正确的是( )
A.硼镁超导物质的晶体结构单元如图所示(B原子位于棱柱内),则这种超导材料的化学式为Mg3B2
B.锂的某种氧化物的晶胞如图所示,则该氧化物的化学式为Li2O
C.某晶体的晶胞如图所示,则这种晶体中A、B、C三种粒子数目之比是3∶9∶4
D.Mn和Bi形成的某种晶体的晶胞结构如图所示(白球均在六棱柱内),则该晶体物质的化学式为Mn2Bi
答案 B
解析 该晶胞中Mg原子个数为12×+2×=3,B原子个数为6,Mg、B原子个数之比为3∶6=1∶2,所以其化学式为MgB2,故A错误;该晶胞中Li原子个数为8,O原子个数为8×+6×=4,则Li、O原子个数之比为8∶4=2∶1,所以其化学式为Li2O,故B正确;该晶胞中B粒子个数为6×+3×=2,A粒子个数为6×=,C粒子个数为1,则A、B、C粒子个数之比为∶2∶1=1∶4∶2,故C错误;Mn原子个数为12×+2×+1+6×=6,Bi原子个数为6,所以Mn、Bi原子个数之比为6∶6=1∶1,所以其化学式为MnBi,故D错误。
16.(1)将等径圆球在二维空间里进行排列,可形成密置层和非密置层,在图1所示的半径相等的圆球的排列中,A属于______层,配位数是______;B属于______层,配位数是________。
(2)将非密置层一层一层地在三维空间里堆积,得到如图2所示的一种金属晶体的晶胞,它被称为简单立方堆积,在这种晶体中,金属原子的配位数是________,平均每个晶胞所占有的原子数目是________。
(3)有资料表明,只有钋的晶体中的原子具有如图2所示的堆积方式,钋位于元素周期表的第__________周期________族,元素符号是____________,外围电子排布式是________。
答案 (1)非密置 4 密置 6 (2)6 1
(3)6 ⅥA Po 6s26p4
17.元素X的某价态离子Xn+中所有电子正好充满K、L、M三个能层,它与N3-形成晶体的晶胞结构如图所示。
(1)该晶体的阳离子与阴离子个数之比为________。
(2)该晶体中Xn+的n=________。
(3)X元素的原子序数是________。
(4)晶体中每个N3-被________个等距离的Xn+包围。
答案 (1)3∶1 (2)1 (3)29 (4)6
解析 (1)Xn+位于晶胞的棱上,其数目为12×=3;N3-位于晶胞的顶点,其数目为8×=1,故二者个数之比为3∶1。(2)由晶体的化学式X3N知,X所带电荷数为1。(3)因为K、L、M三个能层充满,故Xn+有2、8、18结构,所以X的原子序数是29。(4)N3-位于晶胞顶点,故其被6个Xn+从上、下、左、右、前、后包围。
[核心素养发展目标]
1.能从微观角度分析金属晶体中的构成微粒及粒子之间的相互作用,培养宏观辨识与微观探析的学科核心素养。
2.能利用金属晶体的通性判断晶体类型,进一步理解金属晶体中各微粒之间的作用力,理解金属晶体的堆积模型,并能用均摊法分析晶胞组成,强化证据推理与模型认知的学科核心素养。
一、金属晶体
1.概念
(1)晶体:内部粒子(原子、离子或分子)在空间呈现有规则的重复排列,外观具有规则几何外形的固体物质,通常条件下,金属单质及其合金属于晶体。
(2)晶胞:能够反映晶体结构特征的基本重复单位。金属晶体是金属晶胞在空间连续重复延伸而形成的。
(3)金属晶体:通过金属阳离子与自由电子之间的强烈的作用而形成的晶体。
2.金属材料——合金
(1)概念:将两种或两种以上的金属(或金属与非金属)共熔,制备出的特殊金属材料。
(2)性能
①合金的硬度一般都比组成它的纯金属大。
②多数合金的熔点低于组成它的任何一种组分金属。
③合金的导电性和导热性一般低于任一组分金属。
3.金属晶体的常见堆积方式
(1)金属原子在二维空间中放置的两种方式
金属晶体中的原子可看成直径相等的球体。把它们放置在平面上(即二维空间里),可有两种方式——a:非密置层,b:密置层(如下图所示)。
特别提醒 密置层放置时,平面的利用率比非密置层的高。
(2)金属晶体的原子在三维空间里的3种堆积方式
金属原子在三维空间按一定的规律堆积,有3种基本堆积方式(图中不同颜色的小球都代表同一种金属原子)。
堆积方式 图式 实例
简单立方堆积 钋
体心立方堆积 钠、钾、铬、钼、钨等
面心立方堆积 金、银、铜、铅等
1.晶体中一个原子周围距离相等且最近的原子的数目叫配位数,回答下列问题。
(1)非密置层和密置层的配位数分别为______、________________________________。
答案 4 6
(2)简单立方堆积、体心立方堆积和面心立方堆积的配位数分别为________、________、________。
答案 6 8 12
2.金属粉末往往没有金属光泽的原因是什么?
提示 金属粉末往往没有金属光泽,这是因为在粉末状时,金属的晶面分布在各个方向,非常杂乱,晶格排列也不规则,吸收可见光后辐射不出去,所以失去光泽。
1.对图中某金属晶体结构的模型进行分析,有关说法正确的是( )
A.该种堆积方式称为六方堆积
B.该种堆积方式称为体心立方堆积
C.该种堆积方式称为面心立方堆积
D.金属Mg就属于此种堆积方式
答案 C
解析 由图示知该堆积方式为面心立方堆积,A、B错误,C正确,Mg是六方堆积,D错误。
2.钠钾合金在通常状况下呈液态,可作为原子反应堆的导热剂。以下是对钠钾合金具有导热性的主要原因的分析,其中正确的是( )
A.钠钾合金的熔点很低
B.钠、钾原子的电离能都很小
C.钠钾合金中有自由电子
D.钠钾合金中有金属离子
答案 C
3.结合金属晶体的结构和性质,回答以下问题。
(1)已知下列金属晶体:Na、Po、K、Fe、Cu、Mg、Zn、Au,其堆积方式为
①简单立方堆积的是________;
②体心立方堆积的是________;
③六方堆积的是________;
④面心立方堆积的是________。
(2)根据下列叙述,判断一定为金属晶体的是________(填字母)。
A.由分子间作用力形成,熔点很低
B.由共价键结合形成网状晶体,熔点很高
C.固体有良好的导电性、导热性和延展性
答案 (1)①Po ②Na、K、Fe ③Mg、Zn ④Cu、Au
(2)C
解析 (1)简单立方堆积的空间利用率太低,只有金属Po采取这种方式。体心立方堆积是上层金属原子填入下层的金属原子形成的凹穴中,这种堆积方式的空间利用率比简单立方堆积的高,多数金属是这种堆积方式。六方堆积常见金属为Mg、Zn、Ti,面心立方堆积常见金属为Cu、Ag、Au。
二、均摊法分析晶胞的组成
均摊法:指在一个晶胞中按比例均摊出该晶胞中的每个粒子,如某个粒子为n个晶胞所共有,则该粒子有属于该晶胞。如下图所示的晶胞中不同位置的粒子数的计算:
即:(1)处于立方体顶点上的原子为8个晶胞共享。
(2)处于立方体面上的原子为2个晶胞共享。
(3)处于立方体棱上的原子为4个晶胞共享。
(4)处于立方体体心的原子完全属于该晶胞。
填写①简单立方堆积、②体心立方堆积、③六方堆积每个晶胞中所含的原子数目。
(1)长方体(或正方体)晶胞中不同位置的粒子数的计算:
(2)六棱柱晶胞中不同位置的粒子数的计算:
如图所示,六方晶胞中所含微粒数目为12×+3+2×=6。
1.现有甲、乙、丙(如图)三种晶体的晶胞(甲中x处于晶胞的中心,乙中a处于晶胞的中心),可推知:甲晶胞中x与y的个数比是__________,乙晶胞中a与b的个数比是______,丙晶胞中有________个c离子,有____个d离子。
答案 4∶3 1∶1 4 4
解析 处于晶胞中心的x或a为该晶胞单独占有,位于立方体顶点的微粒为8个晶胞共享,位于立方体棱上的微粒为4个晶胞共享,位于立方体面上的微粒为2个晶胞共享,所以x∶y=1∶(6×)=4∶3;a∶b=1∶(8×)=1∶1;丙晶胞中c离子为12×+1=4个,d离子为8×+6×=4个。
2.硼和镁形成的化合物刷新了金属化合物超导的最高纪录。如图所示的是该化合物的晶体结构:镁原子间形成正六棱柱,且棱柱的上、下底面还各有一个镁原子;6个硼原子位于棱柱内。则该化合物的化学式为( )
A.MgB B.MgB2 C.Mg2B D.Mg3B2
答案 B
解析 棱柱内硼原子数为6,均属于这个晶胞。镁原子位于上、下面心(2个)及12个顶点,共有镁原子数为2×+12×=3,则镁、硼原子个数之比为1∶2。
1.下列有关晶胞的叙述正确的是( )
A.晶胞的结构是晶体的结构
B.不同的晶体中,晶胞的大小和形状都相同
C.晶胞中的任何一个粒子都属于该晶胞
D.已知晶胞的组成就可推知晶体的组成
答案 D
2.金属晶体堆积密度大,原子配位数高,能充分利用空间的原因是( )
A.金属原子的价电子数少
B.金属晶体中有自由电子
C.金属原子的原子半径大
D.金属键无方向性、饱和性
答案 D
3.铝钠合金有着广泛的应用,现有三种晶体:①铝、②钠、③铝钠合金,它们的熔点从低到高的顺序是( )
A.①②③ B.②①③
C.③②① D.③①②
答案 C
解析 三种晶体中,一般合金的熔点低于各组成金属单质的熔点,而铝与钠比较,钠的熔、沸点较低。
4.下列关于体心立方堆积晶胞结构(如图)的叙述正确的是( )
A.是密置层的一种堆积方式
B.晶胞是六棱柱
C.每个晶胞内含2个原子
D.每个晶胞内含6个原子
答案 C
解析 体心立方堆积晶体的晶胞为立方体,是非密置层的一种堆积方式,其晶胞内含有2个原子。
5.如图所示是晶体结构中具有代表性的最小重复单元(晶胞)的排列方式,图中—X、—Y、—Z。其对应的化学式不正确的是( )
答案 B
解析 A图中X、Y原(离)子的位置、数目完全等同,化学式为XY,正确;B图化学式应为XY,错误;C图中X的数目:4×+1=,Y的数目:4×=,化学式为X3Y,正确;D图中X的数目:8×=1,Y的数目:6×=3,Z位于内部,数目为1,化学式为XY3Z,正确。
6.有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )
A.①为简单立方堆积,②为六方最密堆积,③为体心立方堆积,④为面心立方最密堆积
B.每个晶胞含有的原子数分别为①1个,②2个,③2个,④4个
C.晶胞中原子的配位数分别为①6,②8,③8,④12
D.空间利用率的大小关系为①<②<③<④
答案 B
解析 ①为简单立方堆积,②为体心立方堆积,③为六方堆积,④为面心立方堆积,A项错误;每个晶胞含有的原子数分别为①8×=1,②8×+1=2,③8×+1=2,④8×+6×=4,B项正确;晶胞③中原子的配位数应为12,C项错误;四种晶体的空间利用率分别为52%、68%、74%、74%,D项错误,应为④=③>②>①。
7.(1)如图所示为二维平面晶体示意图,所表示的化学式为AX3的是________。
(2)如图为一个金属铜的晶胞,请完成以下各题。
①该晶胞“实际”拥有的铜原子数是______个。
②该晶胞称为______(填字母)。
A.六方晶胞
B.体心立方晶胞
C.面心立方晶胞
答案 (1)b (2)4 C
解析 (1)a中,每个黑球周围有6个白球,每个白球周围有3个黑球,白球与黑球个数比为2∶1,化学式为AX2;b中,每个黑球周围有6个白球,每个白球周围有2个黑球,白球与黑球个数比为3∶1,化学式为AX3。
题组一 金属晶体及堆积模型
1.下列关于金属晶体的叙述正确的是( )
A.用铂金做首饰不能用金属键理论解释
B.固态和熔融时易导电,熔点在1 000 ℃左右的晶体可能是金属晶体
C.Al、Na、Mg的熔点逐渐升高
D.金属晶体一定是无色透明的固体
答案 B
解析 用铂金做首饰利用了金属晶体的延展性,能用金属键理论解释,A错误;金属晶体在固态和熔融时能导电,其熔点差异很大,故题设条件下的晶体可能是金属晶体,B正确;一般来说,金属中单位体积内自由电子的数目越多,金属元素的原子半径越小,金属键越强,故金属键的强弱顺序为Al>Mg>Na,其熔点的高低顺序为Al>Mg>Na,C错误。
2.金属钠是体心立方堆积,下列关于钠晶体的判断合理的是( )
A.其熔点比金属铝的熔点高
B.一个钠的晶胞中,平均含有4个钠原子
C.该晶体中的自由电子在外加电场作用下可发生定向移动
D.该晶体中的钠离子在外加电场的作用下可发生定向移动
答案 C
解析 金属的原子半径越小,金属离子所带电荷数越多,金属键越强,金属熔化时破坏金属键,所以Al的金属键强度大于Na的金属键强度,所以Na的熔点比金属Al的熔点低,故A错误;晶胞中Na原子位于立方体的顶点和体心,则一个钠的晶胞中,平均含有的钠原子数为×8+1=2个,故B错误;自由电子在电场的作用下可以定向移动,金属晶体中存在自由移动的电子,所以该晶体中的自由电子在外加电场作用下可发生定向移动,故C正确;晶体中的钠离子不能自由移动,所以晶体中的钠离子在外加电场的作用下不能定向移动,故D错误。
3.(2020·北京承德月考)下列金属的晶体结构类型都属于面心立方最密堆积的是( )
A.Li、Na、Mg、Ca B.Li、Na、K、Rb
C.Pb、Ag、Cu、Au D.Be、Mg、Cu、Zn
答案 C
4.金属原子在二维空间里放置有如图所示的两种排列方式,下列说法正确的是( )
A.(a)为非密置层,配位数为6
B.(b)为密置层,配位数为4
C.(a)在三维空间里堆积可得六方堆积和面心立方堆积
D.(b)在三维空间里堆积仅得简单立方堆积
答案 C
解析 金属原子在二维空间里有两种排列方式,一种是密置层排列,另一种是非密置层排列。密置层排列的空间利用率高,原子的配位数为6,非密置层排列的空间利用率低,配位数为4。由此可知,(a)为密置层,(b)为非密置层。密置层在三维空间堆积可得到六方堆积和面心立方堆积两种堆积方式,非密置层在三维空间堆积可得到简单立方堆积和体心立方堆积两种堆积方式。
5.仔细观察如图,这种堆积方式是( )
A.体心立方堆积
B.简单立方堆积
C.六方堆积
D.面心立方堆积
答案 B
6.如图是金属晶体的面心立方晶胞示意图,在密堆积中处于同一密置层上的原子组合是( )
A.④⑤⑥⑩ B.②③④⑤⑥⑦
C.①④⑤⑥⑧ D.①② ⑧⑤
答案 B
解析 面心立方晶胞的体对角线是垂直于密置层面的直线,所以要找处于同一层上的原子,必须找出垂直于体对角线的面。
7.下列能够表示出每个晶胞中所含实际微粒个数的面心立方晶胞的是( )
答案 B
解析 A项和B项是面心立方晶胞,其中B项是经过切割后的面心立方晶胞,它能表示出此晶胞中所含微粒的实际数目,C项和D项是体心立方晶胞。
题组二 晶胞中微粒数目的计算
8.科学家把C60和K掺杂在一起制造出的物质具有超导性能,其晶胞结构如图所示。该物质中K和C60的个数之比为( )
A.1∶1 B.2∶1
C.3∶1 D.4∶1
答案 C
解析 根据均摊法可知,该晶胞中K的个数为2×6×=6,C60的个数为1+8×=2,所以该物质中K和C60的个数之比为6∶2=3∶1。
9.已知某化合物的晶体是由如图所示的最小结构单元密置堆积而成,下列关于该化合物的叙述错误的是( )
A.1 mol该化合物中含有1 mol Y
B.1 mol该化合物中含有3 mol Cu
C.1 mol该化合物中含有2 mol Ba
D.该化合物的化学式是YBa2Cu3O6
答案 D
解析 由图可知,白球代表的Y原子位于长方体的八个顶点上,大黑球代表的Ba原子位于长方体的四条棱上,灰球代表的Cu原子位于长方体的内部,小黑球代表的O原子有的位于长方体的内部、有的位于长方体的面上,运用均摊法可计算出Y原子个数为8×=1,Ba原子个数为8×=2,Cu原子个数为3,O原子个数为10×+2=7,故该化合物的化学式为YBa2Cu3O7。
10.金属晶体中金属原子有三种常见的堆积方式,a、b、c分别代表这三种晶体内晶胞的结构,其晶胞a、b、c内金属原子个数比为( )
A.3∶2∶1 B.11∶8∶4
C.9∶8∶4 D.21∶14∶9
答案 A
解析 a晶胞中,顶点的微粒被6个晶胞共享,所以a中原子个数为12×+2×+3=6;b中原子个数为8×+6×=4;c中原子个数为8×+1=2。
11.钇钡铜氧化合物晶胞的结构如图所示,则该化合物的化学式可能是( )
A.YBa2Cu3O4 B.YBa2Cu2O5
C.YBa2Cu3O5 D.YBaCu4O4
答案 C
解析 位于顶点的铜原子(最上层平面和最下层平面)共8个,这个晶胞中只分摊到8×=1个;位于棱上的也是8个,这个晶胞分摊到的是8×=2个,所以,每个晶胞单独含有的铜原子数为3个。氧原子位于晶胞面上(不含棱)的有7个,位于晶胞棱上的有6个,所以,每个晶胞单独含有的氧原子数为7×+6×=5个。所以该晶体每个晶胞中平均分摊到(即单独含有)的钇原子、钡原子、铜原子和氧原子个数分别为1、2、3、5,化学式为YBa2Cu3O5。
12.“神九”载人飞船上使用了锂镁合金和锂铝合金等合金材料,下列有关叙述不正确的是( )
A.飞船使用的合金材料,一般具有质量轻、强度高的特点
B.锂铝合金中铝、锂的金属性不如钠强
C.锂镁合金和锂铝合金性质相当稳定,不会与酸发生化学反应
D.锂镁合金是一种具有金属特性的物质,易导热、导电
答案 C
解析 A项,航天材料要符合质地轻、硬度大等基本要求;B项,根据碱金属元素性质递变规律可知Na的金属性比Li强,根据金属活动性顺序可知Na的金属性比铝强;C项,锂、镁按一定比例熔合而得到锂镁合金,具有活泼金属的性质,能与酸反应;D项,合金改变了金属内部结构,但仍具有金属的导热、导电性等性质。
13.铜是生活中比较常见的一种金属,而纳米铜能在空气中自燃,这是因为纳米铜的表面粒子数占总粒子数的比例较大。假设某纳米颗粒的大小和形状如图所示,则这种纳米颗粒的表面粒子数与总粒子数之比是( )
A.7∶11 B.1∶2 C.7∶8 D.26∶27
答案 A
解析 由该纳米颗粒的大小和形状结构图可知,表面粒子数为8个(顶点)+6个(面心)=14,而粒子总数为14+8=22,所以表面粒子数与总粒子数之比为14∶22=7∶11。
14.有一种钛原子和碳原子构成的气态团簇分子,如图所示,顶点和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式为( )
A.Ti14C13 B.TiC
C.Ti4C4 D.Ti4C3
答案 A
解析 由题意知该物质是气态团簇分子,故题目中图示应是该物质的一个完整的分子,由14个钛原子和13个碳原子构成。
15.请仔细观察下列几种物质的结构示意图,判断下列说法正确的是( )
A.硼镁超导物质的晶体结构单元如图所示(B原子位于棱柱内),则这种超导材料的化学式为Mg3B2
B.锂的某种氧化物的晶胞如图所示,则该氧化物的化学式为Li2O
C.某晶体的晶胞如图所示,则这种晶体中A、B、C三种粒子数目之比是3∶9∶4
D.Mn和Bi形成的某种晶体的晶胞结构如图所示(白球均在六棱柱内),则该晶体物质的化学式为Mn2Bi
答案 B
解析 该晶胞中Mg原子个数为12×+2×=3,B原子个数为6,Mg、B原子个数之比为3∶6=1∶2,所以其化学式为MgB2,故A错误;该晶胞中Li原子个数为8,O原子个数为8×+6×=4,则Li、O原子个数之比为8∶4=2∶1,所以其化学式为Li2O,故B正确;该晶胞中B粒子个数为6×+3×=2,A粒子个数为6×=,C粒子个数为1,则A、B、C粒子个数之比为∶2∶1=1∶4∶2,故C错误;Mn原子个数为12×+2×+1+6×=6,Bi原子个数为6,所以Mn、Bi原子个数之比为6∶6=1∶1,所以其化学式为MnBi,故D错误。
16.(1)将等径圆球在二维空间里进行排列,可形成密置层和非密置层,在图1所示的半径相等的圆球的排列中,A属于______层,配位数是______;B属于______层,配位数是________。
(2)将非密置层一层一层地在三维空间里堆积,得到如图2所示的一种金属晶体的晶胞,它被称为简单立方堆积,在这种晶体中,金属原子的配位数是________,平均每个晶胞所占有的原子数目是________。
(3)有资料表明,只有钋的晶体中的原子具有如图2所示的堆积方式,钋位于元素周期表的第__________周期________族,元素符号是____________,外围电子排布式是________。
答案 (1)非密置 4 密置 6 (2)6 1
(3)6 ⅥA Po 6s26p4
17.元素X的某价态离子Xn+中所有电子正好充满K、L、M三个能层,它与N3-形成晶体的晶胞结构如图所示。
(1)该晶体的阳离子与阴离子个数之比为________。
(2)该晶体中Xn+的n=________。
(3)X元素的原子序数是________。
(4)晶体中每个N3-被________个等距离的Xn+包围。
答案 (1)3∶1 (2)1 (3)29 (4)6
解析 (1)Xn+位于晶胞的棱上,其数目为12×=3;N3-位于晶胞的顶点,其数目为8×=1,故二者个数之比为3∶1。(2)由晶体的化学式X3N知,X所带电荷数为1。(3)因为K、L、M三个能层充满,故Xn+有2、8、18结构,所以X的原子序数是29。(4)N3-位于晶胞顶点,故其被6个Xn+从上、下、左、右、前、后包围。
