高中化学苏教版(2021) 选择性必修2 专题3 专题知识体系构建与核心素养提升
文档属性
| 名称 | 高中化学苏教版(2021) 选择性必修2 专题3 专题知识体系构建与核心素养提升 |
|
|
| 格式 | docx | ||
| 文件大小 | 567.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-14 22:11:09 | ||
图片预览


文档简介
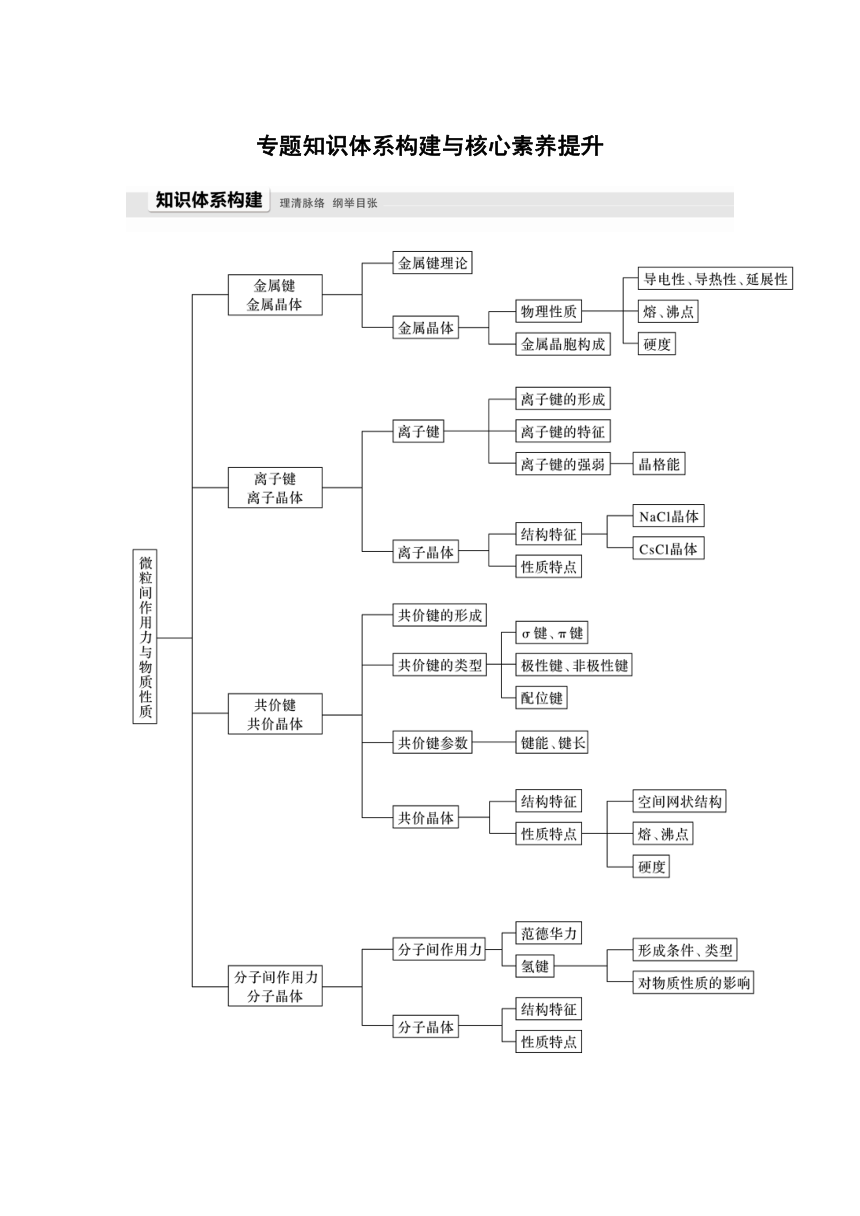
专题知识体系构建与核心素养提升
晶体结构与性质是《物质结构与性质》模块中难度最大的内容,涉及晶体类型的判断,晶体性质的解释,晶胞的计算等,学习时,一要全面认识各类晶胞的结构,做到“了然于胸”;二要研究近几年高考试题的变化,做到“心中有数”。
角度一 各类晶胞再认识
1.下图是由Q、R、G三种元素组成的一种高温超导体的晶胞结构,其中R为+2价,G为-2价,则Q的化合价为________。
答案 +3
解析 晶胞中三种原子的个数分别为R:8×+1=2、G:8×+8×+4×+2=8、Q:8×+2=4,R、G、Q的个数之比为1∶4∶2,则其化学式为RQ2G4。由于R为+2价,G为-2价,所以Q为+3价。
2.已知镧镍合金LaNin的晶胞结构如图,则LaNin中n=________。
答案 5
解析 根据晶胞结构可判断:La的个数:2×+12×=3、Ni的个数:12×+6×+6=15,所以n=5。
3.Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图所示。则该化合物的化学式为________。
答案 CuH
解析 根据晶胞结构可以判断:Cu的个数:2×+12×+3=6;H的个数:6×+1+3=6,所以化学式为CuH。
4.(1)硼化镁晶体在39 K时呈超导性。在硼化镁晶体中,镁原子和硼原子是分层排布的,下图是该晶体微观结构的透视图,图中的硼原子和镁原子投影在同一平面上。则硼化镁的化学式为________。
(2)在硼酸盐中,阴离子有链状、环状等多种结构形式。下图是一种链状结构的多硼酸根,则多硼酸根离子符号为________。
答案 (1)MgB2 (2)BO
解析 (1)每个Mg周围有6个B,而每个B周围有3个Mg,所以其化学式为MgB2。(2)从图可看出,每个单元中,都有一个B和一个O完全属于这个单元,剩余的2个O分别被两个结构单元共用,所以B∶O=1∶(1+2×)=1∶2,化学式为BO。
角度二 晶胞参数和坐标参数的分析与应用
5.[2020·新高考全国卷Ⅰ(山东),17(4)]以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系CdSnAs2的晶胞结构如下图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如下表所示。
坐标 原子 x y z
Cd 0 0 0
Sn 0 0 0.5
As 0.25 0.25 0.125
一个晶胞中有________个Sn,找出距离Cd(0,0,0)最近的Sn________(用分数坐标表示)。CdSnAs2晶体中与单个Sn键合的As有__________个。
答案 4 (0.5,0,0.25)、(0.5,0.5,0) 4
6.[2019·全国卷Ⅰ,35(4)]图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。图(b)是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离x=_______pm,Mg原子之间最短距离y=_________pm。设阿伏加德罗常数的值为NA,则MgCu2的密度是________g·cm-3(列出计算表达式)。
答案 a a
解析 观察图(a)和图(b)知,4个铜原子相切并与面对角线平行,有(4x)2=2a2,x=a。镁原子堆积方式类似金刚石,有y=a。已知1 cm=1010 pm,晶胞体积为(a×10-10)3 cm3,代入密度公式计算即可。
晶体结构与性质是《物质结构与性质》模块中难度最大的内容,涉及晶体类型的判断,晶体性质的解释,晶胞的计算等,学习时,一要全面认识各类晶胞的结构,做到“了然于胸”;二要研究近几年高考试题的变化,做到“心中有数”。
角度一 各类晶胞再认识
1.下图是由Q、R、G三种元素组成的一种高温超导体的晶胞结构,其中R为+2价,G为-2价,则Q的化合价为________。
答案 +3
解析 晶胞中三种原子的个数分别为R:8×+1=2、G:8×+8×+4×+2=8、Q:8×+2=4,R、G、Q的个数之比为1∶4∶2,则其化学式为RQ2G4。由于R为+2价,G为-2价,所以Q为+3价。
2.已知镧镍合金LaNin的晶胞结构如图,则LaNin中n=________。
答案 5
解析 根据晶胞结构可判断:La的个数:2×+12×=3、Ni的个数:12×+6×+6=15,所以n=5。
3.Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图所示。则该化合物的化学式为________。
答案 CuH
解析 根据晶胞结构可以判断:Cu的个数:2×+12×+3=6;H的个数:6×+1+3=6,所以化学式为CuH。
4.(1)硼化镁晶体在39 K时呈超导性。在硼化镁晶体中,镁原子和硼原子是分层排布的,下图是该晶体微观结构的透视图,图中的硼原子和镁原子投影在同一平面上。则硼化镁的化学式为________。
(2)在硼酸盐中,阴离子有链状、环状等多种结构形式。下图是一种链状结构的多硼酸根,则多硼酸根离子符号为________。
答案 (1)MgB2 (2)BO
解析 (1)每个Mg周围有6个B,而每个B周围有3个Mg,所以其化学式为MgB2。(2)从图可看出,每个单元中,都有一个B和一个O完全属于这个单元,剩余的2个O分别被两个结构单元共用,所以B∶O=1∶(1+2×)=1∶2,化学式为BO。
角度二 晶胞参数和坐标参数的分析与应用
5.[2020·新高考全国卷Ⅰ(山东),17(4)]以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系CdSnAs2的晶胞结构如下图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如下表所示。
坐标 原子 x y z
Cd 0 0 0
Sn 0 0 0.5
As 0.25 0.25 0.125
一个晶胞中有________个Sn,找出距离Cd(0,0,0)最近的Sn________(用分数坐标表示)。CdSnAs2晶体中与单个Sn键合的As有__________个。
答案 4 (0.5,0,0.25)、(0.5,0.5,0) 4
6.[2019·全国卷Ⅰ,35(4)]图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。图(b)是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离x=_______pm,Mg原子之间最短距离y=_________pm。设阿伏加德罗常数的值为NA,则MgCu2的密度是________g·cm-3(列出计算表达式)。
答案 a a
解析 观察图(a)和图(b)知,4个铜原子相切并与面对角线平行,有(4x)2=2a2,x=a。镁原子堆积方式类似金刚石,有y=a。已知1 cm=1010 pm,晶胞体积为(a×10-10)3 cm3,代入密度公式计算即可。
