高中化学苏教版(2021) 选择性必修2 专题4 第一单元 第1课时 杂化轨道理论与分子空间结构
文档属性
| 名称 | 高中化学苏教版(2021) 选择性必修2 专题4 第一单元 第1课时 杂化轨道理论与分子空间结构 |  | |
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-14 22:20:42 | ||
图片预览




文档简介
第一单元 分子的空间结构
第1课时 杂化轨道理论与分子空间结构
[核心素养发展目标]
1.了解杂化轨道理论,能从微观角度理解中心原子的杂化轨道类型对分子空间结构的影响。
2.通过对杂化轨道理论的学习,掌握中心原子杂化轨道类型的判断方法,建立分子空间结构分析的思维模型。
一、杂化轨道及其理论要点
1.试解释CH4分子为什么具有正四面体的空间结构?
(1)杂化轨道的形成
碳原子2s轨道上的1个电子进入2p空轨道,1个2s轨道和3个2p轨道“混合”起来,形成能量相等、成分相同的4个sp3杂化轨道,可表示为
(2)共价键的形成
碳原子的4个sp3杂化轨道分别与4个H原子的1s轨道重叠形成4个相同的σ键。
(3)CH4分子的空间结构
甲烷分子中的4个C—H键是等同的,C—H键之间的夹角——键角都是109°28′,形成正四面体型分子。
2.轨道杂化与杂化轨道
(1)轨道的杂化:在外界条件影响下,原子内部能量相近的原子轨道重新组合形成一组新轨道的过程叫做原子轨道的杂化。
(2)杂化轨道:重新组合后的新的原子轨道,叫做杂化原子轨道,简称杂化轨道。
(3)轨道杂化的过程:激发→杂化→轨道重叠。
3.杂化轨道的类型
杂化类型 sp sp2 sp3
参与杂化的原 子轨道及数目 ns 1 1 1
np 1 2 3
杂化轨道数目 2 3 4
1.正误判断,正确的打“√”,错误的打“×”
(1)发生轨道杂化的原子一定是中心原子( )
(2)原子轨道的杂化只有在形成分子的过程中才会发生,孤立的原子是不可能发生杂化的( )
(3)只有能量相近的轨道才能杂化( )
答案 (1)√ (2)√ (3)√
2.常见的杂化轨道类型有哪些?什么是sp3杂化?
提示 常见的杂化轨道类型有sp、sp2、sp3。同一原子内由1个ns轨道和3个np轨道参与的杂化称为sp3杂化。
1.下列关于杂化轨道的说法错误的是( )
A.所有原子轨道都参与杂化形成杂化轨道
B.同一原子中能量相近的原子轨道参与杂化
C.杂化轨道能量集中,有利于牢固成键
D.杂化轨道中不一定有一个电子
答案 A
解析 参与杂化的原子轨道,其能量不能相差太大,如1s轨道与2s、2p轨道能量相差太大,不能形成杂化轨道,即只有能量相近的原子轨道才能参与杂化,故A项错误、B项正确;杂化轨道的电子云一头大一头小,成键时利用大的一头,可使电子云重叠程度更大,形成牢固的化学键,故C项正确;并不是所有的杂化轨道中都会有电子,也可以是空轨道,也可以有一对孤电子对(如NH3),故D项正确。
2.下列有关sp2杂化轨道的说法错误的是( )
A.由同一电子层上的s轨道与p轨道杂化而成
B.共有3个能量相同的杂化轨道
C.每个sp2杂化轨道中s轨道成分占三分之一
D.sp2杂化轨道最多可形成2个σ键
答案 D
解析 同一电子层上s轨道与p轨道的能量差异不是很大,相互杂化的轨道的能量差异也不能过大,A项正确;同种类型的杂化轨道能量相同,B项正确;sp2杂化轨道是由一个s轨道与2个p轨道杂化而成的,C项正确;sp2杂化轨道最多可形成3个σ键,D项错误。
杂化轨道理论的要点
(1)原子形成分子时,通常存在激发、杂化和轨道重叠等过程。发生轨道杂化的原子一定是中心原子。
(2)原子轨道的杂化只有在形成分子的过程中才会发生,孤立的原子是不可能发生杂化的。
(3)只有能量相近的轨道才能杂化(如2s、2p)。
(4)杂化前后原子轨道数目不变(参加杂化的轨道数目等于形成的杂化轨道数目),且杂化轨道的能量相同。
(5)杂化轨道成键时要满足化学键间最小排斥原理,使轨道在空间取得最大夹角分布。故杂化后轨道的伸展方向、形状发生改变,但杂化轨道的形状完全相同。
二、用杂化轨道理论解释分子的形成及分子中的成键情况
1.用杂化轨道理论解释BeCl2、BF3分子的形成
(1)BeCl2分子的形成
杂化后的2个sp杂化轨道分别与氯原子的3p轨道发生重叠,形成2个σ键,构成直线形的BeCl2分子。
(2)BF3分子的形成
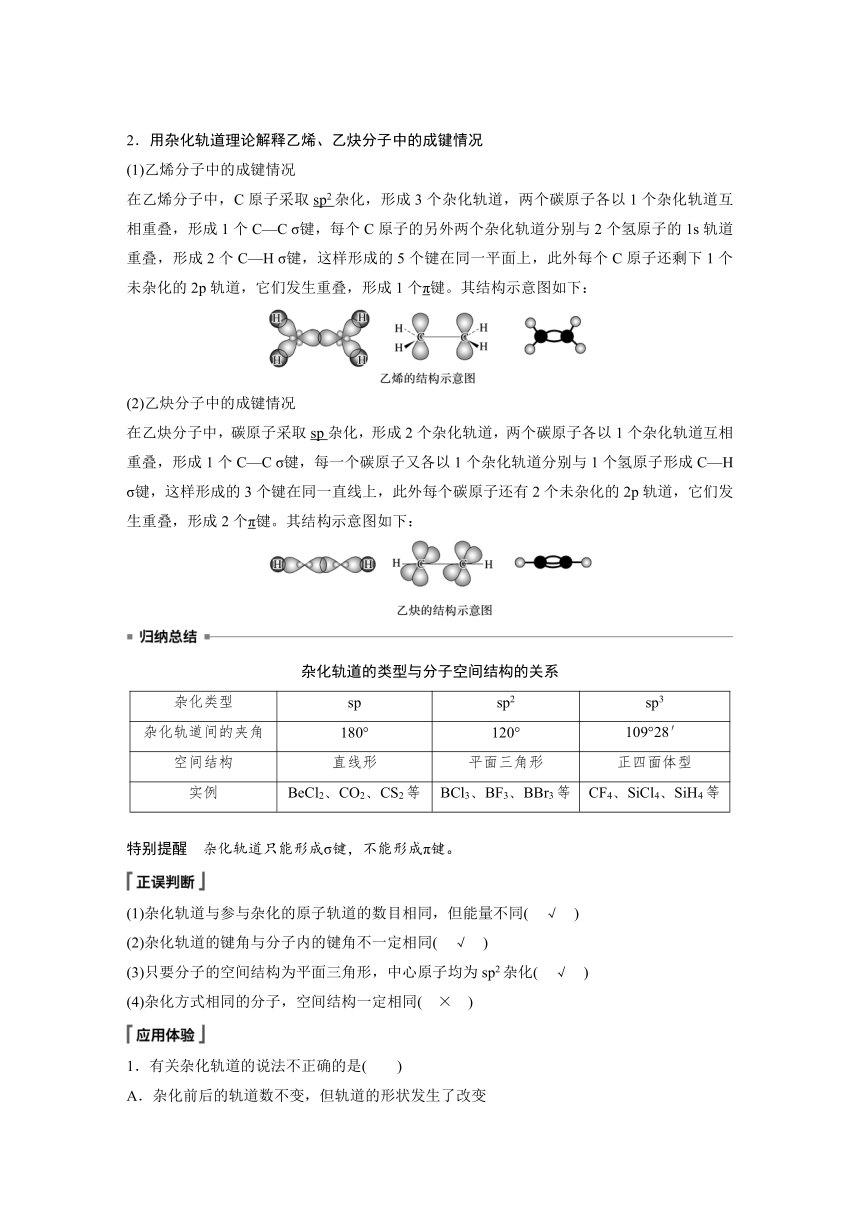
2.用杂化轨道理论解释乙烯、乙炔分子中的成键情况
(1)乙烯分子中的成键情况
在乙烯分子中,C原子采取sp2杂化,形成3个杂化轨道,两个碳原子各以1个杂化轨道互相重叠,形成1个C—C σ键,每个C原子的另外两个杂化轨道分别与2个氢原子的1s轨道重叠,形成2个C—H σ键,这样形成的5个键在同一平面上,此外每个C原子还剩下1个未杂化的2p轨道,它们发生重叠,形成1个π键。其结构示意图如下:
(2)乙炔分子中的成键情况
在乙炔分子中,碳原子采取sp杂化,形成2个杂化轨道,两个碳原子各以1个杂化轨道互相重叠,形成1个C—C σ键,每一个碳原子又各以1个杂化轨道分别与1个氢原子形成C—H σ键,这样形成的3个键在同一直线上,此外每个碳原子还有2个未杂化的2p轨道,它们发生重叠,形成2个π键。其结构示意图如下:
杂化轨道的类型与分子空间结构的关系
杂化类型 sp sp2 sp3
杂化轨道间的夹角 180° 120° 109°28′
空间结构 直线形 平面三角形 正四面体型
实例 BeCl2、CO2、CS2等 BCl3、BF3、BBr3等 CF4、SiCl4、SiH4等
特别提醒 杂化轨道只能形成σ键,不能形成π键。
(1)杂化轨道与参与杂化的原子轨道的数目相同,但能量不同( √ )
(2)杂化轨道的键角与分子内的键角不一定相同( √ )
(3)只要分子的空间结构为平面三角形,中心原子均为sp2杂化( √ )
(4)杂化方式相同的分子,空间结构一定相同( × )
1.有关杂化轨道的说法不正确的是( )
A.杂化前后的轨道数不变,但轨道的形状发生了改变
B.sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180°
C.杂化轨道既可形成σ键,又可形成π键
D.已知CO2为直线形分子,其分子结构可以用sp杂化轨道解释
答案 C
解析 杂化前后的轨道数不变,杂化后,各个轨道尽可能分散、对称分布,导致轨道的形状发生了改变,A正确; sp3、sp2、sp杂化轨道其空间结构分别是正四面体型、平面三角形、直线形,所以其夹角分别为109°28′、120°、180°,B正确;杂化轨道只能形成σ键,C错误;直线形分子的键角为180°,中心原子的杂化方式是sp,D正确。
2.有机物H3CH==H—≡CH中标有“·”的碳原子的杂化方式依次为( )
A.sp、sp2、sp3 B.sp3、sp2、sp
C.sp2、sp、sp3 D.sp3、sp、sp2
答案 B
3.在中,中间的碳原子和两边的碳原子分别采用的杂化方式是( )
A.sp2、sp2 B.sp3、sp3
C.sp2、sp3 D.sp、sp3
答案 C
解析 杂化轨道数=中心原子上的孤电子对数+中心原子的σ键个数。中间的碳原子上的孤电子对数为0,σ键个数为3,则杂化方式是sp2杂化;两边的碳原子上的孤电子对数为0,σ键个数为4,则杂化方式是sp3。
方法规律——中心原子杂化类型的判断方法
(1)根据杂化轨道之间的夹角判断:若杂化轨道之间的夹角为109°28′,则中心原子发生sp3杂化;若杂化轨道之间的夹角为120°,则中心原子发生sp2杂化;若杂化轨道之间的夹角为180°,则中心原子发生sp杂化。
(2)有机物中碳原子杂化类型的判断:饱和碳原子采取sp3杂化,连接双键的碳原子采取sp2杂化,连接三键的碳原子采取sp杂化。
1.鲍林是两位获得诺贝尔奖不同奖项的人之一,杂化轨道是鲍林为了解释分子的空间结构提出的。下列对sp3、sp2、sp杂化轨道的夹角的比较,得出结论正确的是( )
A.sp杂化轨道的夹角最大
B.sp2杂化轨道的夹角最大
C.sp3杂化轨道的夹角最大
D.sp3、sp2、sp杂化轨道的夹角相等
答案 A
解析 sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180°,故A项正确。
2.下列有关sp杂化轨道的叙述正确的是( )
A.是由一个1s轨道和一个2p轨道线性组合而成
B.sp杂化轨道中的两个杂化轨道完全相同
C.sp杂化轨道可与其他原子轨道形成σ键和π键
D.sp杂化轨道有两个,一个能量高,另一个能量低
答案 B
解析 sp杂化轨道是同一原子内同一电子层,能量相近的轨道发生的杂化,A项错误;不同类型能量相近的原子轨道混合起来,重新组合成一组新的轨道,所形成两个能量等同的sp杂化轨道,B项正确、D项错误;杂化轨道用于形成σ键,未杂化的轨道形成π键,不是杂化轨道形成π键,C项错误。
3.乙烯分子中含有4个C—H键和1个C==C键,6个原子在同一平面上。下列关于乙烯分子的成键情况分析正确的是( )
①每个C原子的2s轨道与2p轨道杂化,形成两个sp杂化轨道 ②每个C原子的2s轨道与2个2p轨道杂化,形成3个sp2杂化轨道 ③每个C原子的2s轨道与3个2p轨道杂化,形成4个sp3杂化轨道 ④每个C原子的3个外围电子占据3个杂化轨道,1个外围电子占据1个2p轨道
A.①③ B.②④ C.①④ D.②③
答案 B
解析 乙烯分子中键角为120°,为sp2杂化,形成3个sp2杂化轨道,1个外围电子占据1个2p轨道,2个C原子成键时形成1个π键,②④正确。
4.在乙炔分子中有3个σ键、2个π键,它们分别是( )
A.sp杂化轨道形成σ键、未杂化的2个2p轨道形成2个π键,且互相垂直
B.sp杂化轨道形成σ键、未杂化的2个2p轨道形成2个π键,且互相平行
C.C—H键之间是sp杂化轨道形成的σ键,C—C键之间是未参加杂化的2p轨道形成的π键
D.C—C键之间是sp杂化轨道形成的σ键,C—H键之间是未参加杂化的2p轨道形成的π键
答案 A
解析 碳原子形成乙炔时,一个2s轨道和一个2p轨道杂化成两个sp轨道,另外的两个2p轨道保持不变,其中一个sp轨道与氢原子的1s轨道“头碰头”重叠形成C—Hσ键,另一个sp轨道则与另一个碳原子的sp轨道“头碰头”重叠形成C—C σ键,碳原子剩下的两个2p轨道则“肩并肩”重叠形成两个C—C π键,且这两个π键互相垂直。
5.石墨烯(图甲)是一种由单层碳原子构成的平面结构新型材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(图乙)。
(1)图甲中,1号C与相邻C形成σ键的个数为________。
(2)图乙中,1号C的杂化方式是__________,该C与相邻C形成的键角________(填“>”“<”或“=”)图甲中1号C 与相邻C形成的键角。
答案 (1)3 (2)sp3 <
解析 (1)图甲中,1号C与相邻的3个C形成1个碳碳双键和2个碳碳单键,即形成3个σ键和1个π键。
(2)图乙中,1号C除与3个C形成化学键外,还与羟基氧原子形成化学键,故该C原子采取sp3杂化。
题组一 原子轨道杂化与杂化轨道
1.下列说法错误的是( )
A.第ⅠA族元素成键时不可能有杂化轨道
B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和1个C原子的2p轨道混合起来而形成的
C.孤电子对有可能参加杂化
D.s轨道和p轨道杂化不可能有sp4出现
答案 B
解析 第ⅠA族元素的外围电子排布式为ns1,由于只有1个ns电子,因此不可能形成杂化轨道;H2O分子中的氧原子采取sp3杂化,其sp3杂化轨道有2个是由孤电子对占据的,所以孤电子对有可能参加杂化;由于np能级只有3个原子轨道,所以s轨道和p轨道杂化只有sp3、sp2、sp 3种,不可能出现sp4杂化。
2.氨气分子空间结构是三角锥型,而甲烷是正四面体型,这是因为( )
A.两种分子的中心原子杂化轨道类型不同,NH3为sp2杂化,而CH4是sp3杂化
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道
C.NH3分子中有一对未成键的孤电子对,它对成键电子对的排斥作用较强
D.氨气的相对分子质量大于甲烷
答案 C
解析 本题考查分子空间结构的判断。NH3中N原子形成3个σ键,有一对未成键的孤电子对,杂化轨道数为4,采取sp3杂化,孤电子对对成键电子对的排斥作用较强,N—H键之间的键角小于109°28′,所以氨气分子空间结构是三角锥型;CH4分子中C原子采取sp3杂化,杂化轨道全部用于成键,碳原子连接4个相同的原子,C—H键之间的键角相等为109°28′,故CH4的空间结构为正四面体型,故A、B、D错误,C正确。
3.下列有关杂化轨道的说法不正确的是( )
A.原子中能量相近的某些轨道,在成键时,能重新组合成能量相等的新轨道
B.轨道数目杂化前后可以相等,也可以不等
C.杂化轨道成键时,要满足原子轨道最大重叠原理、能量最低原理
D.CH4分子中任意两个C—H键的夹角均为109°28′
答案 B
解析 原子轨道形成杂化轨道前后,轨道数目不变化,用于形成杂化轨道的原子轨道的能量相近,并满足最大重叠程度,故选B。
题组二 杂化类型的判断
4.BF3是典型的平面三角形分子,它溶于氢氟酸或NaF溶液中都形成BF,则BF3和BF中B原子的杂化轨道类型分别是( )
A.sp2、sp2 B.sp3、sp3
C.sp2、sp3 D.sp、sp2
答案 C
5.甲烷中的碳原子是sp3杂化,下列用*表示的碳原子的杂化和甲烷中的碳原子杂化类型一致的是( )
A.CH≡CH3 B.H2==CHCH3
C.CH2==HCH3 D.CH2==CHH3
答案 D
解析 D项中用*表示的碳原子形成了四个σ键,与甲烷类似,其为sp3杂化。
6.下列分子或离子中,不存在sp3杂化的是( )
A.SO B.NH3 C.C2H6 D.SO2
答案 D
解析 A项,在SO中S原子采取sp3杂化,错误;B项,NH3中N原子采取sp3杂化,错误;C项,C2H6中C原子采取sp3杂化,错误;D项,SO2中S原子采取sp2杂化,正确。
7.下列分子所含原子中,既有sp3杂化,又有sp2杂化的是( )
A.乙醛[]
B.丙烯腈[]
C.甲醛[]
D.丙炔[]
答案 A
解析 乙醛中甲基的碳原子采取sp3杂化,醛基中碳原子采取sp2杂化;丙烯腈中碳碳双键的两个碳原子采取sp2杂化,另一个碳原子采取sp杂化;甲醛中碳原子采取sp2杂化;丙炔中甲基碳原子采取sp3杂化,碳碳三键中两个碳原子采取sp杂化。
8.下列分子中的中心原子为sp杂化,分子的空间结构为直线形,且分子中没有形成π键的是( )
A.CH≡CH B.CO2 C.BeCl2 D.BBr3
答案 C
解析 CH≡CH和CO2中的C原子均采取sp杂化,且都含有π键;BeCl2分子中Be采取sp杂化,没形成π键;BBr3中B原子采取sp2杂化,且没有π键。
题组三 杂化轨道理论的应用
9.形成下列分子时,中心原子采用sp3杂化轨道和另一个原子的p轨道成键的是( )
①PF3 ②CF4 ③NH3 ④H2O
A.①② B.②③ C.③④ D.①④
答案 A
解析 PF3、CF4、NH3、H2O分子中P原子、C原子、N原子、O原子都采取sp3杂化, NH3和H2O分子中H原子以1s轨道与N和O原子形成σ键,PF3和CF4分子中F原子以2p轨道分别与P和C原子形成σ键。
10.(2020·兰州高二月考)sp3杂化形成的AB4型分子的空间结构是( )
A.平面四边形 B.正四面体型
C.三角锥型 D.平面三角形
答案 B
11.氮的最高价氧化物为无色晶体,它由NO和NO构成,已知其阴离子结构为平面三角形,阳离子中氮的杂化方式为sp,则其阳离子的结构和阴离子中氮的杂化方式为( )
A.直线形 sp2 B.V形 sp
C.平面三角形 sp2 D.平面三角形 sp3
答案 A
解析 NO结构为平面三角形,其中氮原子的杂化方式为sp2;NO中氮的杂化方式为sp,结构为直线形。
12.化合物A是一种新型锅炉水除氧剂,其结构式如图所示:,下列说法正确的是( )
A.碳、氮原子的杂化类型相同
B.氮原子与碳原子分别为sp3杂化与sp2杂化
C.1 mol A分子中所含σ键的数目为10NA
D.编号为a的氮原子和与其成键的另外三个原子在同一平面内
答案 B
解析 A分子中碳、氮原子各形成了3个σ键,氮原子有一对孤电子对而碳原子没有,故氮原子是sp3杂化而碳原子是sp2杂化,A项错误、B项正确;A分子中有一个碳氧双键,故有12对共用电子对、11个σ键,C项错误;氮原子为sp3杂化,相应的四个原子形成的是三角锥型结构,不可能共平面,D项错误。
13.白磷是一种能自燃的单质,其分子的结构模型如图所示:,下列叙述错误的是( )
A.每个磷原子形成3个σ键,磷原子为sp2杂化
B.磷原子均为sp3杂化
C.1 mol白磷中共含6 mol非极性键
D.白磷分子的空间结构为正四面体型
答案 A
解析 由白磷分子的结构模型图可知,每个磷原子均形成了3个σ键,且每个磷原子还有一对孤电子对,故磷原子为sp3杂化,A项错误、B项正确;由图可知C、D项正确。
14.如图是甲醛分子的结构模型,根据该图和所学化学知识回答下列问题:
(1)甲醛分子中碳原子的杂化方式是__________,作出该判断的主要理由是___________。
(2)下列是对甲醛分子中碳氧键的判断,其中正确的是________(填序号)。
①单键 ②双键 ③σ键 ④π键 ⑤σ键和π键
(3)甲醛分子中C—H键与C—H键之间的夹角________(填“=”“>”或“<”)120°,出现该现象的主要原因是__________________________________________________________。
答案 (1)sp2 甲醛分子的空间结构为平面三角形 (2)②⑤ (3)< 碳氧双键中存在π键,它对C—H键的排斥作用较强
解析 (1)原子的杂化轨道类型不同,分子的空间结构也不同。由图可知,甲醛分子为平面三角形,所以甲醛分子中的碳原子采取sp2杂化。
(2)醛类分子中都含有C==O键,所以甲醛分子中的碳氧键是双键。一般来说,双键是σ键和π键的组合。
(3)由于碳氧双键中存在π键,它对C—H键的排斥作用较强,所以甲醛分子中C—H键与C—H键间的夹角小于120°。
15.2001年是伟大的化学家、1954年诺贝尔化学奖得主、著名的化学结构大师、20世纪的科学怪杰鲍林(L.C.Pauling)教授的诞辰100周年。1994年这位老人谢世后,人们打开他的办公室,发现里面有一块黑板,画得满满的,其中一个结构式如图所示。老人为什么画这个结构式?它能合成吗?它有什么性质?不得而知。这是鲍林留给世人的一个谜,也许这是永远无法解开的谜,也许有朝一日你就能解开它。不管结果如何,让我们先对这个结构作一番了解。
(1)它的分子式是______________________________________________________________。
(2)它是否带有电荷?________(填“是”或“否”)。
(3)该分子中为sp杂化的氮原子有________个;sp2杂化的氮原子有________个;sp3杂化的氮原子有________个。
(4)为什么人们推测它是炸药?___________________________________________________。
答案 (1)C6H2O2N10 (2)否 (3)1 9 0 (4)它分解能产生大量很稳定的气体N2
解析 (1)根据有机物分子结构简式的书写规则,不难确定,每个环上除3个氮原子外还有3个碳原子,由此可以确定其分子式。(2)由电子数可以确定,该分子不带电荷。(3)根据氮原子的成键特征和结构可以确定,采取sp2杂化方式的氮原子数为9个,采取sp杂化方式的氮原子数为1个,无sp3杂化方式。
16.“三鹿奶粉事件”在社会上引起了人们对食品质量的恐慌,三鹿奶粉中掺杂了被称为“蛋白精”的工业原料三聚氰胺。已知三聚氰胺的结构简式如图所示。三聚氰胺是氰胺(H2N—C≡N)的三聚体,请回答下列问题:
(1)写出基态碳原子的电子排布式:________。
(2)氰胺中—C≡N中的氮原子、三聚氰胺环状结构中的氮原子和氨基中的氮原子,这三种氮原子的杂化轨道类型分别是________、________、________。
(3)一个三聚氰胺分子中有________个σ键。
(4)三聚氰胺与三聚氰酸()分子相互之间通过氢键结合,在肾脏内易形成结石。三聚氰酸分子中C原子采取________杂化。该分子的结构简式中,每个碳氧原子之间的共价键是________(填字母)。
A.2个σ键 B.2个π键
C.1个σ键、1个π键
答案 (1)1s22s22p2 (2)sp sp2 sp3 (3)15 (4)sp2 C
解析 (2)氰胺中—C≡N中的N原子、三聚氰胺环上的N原子、—NH2中的N原子分别形成1、2、3个σ键且均有一对未成键电子对,所以分别采取sp、sp2、sp3杂化。(3)除每个双键上有1个π键外,其余均为σ键,共15个。
(4)由于该分子中C与O形成双键,则应采取sp2方式成键,sp2杂化的C原子与氧原子间有1个σ键、1个π键。
第1课时 杂化轨道理论与分子空间结构
[核心素养发展目标]
1.了解杂化轨道理论,能从微观角度理解中心原子的杂化轨道类型对分子空间结构的影响。
2.通过对杂化轨道理论的学习,掌握中心原子杂化轨道类型的判断方法,建立分子空间结构分析的思维模型。
一、杂化轨道及其理论要点
1.试解释CH4分子为什么具有正四面体的空间结构?
(1)杂化轨道的形成
碳原子2s轨道上的1个电子进入2p空轨道,1个2s轨道和3个2p轨道“混合”起来,形成能量相等、成分相同的4个sp3杂化轨道,可表示为
(2)共价键的形成
碳原子的4个sp3杂化轨道分别与4个H原子的1s轨道重叠形成4个相同的σ键。
(3)CH4分子的空间结构
甲烷分子中的4个C—H键是等同的,C—H键之间的夹角——键角都是109°28′,形成正四面体型分子。
2.轨道杂化与杂化轨道
(1)轨道的杂化:在外界条件影响下,原子内部能量相近的原子轨道重新组合形成一组新轨道的过程叫做原子轨道的杂化。
(2)杂化轨道:重新组合后的新的原子轨道,叫做杂化原子轨道,简称杂化轨道。
(3)轨道杂化的过程:激发→杂化→轨道重叠。
3.杂化轨道的类型
杂化类型 sp sp2 sp3
参与杂化的原 子轨道及数目 ns 1 1 1
np 1 2 3
杂化轨道数目 2 3 4
1.正误判断,正确的打“√”,错误的打“×”
(1)发生轨道杂化的原子一定是中心原子( )
(2)原子轨道的杂化只有在形成分子的过程中才会发生,孤立的原子是不可能发生杂化的( )
(3)只有能量相近的轨道才能杂化( )
答案 (1)√ (2)√ (3)√
2.常见的杂化轨道类型有哪些?什么是sp3杂化?
提示 常见的杂化轨道类型有sp、sp2、sp3。同一原子内由1个ns轨道和3个np轨道参与的杂化称为sp3杂化。
1.下列关于杂化轨道的说法错误的是( )
A.所有原子轨道都参与杂化形成杂化轨道
B.同一原子中能量相近的原子轨道参与杂化
C.杂化轨道能量集中,有利于牢固成键
D.杂化轨道中不一定有一个电子
答案 A
解析 参与杂化的原子轨道,其能量不能相差太大,如1s轨道与2s、2p轨道能量相差太大,不能形成杂化轨道,即只有能量相近的原子轨道才能参与杂化,故A项错误、B项正确;杂化轨道的电子云一头大一头小,成键时利用大的一头,可使电子云重叠程度更大,形成牢固的化学键,故C项正确;并不是所有的杂化轨道中都会有电子,也可以是空轨道,也可以有一对孤电子对(如NH3),故D项正确。
2.下列有关sp2杂化轨道的说法错误的是( )
A.由同一电子层上的s轨道与p轨道杂化而成
B.共有3个能量相同的杂化轨道
C.每个sp2杂化轨道中s轨道成分占三分之一
D.sp2杂化轨道最多可形成2个σ键
答案 D
解析 同一电子层上s轨道与p轨道的能量差异不是很大,相互杂化的轨道的能量差异也不能过大,A项正确;同种类型的杂化轨道能量相同,B项正确;sp2杂化轨道是由一个s轨道与2个p轨道杂化而成的,C项正确;sp2杂化轨道最多可形成3个σ键,D项错误。
杂化轨道理论的要点
(1)原子形成分子时,通常存在激发、杂化和轨道重叠等过程。发生轨道杂化的原子一定是中心原子。
(2)原子轨道的杂化只有在形成分子的过程中才会发生,孤立的原子是不可能发生杂化的。
(3)只有能量相近的轨道才能杂化(如2s、2p)。
(4)杂化前后原子轨道数目不变(参加杂化的轨道数目等于形成的杂化轨道数目),且杂化轨道的能量相同。
(5)杂化轨道成键时要满足化学键间最小排斥原理,使轨道在空间取得最大夹角分布。故杂化后轨道的伸展方向、形状发生改变,但杂化轨道的形状完全相同。
二、用杂化轨道理论解释分子的形成及分子中的成键情况
1.用杂化轨道理论解释BeCl2、BF3分子的形成
(1)BeCl2分子的形成
杂化后的2个sp杂化轨道分别与氯原子的3p轨道发生重叠,形成2个σ键,构成直线形的BeCl2分子。
(2)BF3分子的形成
2.用杂化轨道理论解释乙烯、乙炔分子中的成键情况
(1)乙烯分子中的成键情况
在乙烯分子中,C原子采取sp2杂化,形成3个杂化轨道,两个碳原子各以1个杂化轨道互相重叠,形成1个C—C σ键,每个C原子的另外两个杂化轨道分别与2个氢原子的1s轨道重叠,形成2个C—H σ键,这样形成的5个键在同一平面上,此外每个C原子还剩下1个未杂化的2p轨道,它们发生重叠,形成1个π键。其结构示意图如下:
(2)乙炔分子中的成键情况
在乙炔分子中,碳原子采取sp杂化,形成2个杂化轨道,两个碳原子各以1个杂化轨道互相重叠,形成1个C—C σ键,每一个碳原子又各以1个杂化轨道分别与1个氢原子形成C—H σ键,这样形成的3个键在同一直线上,此外每个碳原子还有2个未杂化的2p轨道,它们发生重叠,形成2个π键。其结构示意图如下:
杂化轨道的类型与分子空间结构的关系
杂化类型 sp sp2 sp3
杂化轨道间的夹角 180° 120° 109°28′
空间结构 直线形 平面三角形 正四面体型
实例 BeCl2、CO2、CS2等 BCl3、BF3、BBr3等 CF4、SiCl4、SiH4等
特别提醒 杂化轨道只能形成σ键,不能形成π键。
(1)杂化轨道与参与杂化的原子轨道的数目相同,但能量不同( √ )
(2)杂化轨道的键角与分子内的键角不一定相同( √ )
(3)只要分子的空间结构为平面三角形,中心原子均为sp2杂化( √ )
(4)杂化方式相同的分子,空间结构一定相同( × )
1.有关杂化轨道的说法不正确的是( )
A.杂化前后的轨道数不变,但轨道的形状发生了改变
B.sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180°
C.杂化轨道既可形成σ键,又可形成π键
D.已知CO2为直线形分子,其分子结构可以用sp杂化轨道解释
答案 C
解析 杂化前后的轨道数不变,杂化后,各个轨道尽可能分散、对称分布,导致轨道的形状发生了改变,A正确; sp3、sp2、sp杂化轨道其空间结构分别是正四面体型、平面三角形、直线形,所以其夹角分别为109°28′、120°、180°,B正确;杂化轨道只能形成σ键,C错误;直线形分子的键角为180°,中心原子的杂化方式是sp,D正确。
2.有机物H3CH==H—≡CH中标有“·”的碳原子的杂化方式依次为( )
A.sp、sp2、sp3 B.sp3、sp2、sp
C.sp2、sp、sp3 D.sp3、sp、sp2
答案 B
3.在中,中间的碳原子和两边的碳原子分别采用的杂化方式是( )
A.sp2、sp2 B.sp3、sp3
C.sp2、sp3 D.sp、sp3
答案 C
解析 杂化轨道数=中心原子上的孤电子对数+中心原子的σ键个数。中间的碳原子上的孤电子对数为0,σ键个数为3,则杂化方式是sp2杂化;两边的碳原子上的孤电子对数为0,σ键个数为4,则杂化方式是sp3。
方法规律——中心原子杂化类型的判断方法
(1)根据杂化轨道之间的夹角判断:若杂化轨道之间的夹角为109°28′,则中心原子发生sp3杂化;若杂化轨道之间的夹角为120°,则中心原子发生sp2杂化;若杂化轨道之间的夹角为180°,则中心原子发生sp杂化。
(2)有机物中碳原子杂化类型的判断:饱和碳原子采取sp3杂化,连接双键的碳原子采取sp2杂化,连接三键的碳原子采取sp杂化。
1.鲍林是两位获得诺贝尔奖不同奖项的人之一,杂化轨道是鲍林为了解释分子的空间结构提出的。下列对sp3、sp2、sp杂化轨道的夹角的比较,得出结论正确的是( )
A.sp杂化轨道的夹角最大
B.sp2杂化轨道的夹角最大
C.sp3杂化轨道的夹角最大
D.sp3、sp2、sp杂化轨道的夹角相等
答案 A
解析 sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180°,故A项正确。
2.下列有关sp杂化轨道的叙述正确的是( )
A.是由一个1s轨道和一个2p轨道线性组合而成
B.sp杂化轨道中的两个杂化轨道完全相同
C.sp杂化轨道可与其他原子轨道形成σ键和π键
D.sp杂化轨道有两个,一个能量高,另一个能量低
答案 B
解析 sp杂化轨道是同一原子内同一电子层,能量相近的轨道发生的杂化,A项错误;不同类型能量相近的原子轨道混合起来,重新组合成一组新的轨道,所形成两个能量等同的sp杂化轨道,B项正确、D项错误;杂化轨道用于形成σ键,未杂化的轨道形成π键,不是杂化轨道形成π键,C项错误。
3.乙烯分子中含有4个C—H键和1个C==C键,6个原子在同一平面上。下列关于乙烯分子的成键情况分析正确的是( )
①每个C原子的2s轨道与2p轨道杂化,形成两个sp杂化轨道 ②每个C原子的2s轨道与2个2p轨道杂化,形成3个sp2杂化轨道 ③每个C原子的2s轨道与3个2p轨道杂化,形成4个sp3杂化轨道 ④每个C原子的3个外围电子占据3个杂化轨道,1个外围电子占据1个2p轨道
A.①③ B.②④ C.①④ D.②③
答案 B
解析 乙烯分子中键角为120°,为sp2杂化,形成3个sp2杂化轨道,1个外围电子占据1个2p轨道,2个C原子成键时形成1个π键,②④正确。
4.在乙炔分子中有3个σ键、2个π键,它们分别是( )
A.sp杂化轨道形成σ键、未杂化的2个2p轨道形成2个π键,且互相垂直
B.sp杂化轨道形成σ键、未杂化的2个2p轨道形成2个π键,且互相平行
C.C—H键之间是sp杂化轨道形成的σ键,C—C键之间是未参加杂化的2p轨道形成的π键
D.C—C键之间是sp杂化轨道形成的σ键,C—H键之间是未参加杂化的2p轨道形成的π键
答案 A
解析 碳原子形成乙炔时,一个2s轨道和一个2p轨道杂化成两个sp轨道,另外的两个2p轨道保持不变,其中一个sp轨道与氢原子的1s轨道“头碰头”重叠形成C—Hσ键,另一个sp轨道则与另一个碳原子的sp轨道“头碰头”重叠形成C—C σ键,碳原子剩下的两个2p轨道则“肩并肩”重叠形成两个C—C π键,且这两个π键互相垂直。
5.石墨烯(图甲)是一种由单层碳原子构成的平面结构新型材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(图乙)。
(1)图甲中,1号C与相邻C形成σ键的个数为________。
(2)图乙中,1号C的杂化方式是__________,该C与相邻C形成的键角________(填“>”“<”或“=”)图甲中1号C 与相邻C形成的键角。
答案 (1)3 (2)sp3 <
解析 (1)图甲中,1号C与相邻的3个C形成1个碳碳双键和2个碳碳单键,即形成3个σ键和1个π键。
(2)图乙中,1号C除与3个C形成化学键外,还与羟基氧原子形成化学键,故该C原子采取sp3杂化。
题组一 原子轨道杂化与杂化轨道
1.下列说法错误的是( )
A.第ⅠA族元素成键时不可能有杂化轨道
B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和1个C原子的2p轨道混合起来而形成的
C.孤电子对有可能参加杂化
D.s轨道和p轨道杂化不可能有sp4出现
答案 B
解析 第ⅠA族元素的外围电子排布式为ns1,由于只有1个ns电子,因此不可能形成杂化轨道;H2O分子中的氧原子采取sp3杂化,其sp3杂化轨道有2个是由孤电子对占据的,所以孤电子对有可能参加杂化;由于np能级只有3个原子轨道,所以s轨道和p轨道杂化只有sp3、sp2、sp 3种,不可能出现sp4杂化。
2.氨气分子空间结构是三角锥型,而甲烷是正四面体型,这是因为( )
A.两种分子的中心原子杂化轨道类型不同,NH3为sp2杂化,而CH4是sp3杂化
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道
C.NH3分子中有一对未成键的孤电子对,它对成键电子对的排斥作用较强
D.氨气的相对分子质量大于甲烷
答案 C
解析 本题考查分子空间结构的判断。NH3中N原子形成3个σ键,有一对未成键的孤电子对,杂化轨道数为4,采取sp3杂化,孤电子对对成键电子对的排斥作用较强,N—H键之间的键角小于109°28′,所以氨气分子空间结构是三角锥型;CH4分子中C原子采取sp3杂化,杂化轨道全部用于成键,碳原子连接4个相同的原子,C—H键之间的键角相等为109°28′,故CH4的空间结构为正四面体型,故A、B、D错误,C正确。
3.下列有关杂化轨道的说法不正确的是( )
A.原子中能量相近的某些轨道,在成键时,能重新组合成能量相等的新轨道
B.轨道数目杂化前后可以相等,也可以不等
C.杂化轨道成键时,要满足原子轨道最大重叠原理、能量最低原理
D.CH4分子中任意两个C—H键的夹角均为109°28′
答案 B
解析 原子轨道形成杂化轨道前后,轨道数目不变化,用于形成杂化轨道的原子轨道的能量相近,并满足最大重叠程度,故选B。
题组二 杂化类型的判断
4.BF3是典型的平面三角形分子,它溶于氢氟酸或NaF溶液中都形成BF,则BF3和BF中B原子的杂化轨道类型分别是( )
A.sp2、sp2 B.sp3、sp3
C.sp2、sp3 D.sp、sp2
答案 C
5.甲烷中的碳原子是sp3杂化,下列用*表示的碳原子的杂化和甲烷中的碳原子杂化类型一致的是( )
A.CH≡CH3 B.H2==CHCH3
C.CH2==HCH3 D.CH2==CHH3
答案 D
解析 D项中用*表示的碳原子形成了四个σ键,与甲烷类似,其为sp3杂化。
6.下列分子或离子中,不存在sp3杂化的是( )
A.SO B.NH3 C.C2H6 D.SO2
答案 D
解析 A项,在SO中S原子采取sp3杂化,错误;B项,NH3中N原子采取sp3杂化,错误;C项,C2H6中C原子采取sp3杂化,错误;D项,SO2中S原子采取sp2杂化,正确。
7.下列分子所含原子中,既有sp3杂化,又有sp2杂化的是( )
A.乙醛[]
B.丙烯腈[]
C.甲醛[]
D.丙炔[]
答案 A
解析 乙醛中甲基的碳原子采取sp3杂化,醛基中碳原子采取sp2杂化;丙烯腈中碳碳双键的两个碳原子采取sp2杂化,另一个碳原子采取sp杂化;甲醛中碳原子采取sp2杂化;丙炔中甲基碳原子采取sp3杂化,碳碳三键中两个碳原子采取sp杂化。
8.下列分子中的中心原子为sp杂化,分子的空间结构为直线形,且分子中没有形成π键的是( )
A.CH≡CH B.CO2 C.BeCl2 D.BBr3
答案 C
解析 CH≡CH和CO2中的C原子均采取sp杂化,且都含有π键;BeCl2分子中Be采取sp杂化,没形成π键;BBr3中B原子采取sp2杂化,且没有π键。
题组三 杂化轨道理论的应用
9.形成下列分子时,中心原子采用sp3杂化轨道和另一个原子的p轨道成键的是( )
①PF3 ②CF4 ③NH3 ④H2O
A.①② B.②③ C.③④ D.①④
答案 A
解析 PF3、CF4、NH3、H2O分子中P原子、C原子、N原子、O原子都采取sp3杂化, NH3和H2O分子中H原子以1s轨道与N和O原子形成σ键,PF3和CF4分子中F原子以2p轨道分别与P和C原子形成σ键。
10.(2020·兰州高二月考)sp3杂化形成的AB4型分子的空间结构是( )
A.平面四边形 B.正四面体型
C.三角锥型 D.平面三角形
答案 B
11.氮的最高价氧化物为无色晶体,它由NO和NO构成,已知其阴离子结构为平面三角形,阳离子中氮的杂化方式为sp,则其阳离子的结构和阴离子中氮的杂化方式为( )
A.直线形 sp2 B.V形 sp
C.平面三角形 sp2 D.平面三角形 sp3
答案 A
解析 NO结构为平面三角形,其中氮原子的杂化方式为sp2;NO中氮的杂化方式为sp,结构为直线形。
12.化合物A是一种新型锅炉水除氧剂,其结构式如图所示:,下列说法正确的是( )
A.碳、氮原子的杂化类型相同
B.氮原子与碳原子分别为sp3杂化与sp2杂化
C.1 mol A分子中所含σ键的数目为10NA
D.编号为a的氮原子和与其成键的另外三个原子在同一平面内
答案 B
解析 A分子中碳、氮原子各形成了3个σ键,氮原子有一对孤电子对而碳原子没有,故氮原子是sp3杂化而碳原子是sp2杂化,A项错误、B项正确;A分子中有一个碳氧双键,故有12对共用电子对、11个σ键,C项错误;氮原子为sp3杂化,相应的四个原子形成的是三角锥型结构,不可能共平面,D项错误。
13.白磷是一种能自燃的单质,其分子的结构模型如图所示:,下列叙述错误的是( )
A.每个磷原子形成3个σ键,磷原子为sp2杂化
B.磷原子均为sp3杂化
C.1 mol白磷中共含6 mol非极性键
D.白磷分子的空间结构为正四面体型
答案 A
解析 由白磷分子的结构模型图可知,每个磷原子均形成了3个σ键,且每个磷原子还有一对孤电子对,故磷原子为sp3杂化,A项错误、B项正确;由图可知C、D项正确。
14.如图是甲醛分子的结构模型,根据该图和所学化学知识回答下列问题:
(1)甲醛分子中碳原子的杂化方式是__________,作出该判断的主要理由是___________。
(2)下列是对甲醛分子中碳氧键的判断,其中正确的是________(填序号)。
①单键 ②双键 ③σ键 ④π键 ⑤σ键和π键
(3)甲醛分子中C—H键与C—H键之间的夹角________(填“=”“>”或“<”)120°,出现该现象的主要原因是__________________________________________________________。
答案 (1)sp2 甲醛分子的空间结构为平面三角形 (2)②⑤ (3)< 碳氧双键中存在π键,它对C—H键的排斥作用较强
解析 (1)原子的杂化轨道类型不同,分子的空间结构也不同。由图可知,甲醛分子为平面三角形,所以甲醛分子中的碳原子采取sp2杂化。
(2)醛类分子中都含有C==O键,所以甲醛分子中的碳氧键是双键。一般来说,双键是σ键和π键的组合。
(3)由于碳氧双键中存在π键,它对C—H键的排斥作用较强,所以甲醛分子中C—H键与C—H键间的夹角小于120°。
15.2001年是伟大的化学家、1954年诺贝尔化学奖得主、著名的化学结构大师、20世纪的科学怪杰鲍林(L.C.Pauling)教授的诞辰100周年。1994年这位老人谢世后,人们打开他的办公室,发现里面有一块黑板,画得满满的,其中一个结构式如图所示。老人为什么画这个结构式?它能合成吗?它有什么性质?不得而知。这是鲍林留给世人的一个谜,也许这是永远无法解开的谜,也许有朝一日你就能解开它。不管结果如何,让我们先对这个结构作一番了解。
(1)它的分子式是______________________________________________________________。
(2)它是否带有电荷?________(填“是”或“否”)。
(3)该分子中为sp杂化的氮原子有________个;sp2杂化的氮原子有________个;sp3杂化的氮原子有________个。
(4)为什么人们推测它是炸药?___________________________________________________。
答案 (1)C6H2O2N10 (2)否 (3)1 9 0 (4)它分解能产生大量很稳定的气体N2
解析 (1)根据有机物分子结构简式的书写规则,不难确定,每个环上除3个氮原子外还有3个碳原子,由此可以确定其分子式。(2)由电子数可以确定,该分子不带电荷。(3)根据氮原子的成键特征和结构可以确定,采取sp2杂化方式的氮原子数为9个,采取sp杂化方式的氮原子数为1个,无sp3杂化方式。
16.“三鹿奶粉事件”在社会上引起了人们对食品质量的恐慌,三鹿奶粉中掺杂了被称为“蛋白精”的工业原料三聚氰胺。已知三聚氰胺的结构简式如图所示。三聚氰胺是氰胺(H2N—C≡N)的三聚体,请回答下列问题:
(1)写出基态碳原子的电子排布式:________。
(2)氰胺中—C≡N中的氮原子、三聚氰胺环状结构中的氮原子和氨基中的氮原子,这三种氮原子的杂化轨道类型分别是________、________、________。
(3)一个三聚氰胺分子中有________个σ键。
(4)三聚氰胺与三聚氰酸()分子相互之间通过氢键结合,在肾脏内易形成结石。三聚氰酸分子中C原子采取________杂化。该分子的结构简式中,每个碳氧原子之间的共价键是________(填字母)。
A.2个σ键 B.2个π键
C.1个σ键、1个π键
答案 (1)1s22s22p2 (2)sp sp2 sp3 (3)15 (4)sp2 C
解析 (2)氰胺中—C≡N中的N原子、三聚氰胺环上的N原子、—NH2中的N原子分别形成1、2、3个σ键且均有一对未成键电子对,所以分别采取sp、sp2、sp3杂化。(3)除每个双键上有1个π键外,其余均为σ键,共15个。
(4)由于该分子中C与O形成双键,则应采取sp2方式成键,sp2杂化的C原子与氧原子间有1个σ键、1个π键。
