吉林省白城市洮南第一高级中学校2021-2022学年高二上学期第三次月考化学试卷(Word版含答案)
文档属性
| 名称 | 吉林省白城市洮南第一高级中学校2021-2022学年高二上学期第三次月考化学试卷(Word版含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-15 22:25:59 | ||
图片预览


文档简介
洮南第一高级中学校2021-2022学年高二上学期第三次月考
化学试题
考试时长: 90分钟 满分:100分
第一部分 选择题(共50分)
可能用到的相对原子质量:H-1 C—12 O-16 Ag-108 Na-23 K-39
一、选择题(每小题只有1个选项符合题意。每小题2分,共50分。)
1.化学与社会、生活密切相关。下列说法不正确的是( )
A.锅炉水垢中含有的,可先用溶液处理,后用酸除去
B.在其他外界条件不变的情况,汽车排气管中使用催化剂,可改变产生尾气的反应方向
C.疫苗一般应冷藏存放,以减小蛋白质变性的速率
D.用作沉淀剂,除去水中的和
2.用惰性电极电解等物质的量Na2SO4、AgNO3、KCl的混合液,最先从阴极和阳极上析出的物质分别是( )
A.H2和Cl2 B.Ag和Cl2 C.H2和O2 D.Ag和O2
3.把、、、四块金属片浸泡在稀中,用导线两两相连可以组成多种原电池:若、相连时,为负极;、相连时,为负极;、相连时,为正极;、相连时,为正极.则这四种金属的活动性顺序由强到弱为
A. B. C. D.
4.分别按如图甲、乙所示装置进行实验,图中两个烧杯里的溶液均为2 L同浓度的稀硝酸和NaOH溶液,A为电流表。下列说法正确的是( )
A.甲烧杯溶液中H+会向铝片移动
B.两烧杯中铜片表面均有H2产生
C.两烧杯中溶液pH变化不同
D.乙的内电路中电子流动方向为Al→溶液→Cu
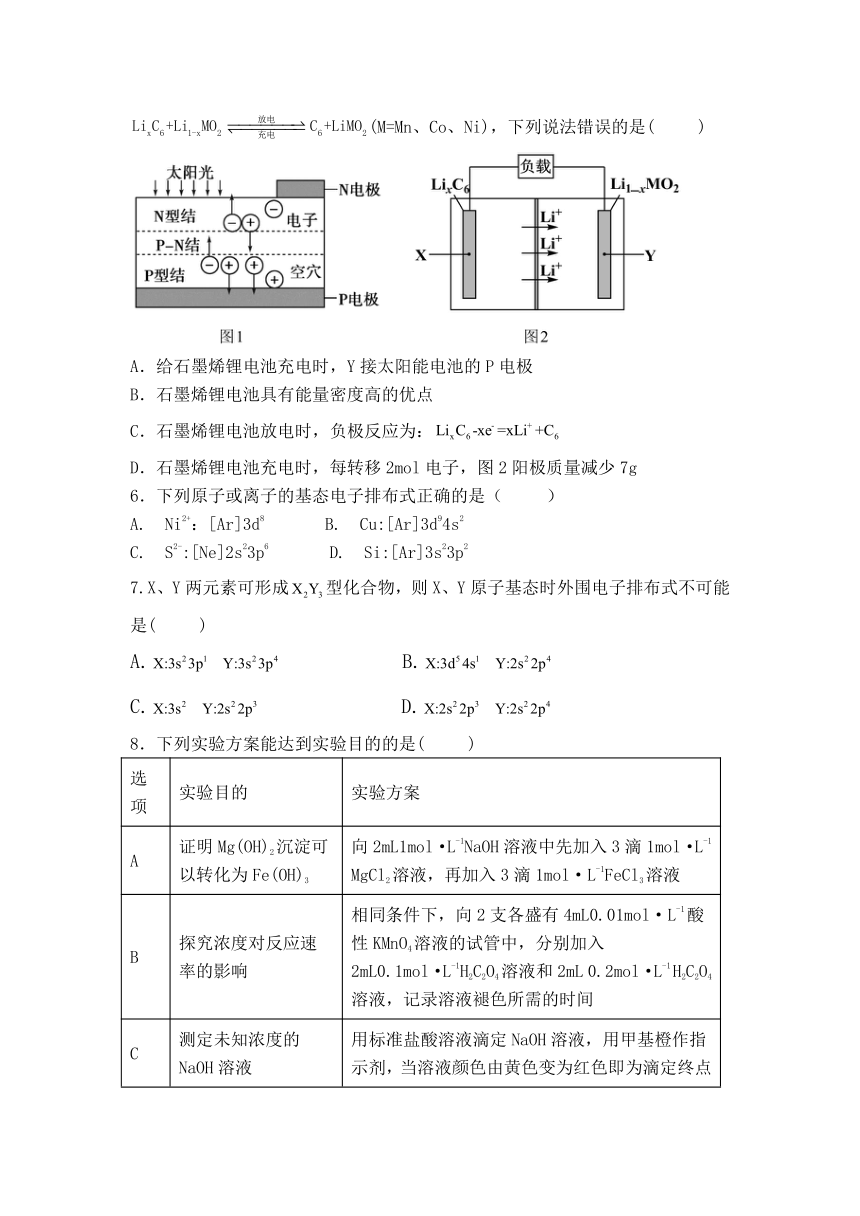
5.近年来国家大力扶持新能源项目建设。图1是太阳能电池工作示意图,可与图2石墨烯锂电池联合使用。已知石墨烯锂电池的反应式为:(M=Mn、Co、Ni),下列说法错误的是( )
A.给石墨烯锂电池充电时,Y接太阳能电池的P电极
B.石墨烯锂电池具有能量密度高的优点
C.石墨烯锂电池放电时,负极反应为:
D.石墨烯锂电池充电时,每转移2mol电子,图2阳极质量减少7g
6.下列原子或离子的基态电子排布式正确的是( )
A. Ni2+:[Ar]3d8 B. Cu:[Ar]3d94s2
C. S2-:[Ne]2s23p6 D. Si:[Ar]3s23p2
7.X、Y两元素可形成型化合物,则X、Y原子基态时外围电子排布式不可能是( )
A. B.
C. D.
8.下列实验方案能达到实验目的的是( )
选项 实验目的 实验方案
A 证明Mg(OH)2沉淀可以转化为Fe(OH)3 向2mL1mol·L-1NaOH溶液中先加入3滴1mol·L-1 MgCl2溶液,再加入3滴1mol·L-1FeCl3溶液
B 探究浓度对反应速率的影响 相同条件下,向2支各盛有4mL0.01mol·L-1酸性KMnO4溶液的试管中,分别加入2mL0.1mol·L-1H2C2O4溶液和2mL 0.2mol·L-1 H2C2O4溶液,记录溶液褪色所需的时间
C 测定未知浓度的NaOH溶液 用标准盐酸溶液滴定NaOH溶液,用甲基橙作指示剂,当溶液颜色由黄色变为红色即为滴定终点
D 比较HClO和H2CO3的酸性强弱 常温下,用pH试纸分别测定浓度均为0.1 mol·L-1的NaClO溶液和NaHCO3溶液的pH
9.已知:BaMoO4、BaSO4均难溶于水,lg2≈0.3,离子浓度≤10-5mol/L时认为其沉淀完全。T℃时,BaMoO4、BaSO4的沉淀溶解平衡曲线如图所示,其中p(Ba)=-lgc(Ba2+),p(X)=-lgc(MoO)或-lgc(SO)。下列叙述正确的是( )
A.T℃时,Z点对应为BaMoO4的不饱和溶液
B.T℃时,向等浓度的Na2SO4和Na2MoO4的混合溶液中加入BaCl2溶液,先析出BaMoO4沉淀
C.T℃时,Ksp(BaMoO4)的数量级为10-7
D.T℃时,BaMoO4(s)+SOBaSO4(s)+MoO的平衡常数K=200
10.下列金属防腐的措施中,属于牺牲阳极法的是( )
A.水中的钢闸门连接电源的负极 B.金属护栏表面涂漆
C.汽车底盘喷涂高分子膜 D.地下钢管连接锌板
11.已知,,。某溶液中含有Ag+、Cu2+和Sb3+,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的Na2S溶液时,三种阳离子产生沉淀的先后顺序为( )
A.Ag+、Cu2+、Sb3+ B.Cu2+、Ag+、Sb3+
C.Sb3+、Ag+、Cu2+ D.Ag+、Sb3+、Cu2+
12.下列说法中正确的是( )
A.电解熔融状态下的AlCl3或Al2O3均可得到单质铝
B.钢铁、铜在适当条件均可发生吸氧腐蚀、析氢腐蚀
C.向的稀混合液中滴加AgNO3溶液,可确定Ksp(AgCl)、Ksp(AgI)的相对大小
D.BaSO4、BaCO3均难溶于水,故BaCO3不能与Na2SO4溶液反应
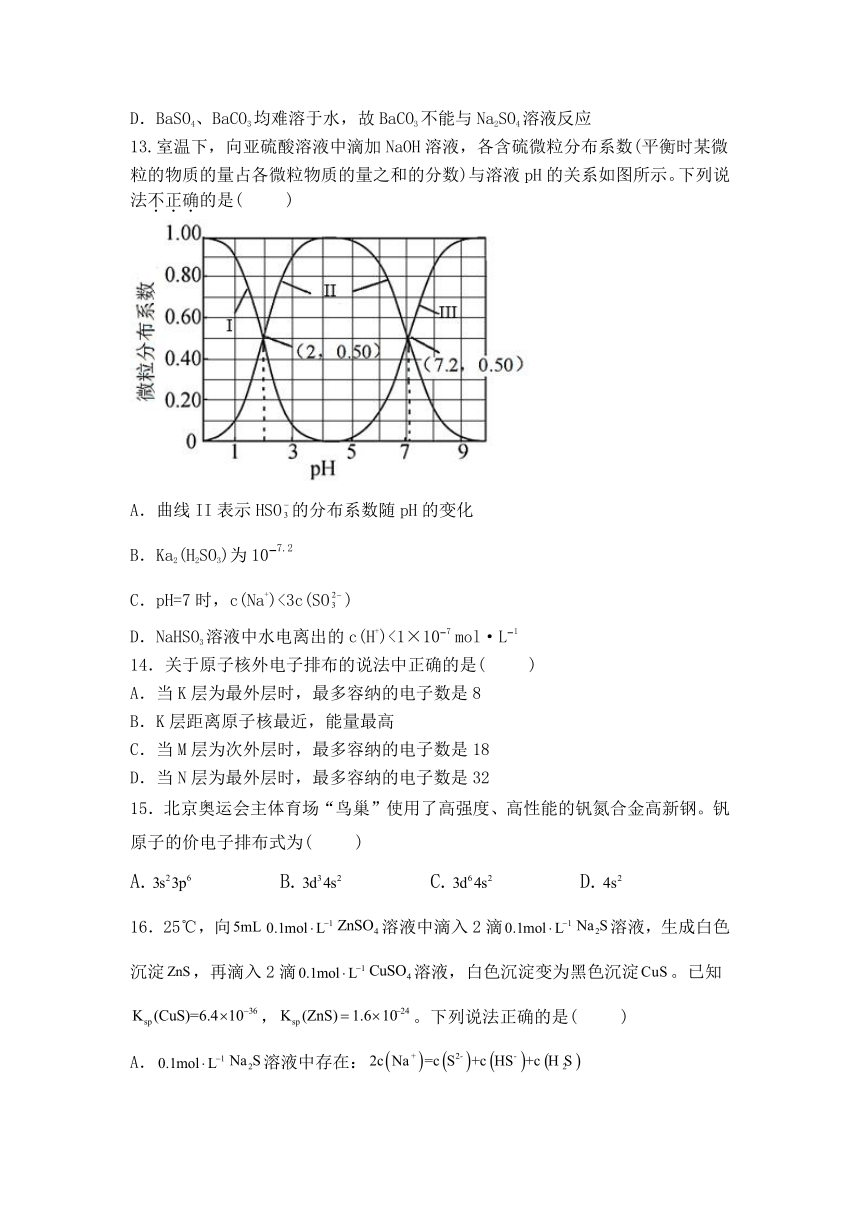
13.室温下,向亚硫酸溶液中滴加NaOH溶液,各含硫微粒分布系数(平衡时某微粒的物质的量占各微粒物质的量之和的分数)与溶液pH的关系如图所示。下列说法不正确的是( )
A.曲线II表示HSO的分布系数随pH的变化
B.Ka2(H2SO3)为10 7.2
C.pH=7时,c(Na+)<3c(SO)
D.NaHSO3溶液中水电离出的c(H+)<1×10 7 mol·L 1
14.关于原子核外电子排布的说法中正确的是( )
A.当K层为最外层时,最多容纳的电子数是8
B.K层距离原子核最近,能量最高
C.当M层为次外层时,最多容纳的电子数是18
D.当N层为最外层时,最多容纳的电子数是32
15.北京奥运会主体育场“鸟巢”使用了高强度、高性能的钒氮合金高新钢。钒原子的价电子排布式为( )
A. B. C. D.
16.25℃,向溶液中滴入2滴溶液,生成白色沉淀,再滴入2滴溶液,白色沉淀变为黑色沉淀。已知,。下列说法正确的是( )
A.溶液中存在:
B.滴入溶液后溶解,增大
C.白色沉淀变为黑色沉淀的离子方程式为
D.向、混合溶液中加入过量溶液,充分反应后静置,则上层清液中
17.下列描述中,不符合生产实际的是( )
A.电解熔融的氯化镁制取金属镁,用铁作阳极
B.电解法精炼粗铜,用纯铜作阴极
C.工业上电解饱和食盐水制烧碱,用阳离子交换膜阻止OH-移向阳极
D.在镀件上电镀铜,用铜作阳极
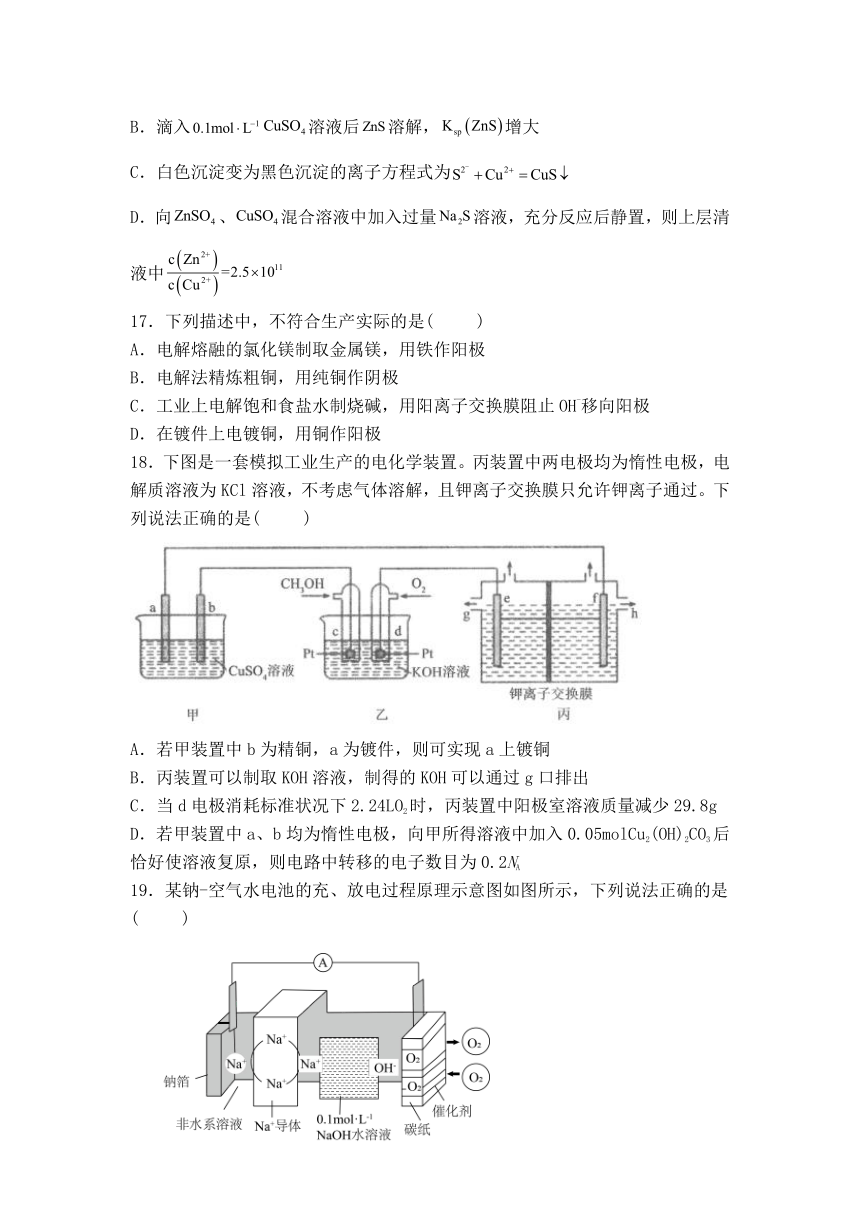
18.下图是一套模拟工业生产的电化学装置。丙装置中两电极均为惰性电极,电解质溶液为KCl溶液,不考虑气体溶解,且钾离子交换膜只允许钾离子通过。下列说法正确的是( )
A.若甲装置中b为精铜,a为镀件,则可实现a上镀铜
B.丙装置可以制取KOH溶液,制得的KOH可以通过g口排出
C.当d电极消耗标准状况下2.24LO2时,丙装置中阳极室溶液质量减少29.8g
D.若甲装置中a、b均为惰性电极,向甲所得溶液中加入0.05molCu2(OH)2CO3后恰好使溶液复原,则电路中转移的电子数目为0.2NA
19.某钠-空气水电池的充、放电过程原理示意图如图所示,下列说法正确的是( )
A.放电时,向负极移动
B.放电时,电子由钠箔经导线流向碳纸
C.充电时,当有通过导线时,则钠箔减重
D.充电时,碳纸与电源负极相连,电极反应式为
20.某种利用垃圾渗透液实现发电的装置示意图如下,当该装置工作时,下列说法不正确的是( )
A.电子流由Y极沿导线流向X极
B.电路中流过7.5mol电子时,共产生标准状况下的体积为44.8L
C.盐桥中向Y极移动。
D.Y极发生的反应为,周围pH增大
21.钴(Co)合金广泛应用于机械制造等领域。如图为水溶液中电解制备金属钴和回收盐酸的装置图。下列说法正确的是( )
A.a为直流电源负极
B.X膜为阳离子交换膜
C.移除两交换膜后,两电极上发生的反应都不变
D.每生成1molCo,I室溶液质量理论上减少16g
22.下列关于金属的腐蚀与防护的叙述不正确的是( )
A.图①马口铁(镀锡铁)即使镀层破损,依然不易生锈
B.图②若将钢闸门与电源的负极相连,可防止钢闸门腐蚀
C.图②若断开电源,钢闸门将发生吸氧腐蚀
D.图③若金属M比铁活泼,可防止钢铁输水管腐蚀
23.常温下,有下列四种溶液:①的溶液 ②的HCl溶液 ③的氨水 ④的NaOH溶液,下列有关说法正确的是( )
A.四种溶液的Kw相同,由水电离的:①=③>②=④
B.向等体积的四种溶液中分别加入100mL水后,溶液的pH:③>④>②>①
C.①、②溶液分别与足量锌粉反应,生成H2的量:① =②
D.将②、③两种溶液混合后,若,消耗溶液的体积为:③>②
24.CuI是一种不溶于水的白色固体,它可以由反应2Cu2++4I-=2CuI↓+I2得到。下图所示装置中,a、b都是惰性电极,通电一段时间后,在KI-淀粉溶液中阳极周围变蓝色。下列说法正确的是( )
A.若a极变红,则在Pt电极上:2I-_2e-=I2,I2遇淀粉变蓝
B.若b极变红,则在Pt电极上:2H2O-4e-=O2↑+4H+,O2将I-氧化为I2,I2遇淀粉变蓝
C.若a极变红,则在Cu电极上:2Cu+4I-_4e-=2CuI↓+I2,I2遇淀粉变蓝
D.若b极变红,则在Cu电极上:Cu-2e-=Cu2+,Cu2+显蓝色
25.废气的污染成为世界各国关注的焦点,科技团队研究发现利用工业尾气中硫化物与氮氧化物, 可以制取Na2S2O4和NH4NO3(Ce为铈元素):
有关该流程下列说法错误的是( )
A.有极强的还原性,属于强还原剂
B.装置Ⅱ中若生成2NA个H+(NA代表阿伏伽德罗常数)则消耗18g水
C.装置Ⅲ再生5 mol Ce4+,若用甲烷燃料电池进行电解,理论上要消耗12 g甲烷
D.装置Ⅳ获得粗产品NH4NO3的实验操作依次为蒸发浓缩、冷却结晶、过滤、洗涤等
第II卷(非选择题,共50分)
26.(18分)(1)图中各容器中盛有相同浓度的稀硫酸,铁被腐蚀的速率由快到慢的顺序是
(2)某兴趣小组的同学以甲醇燃料电池为电源研究有关电化学的问题。
①甲池中,通入甲醇一极的电极反应式为___________。
②乙池中,A极石墨电极的电极反应式为___________。
③丙池中,通电前C、D两电极的质量相同,通电一段时间后。
a.C电极的电极反应式为___________,溶液中c(Ag+)将 ___________填“增大”“减小”或“不变”。
b.两极的质量相差17.28g,则甲池中消耗O2的体积为___________mL(标准状况下。
丁池中,利用离子交换膜控制电解液中c(OH-)来制备纳米Cu2O,离子交换膜为阴离子交换膜。
a.Ti电极的电极反应式为___________,其附近溶液的碱性将___________填“增大”“减小”或“不变”。
b.Cu电极的电极反应式为_________
27.(12分)(1)在25℃下,向浓度均为0.1 mol L 1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成_______沉淀(填化学式),生成该沉淀的离子方程式为 。(已知25℃时,Ksp[Mg(OH)2]=1.8×10 11,Ksp[Cu(OH)2]=2.2×10 20)
(2)相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol L 1盐酸、③0.1 mol L 1氯化镁溶液、④0.1 mol L 1硝酸银溶液中,c(Ag+)由大到小的顺序为:_______
(3)已知:Ksp(AgBr)=5.4×10 13,Ksp(AgCl)=1.8×10 10,向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,=_______。
(4)已知在25℃时,Ksp[Mg(OH)2]=3.2×10 11。25℃时,向0.02 mol L 1的MgCl2溶液中加入NaOH固体,如要生成Mg(OH)2沉淀,应使溶液中的c(OH-)最小为_______mol L 1。
(5)某温度,BaSO4在水中的沉淀溶解平衡曲线如图,下列说法正确的是
A.加入Na2SO4可使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.b点有BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
28.(14分)如图是一个电化学过程的示意图,请回答下列问题:
(1)若X为CuSO4溶液
①断开K1,闭合K2,Pt为_________极(填“正”或“负”或“阴”或“阳”),该极发生的电极反应式___________.
②断开K2,闭合K1,Pt极发生的电极反应式_________,Fe电极上的现象是_________.
(2)若X为滴有少量酚酞的NaCl溶液
①断开K1,闭合K2,铁能被腐蚀,该腐蚀属于_________腐蚀(填“吸氧”或“析氢”).Pt电极附近现象_________.
②断开K2,闭合K1,若导线中转移0.02 mol e-时断开K1,此时溶液体积为200 mL,室温下搅拌均匀后溶液的pH为_________.
29. (6分)向50mlL0.018mol/L AgNO3溶液中加入50 mL 0. 02 mol/L盐酸。已知AgCl(s)的溶度积常数Ksp=1×10-10,混合后溶液的体积变化忽略不计。请计算:
(1)沉淀生成后,溶液中c(Ag+)=
(2)沉淀生成后,溶液的pH=
(3)如果向沉淀生成后的溶液中继续加入50ml0.001mol/L的盐酸,是否产生沉淀? (填“是”或“否”)
化学答案
B C B C D A C B A D A C C C B D A C B A B A B C C
26.(18分,每空2分)
(1)④③②①
(2) ①CH3OH-6e-+8OH-=CO+6H2O
②2Cl- - 2e- = Cl2↑
③ a. Ag - e- =Ag+ 不变 b.448
④a.2H2O+2e-=H2↑+2OH- 增大 b.2Cu-2e-+2OH-=Cu2O+H2O
27.(12分,每空2分)
(1)Cu(OH)2 2NH3·H2O+Cu2+ =Cu(OH)2↓+2NH
(2) ④>①>②>③
(3)3×10 3
(4) 4×10 5
(5) C
28.(14分,每空2分)
(1) ①正 Cu2+ + 2e- =Cu
②2H2O-4e-== O2↑+4H+ 红色物质生成
(2) ①吸氧 溶液变红
②13
29.(6分,每空2分)
(1)1×10-7mol/L (2)2 (3)否
化学试题
考试时长: 90分钟 满分:100分
第一部分 选择题(共50分)
可能用到的相对原子质量:H-1 C—12 O-16 Ag-108 Na-23 K-39
一、选择题(每小题只有1个选项符合题意。每小题2分,共50分。)
1.化学与社会、生活密切相关。下列说法不正确的是( )
A.锅炉水垢中含有的,可先用溶液处理,后用酸除去
B.在其他外界条件不变的情况,汽车排气管中使用催化剂,可改变产生尾气的反应方向
C.疫苗一般应冷藏存放,以减小蛋白质变性的速率
D.用作沉淀剂,除去水中的和
2.用惰性电极电解等物质的量Na2SO4、AgNO3、KCl的混合液,最先从阴极和阳极上析出的物质分别是( )
A.H2和Cl2 B.Ag和Cl2 C.H2和O2 D.Ag和O2
3.把、、、四块金属片浸泡在稀中,用导线两两相连可以组成多种原电池:若、相连时,为负极;、相连时,为负极;、相连时,为正极;、相连时,为正极.则这四种金属的活动性顺序由强到弱为
A. B. C. D.
4.分别按如图甲、乙所示装置进行实验,图中两个烧杯里的溶液均为2 L同浓度的稀硝酸和NaOH溶液,A为电流表。下列说法正确的是( )
A.甲烧杯溶液中H+会向铝片移动
B.两烧杯中铜片表面均有H2产生
C.两烧杯中溶液pH变化不同
D.乙的内电路中电子流动方向为Al→溶液→Cu
5.近年来国家大力扶持新能源项目建设。图1是太阳能电池工作示意图,可与图2石墨烯锂电池联合使用。已知石墨烯锂电池的反应式为:(M=Mn、Co、Ni),下列说法错误的是( )
A.给石墨烯锂电池充电时,Y接太阳能电池的P电极
B.石墨烯锂电池具有能量密度高的优点
C.石墨烯锂电池放电时,负极反应为:
D.石墨烯锂电池充电时,每转移2mol电子,图2阳极质量减少7g
6.下列原子或离子的基态电子排布式正确的是( )
A. Ni2+:[Ar]3d8 B. Cu:[Ar]3d94s2
C. S2-:[Ne]2s23p6 D. Si:[Ar]3s23p2
7.X、Y两元素可形成型化合物,则X、Y原子基态时外围电子排布式不可能是( )
A. B.
C. D.
8.下列实验方案能达到实验目的的是( )
选项 实验目的 实验方案
A 证明Mg(OH)2沉淀可以转化为Fe(OH)3 向2mL1mol·L-1NaOH溶液中先加入3滴1mol·L-1 MgCl2溶液,再加入3滴1mol·L-1FeCl3溶液
B 探究浓度对反应速率的影响 相同条件下,向2支各盛有4mL0.01mol·L-1酸性KMnO4溶液的试管中,分别加入2mL0.1mol·L-1H2C2O4溶液和2mL 0.2mol·L-1 H2C2O4溶液,记录溶液褪色所需的时间
C 测定未知浓度的NaOH溶液 用标准盐酸溶液滴定NaOH溶液,用甲基橙作指示剂,当溶液颜色由黄色变为红色即为滴定终点
D 比较HClO和H2CO3的酸性强弱 常温下,用pH试纸分别测定浓度均为0.1 mol·L-1的NaClO溶液和NaHCO3溶液的pH
9.已知:BaMoO4、BaSO4均难溶于水,lg2≈0.3,离子浓度≤10-5mol/L时认为其沉淀完全。T℃时,BaMoO4、BaSO4的沉淀溶解平衡曲线如图所示,其中p(Ba)=-lgc(Ba2+),p(X)=-lgc(MoO)或-lgc(SO)。下列叙述正确的是( )
A.T℃时,Z点对应为BaMoO4的不饱和溶液
B.T℃时,向等浓度的Na2SO4和Na2MoO4的混合溶液中加入BaCl2溶液,先析出BaMoO4沉淀
C.T℃时,Ksp(BaMoO4)的数量级为10-7
D.T℃时,BaMoO4(s)+SOBaSO4(s)+MoO的平衡常数K=200
10.下列金属防腐的措施中,属于牺牲阳极法的是( )
A.水中的钢闸门连接电源的负极 B.金属护栏表面涂漆
C.汽车底盘喷涂高分子膜 D.地下钢管连接锌板
11.已知,,。某溶液中含有Ag+、Cu2+和Sb3+,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的Na2S溶液时,三种阳离子产生沉淀的先后顺序为( )
A.Ag+、Cu2+、Sb3+ B.Cu2+、Ag+、Sb3+
C.Sb3+、Ag+、Cu2+ D.Ag+、Sb3+、Cu2+
12.下列说法中正确的是( )
A.电解熔融状态下的AlCl3或Al2O3均可得到单质铝
B.钢铁、铜在适当条件均可发生吸氧腐蚀、析氢腐蚀
C.向的稀混合液中滴加AgNO3溶液,可确定Ksp(AgCl)、Ksp(AgI)的相对大小
D.BaSO4、BaCO3均难溶于水,故BaCO3不能与Na2SO4溶液反应
13.室温下,向亚硫酸溶液中滴加NaOH溶液,各含硫微粒分布系数(平衡时某微粒的物质的量占各微粒物质的量之和的分数)与溶液pH的关系如图所示。下列说法不正确的是( )
A.曲线II表示HSO的分布系数随pH的变化
B.Ka2(H2SO3)为10 7.2
C.pH=7时,c(Na+)<3c(SO)
D.NaHSO3溶液中水电离出的c(H+)<1×10 7 mol·L 1
14.关于原子核外电子排布的说法中正确的是( )
A.当K层为最外层时,最多容纳的电子数是8
B.K层距离原子核最近,能量最高
C.当M层为次外层时,最多容纳的电子数是18
D.当N层为最外层时,最多容纳的电子数是32
15.北京奥运会主体育场“鸟巢”使用了高强度、高性能的钒氮合金高新钢。钒原子的价电子排布式为( )
A. B. C. D.
16.25℃,向溶液中滴入2滴溶液,生成白色沉淀,再滴入2滴溶液,白色沉淀变为黑色沉淀。已知,。下列说法正确的是( )
A.溶液中存在:
B.滴入溶液后溶解,增大
C.白色沉淀变为黑色沉淀的离子方程式为
D.向、混合溶液中加入过量溶液,充分反应后静置,则上层清液中
17.下列描述中,不符合生产实际的是( )
A.电解熔融的氯化镁制取金属镁,用铁作阳极
B.电解法精炼粗铜,用纯铜作阴极
C.工业上电解饱和食盐水制烧碱,用阳离子交换膜阻止OH-移向阳极
D.在镀件上电镀铜,用铜作阳极
18.下图是一套模拟工业生产的电化学装置。丙装置中两电极均为惰性电极,电解质溶液为KCl溶液,不考虑气体溶解,且钾离子交换膜只允许钾离子通过。下列说法正确的是( )
A.若甲装置中b为精铜,a为镀件,则可实现a上镀铜
B.丙装置可以制取KOH溶液,制得的KOH可以通过g口排出
C.当d电极消耗标准状况下2.24LO2时,丙装置中阳极室溶液质量减少29.8g
D.若甲装置中a、b均为惰性电极,向甲所得溶液中加入0.05molCu2(OH)2CO3后恰好使溶液复原,则电路中转移的电子数目为0.2NA
19.某钠-空气水电池的充、放电过程原理示意图如图所示,下列说法正确的是( )
A.放电时,向负极移动
B.放电时,电子由钠箔经导线流向碳纸
C.充电时,当有通过导线时,则钠箔减重
D.充电时,碳纸与电源负极相连,电极反应式为
20.某种利用垃圾渗透液实现发电的装置示意图如下,当该装置工作时,下列说法不正确的是( )
A.电子流由Y极沿导线流向X极
B.电路中流过7.5mol电子时,共产生标准状况下的体积为44.8L
C.盐桥中向Y极移动。
D.Y极发生的反应为,周围pH增大
21.钴(Co)合金广泛应用于机械制造等领域。如图为水溶液中电解制备金属钴和回收盐酸的装置图。下列说法正确的是( )
A.a为直流电源负极
B.X膜为阳离子交换膜
C.移除两交换膜后,两电极上发生的反应都不变
D.每生成1molCo,I室溶液质量理论上减少16g
22.下列关于金属的腐蚀与防护的叙述不正确的是( )
A.图①马口铁(镀锡铁)即使镀层破损,依然不易生锈
B.图②若将钢闸门与电源的负极相连,可防止钢闸门腐蚀
C.图②若断开电源,钢闸门将发生吸氧腐蚀
D.图③若金属M比铁活泼,可防止钢铁输水管腐蚀
23.常温下,有下列四种溶液:①的溶液 ②的HCl溶液 ③的氨水 ④的NaOH溶液,下列有关说法正确的是( )
A.四种溶液的Kw相同,由水电离的:①=③>②=④
B.向等体积的四种溶液中分别加入100mL水后,溶液的pH:③>④>②>①
C.①、②溶液分别与足量锌粉反应,生成H2的量:① =②
D.将②、③两种溶液混合后,若,消耗溶液的体积为:③>②
24.CuI是一种不溶于水的白色固体,它可以由反应2Cu2++4I-=2CuI↓+I2得到。下图所示装置中,a、b都是惰性电极,通电一段时间后,在KI-淀粉溶液中阳极周围变蓝色。下列说法正确的是( )
A.若a极变红,则在Pt电极上:2I-_2e-=I2,I2遇淀粉变蓝
B.若b极变红,则在Pt电极上:2H2O-4e-=O2↑+4H+,O2将I-氧化为I2,I2遇淀粉变蓝
C.若a极变红,则在Cu电极上:2Cu+4I-_4e-=2CuI↓+I2,I2遇淀粉变蓝
D.若b极变红,则在Cu电极上:Cu-2e-=Cu2+,Cu2+显蓝色
25.废气的污染成为世界各国关注的焦点,科技团队研究发现利用工业尾气中硫化物与氮氧化物, 可以制取Na2S2O4和NH4NO3(Ce为铈元素):
有关该流程下列说法错误的是( )
A.有极强的还原性,属于强还原剂
B.装置Ⅱ中若生成2NA个H+(NA代表阿伏伽德罗常数)则消耗18g水
C.装置Ⅲ再生5 mol Ce4+,若用甲烷燃料电池进行电解,理论上要消耗12 g甲烷
D.装置Ⅳ获得粗产品NH4NO3的实验操作依次为蒸发浓缩、冷却结晶、过滤、洗涤等
第II卷(非选择题,共50分)
26.(18分)(1)图中各容器中盛有相同浓度的稀硫酸,铁被腐蚀的速率由快到慢的顺序是
(2)某兴趣小组的同学以甲醇燃料电池为电源研究有关电化学的问题。
①甲池中,通入甲醇一极的电极反应式为___________。
②乙池中,A极石墨电极的电极反应式为___________。
③丙池中,通电前C、D两电极的质量相同,通电一段时间后。
a.C电极的电极反应式为___________,溶液中c(Ag+)将 ___________填“增大”“减小”或“不变”。
b.两极的质量相差17.28g,则甲池中消耗O2的体积为___________mL(标准状况下。
丁池中,利用离子交换膜控制电解液中c(OH-)来制备纳米Cu2O,离子交换膜为阴离子交换膜。
a.Ti电极的电极反应式为___________,其附近溶液的碱性将___________填“增大”“减小”或“不变”。
b.Cu电极的电极反应式为_________
27.(12分)(1)在25℃下,向浓度均为0.1 mol L 1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成_______沉淀(填化学式),生成该沉淀的离子方程式为 。(已知25℃时,Ksp[Mg(OH)2]=1.8×10 11,Ksp[Cu(OH)2]=2.2×10 20)
(2)相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol L 1盐酸、③0.1 mol L 1氯化镁溶液、④0.1 mol L 1硝酸银溶液中,c(Ag+)由大到小的顺序为:_______
(3)已知:Ksp(AgBr)=5.4×10 13,Ksp(AgCl)=1.8×10 10,向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,=_______。
(4)已知在25℃时,Ksp[Mg(OH)2]=3.2×10 11。25℃时,向0.02 mol L 1的MgCl2溶液中加入NaOH固体,如要生成Mg(OH)2沉淀,应使溶液中的c(OH-)最小为_______mol L 1。
(5)某温度,BaSO4在水中的沉淀溶解平衡曲线如图,下列说法正确的是
A.加入Na2SO4可使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.b点有BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
28.(14分)如图是一个电化学过程的示意图,请回答下列问题:
(1)若X为CuSO4溶液
①断开K1,闭合K2,Pt为_________极(填“正”或“负”或“阴”或“阳”),该极发生的电极反应式___________.
②断开K2,闭合K1,Pt极发生的电极反应式_________,Fe电极上的现象是_________.
(2)若X为滴有少量酚酞的NaCl溶液
①断开K1,闭合K2,铁能被腐蚀,该腐蚀属于_________腐蚀(填“吸氧”或“析氢”).Pt电极附近现象_________.
②断开K2,闭合K1,若导线中转移0.02 mol e-时断开K1,此时溶液体积为200 mL,室温下搅拌均匀后溶液的pH为_________.
29. (6分)向50mlL0.018mol/L AgNO3溶液中加入50 mL 0. 02 mol/L盐酸。已知AgCl(s)的溶度积常数Ksp=1×10-10,混合后溶液的体积变化忽略不计。请计算:
(1)沉淀生成后,溶液中c(Ag+)=
(2)沉淀生成后,溶液的pH=
(3)如果向沉淀生成后的溶液中继续加入50ml0.001mol/L的盐酸,是否产生沉淀? (填“是”或“否”)
化学答案
B C B C D A C B A D A C C C B D A C B A B A B C C
26.(18分,每空2分)
(1)④③②①
(2) ①CH3OH-6e-+8OH-=CO+6H2O
②2Cl- - 2e- = Cl2↑
③ a. Ag - e- =Ag+ 不变 b.448
④a.2H2O+2e-=H2↑+2OH- 增大 b.2Cu-2e-+2OH-=Cu2O+H2O
27.(12分,每空2分)
(1)Cu(OH)2 2NH3·H2O+Cu2+ =Cu(OH)2↓+2NH
(2) ④>①>②>③
(3)3×10 3
(4) 4×10 5
(5) C
28.(14分,每空2分)
(1) ①正 Cu2+ + 2e- =Cu
②2H2O-4e-== O2↑+4H+ 红色物质生成
(2) ①吸氧 溶液变红
②13
29.(6分,每空2分)
(1)1×10-7mol/L (2)2 (3)否
同课章节目录
