安徽省合肥市肥东县凯悦高级中学校2021-2022学年高二上学期第三次自主检测化学试题(Word版含解析)
文档属性
| 名称 | 安徽省合肥市肥东县凯悦高级中学校2021-2022学年高二上学期第三次自主检测化学试题(Word版含解析) |
|
|
| 格式 | doc | ||
| 文件大小 | 554.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-16 00:00:00 | ||
图片预览



文档简介
凯悦高级中学校2021-2022学年高二上学期第三次自主检测
化学 试题卷
测试时间:90分钟 满分:100分
第Ⅰ卷(选择题 共48分)
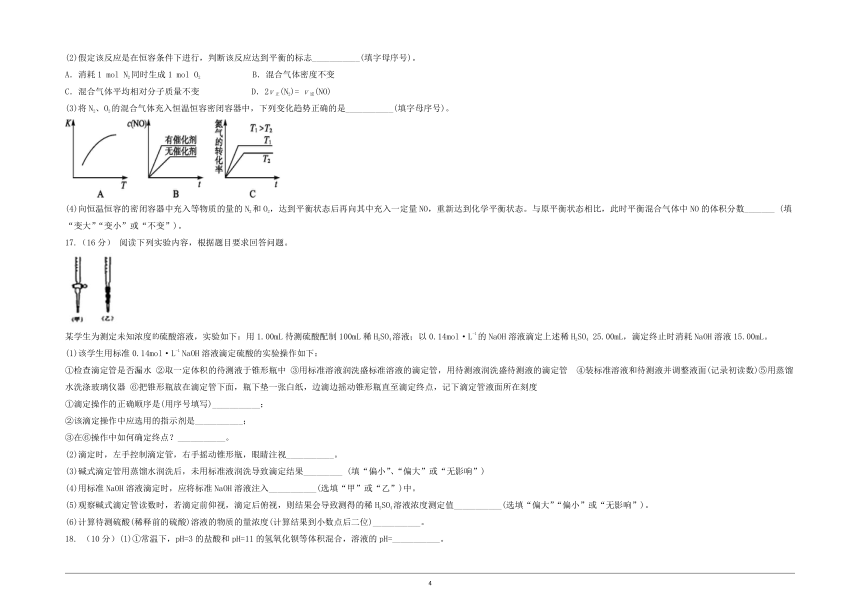
一、选择题(本题包括14小题,每小题3分,共42分)
1. 化学能与热能可相互转化,下列变化过程中一定不存在化学能转化为热能的是( )
A. 木材燃烧 B. 导弹爆炸
C. 干冰 D. 谷物酿酒
2. 某反应使用催化剂后,其反应过程中能量变化如图,下列说法错误的是( )
A. 总反应为放热反应
B. 使用催化剂后,活化能不变
C. 反应①是吸热反应,反应②是放热反应
D. ΔH=ΔH1+ΔH2
3.反应A(g)+3B(g)2C(g)+3D(g)在四种不同情况下的反应速率如下,则反应速率由快到慢的顺序为( )
①v(A)=0.01 mol·L-1·s-1 ②v(B)=0.06 mol·L-1·s-1
③v(C)=2.4 mol·L-1·min-1 ④v(D)=3.5 mol·L-1·min-1
A.②=③>④>① B.④>②=③>①
C.②>③>④>① D.④>①>②>③
4.对于反应2SO2(g)+O2(g) 2SO3(g)△H<0已达平衡,在其他条件不变的情况下,如果分别改变下列条件,对化学反应速率和化学平衡产生的影响与图像不相符的是( )
A. B.
C. D.
5.某化学反应△H<0、△S>0,则关于此反应下列说法正确的是( )
A.仅在高温下自发进行 B.仅在低温下自发进行
C. 在任何温度下都不能自发进行 D.在任何温度下都能自发进行
6.工业生产氨气的适宜条件中不包括( )
A.用浓硫酸吸收产物 B.用铁触煤作催化剂
C.温度400~500℃ D.压强为10~30MPa
7.一定条件下,可逆反应aA(g)bB(g)+cC(g)达到平衡状态后,A的转化率a(A)与温度(T)、压强(p)的关系如图所示。下列判断正确的是( )
A. aB. 该反应的平衡常数随温度的升高而增大
C. 该反应用于工业生产时,采用的压强越大越好
D.若T18. 在足量锌与等物质的量浓度、等体积的盐酸和醋酸反应时,下列叙述正确的是( )
A. 开始反应时,二者的速率相等 B. 盐酸放出的H2多
C. 二者放出的H2一样多 D. 醋酸消耗的Zn的质量多
9. 将0.1 mol/L CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起( )
A. 溶液的pH增大
B. CH3COOH电离度增大
C. 溶液的导电能力减弱
D. 溶液中c(OH-)减小
10. 下列事实能说明亚硝酸是弱电解质的是( )
①25℃时亚硝酸钠溶液的pH大于7 ②用HNO2溶液做导电试验,灯泡很暗 ③HNO2溶液不与Na2SO4溶液反应 ④0.1mol·L-1HNO2溶液的pH=2
A. ①②③ B.①④ C.②③④ D. ①②④
11. 25℃时,水的电离达到平衡:H2OH++ OH-;ΔH > 0,下列叙述正确的是( )
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C. 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D. 将水加热,Kw增大,pH不变
12. 25℃时,pH=2的HCl溶液中,由水电离出的H+离子浓度是( )
A. 1×10-7mol/L B. 1×10-12mol/L C. 1×10-2mol/L D. 1×10-14mol/L
13. 相同温度下,根据三种酸的电离常数,下列判断正确的是( )
酸 HX HY HZ
电离常数K 9×10-7 9×10-6 1×10-2
A. 三种酸的强弱关系:HX>HY>HZ
B. 反应HX+Y-=HY+X-能够发生
C. 相同温度下,0.1 mol·L-1的HX、HY、HZ溶液,HX溶液pH最大
D. 相同温度下,1 mol·L-1 HX溶液的电离程度大于0.1 mol·L-1 HX
14. 室温下,将0.100 0 mol·L-1盐酸滴入20.00 mL未知浓度的某一元碱MOH溶液中,溶液pH随加入盐酸体积变化曲线如图所示。下列有关说法不正确的是( )
A. 该一元碱溶液浓度为0.100 0 mol·L-1
B. A、B、C三点的水溶液导电性依次增强
C. 室温下,MOH的电离常数Kb=1×10-5
D. 该一元碱溶液浓度为0.00100 0 mol·L-1
第Ⅱ卷(非选择题 共58分)
2、非选择题(本题包括5小题,每空两分,共58分)
15. (12分)根据要求,回答下列问题:
(1)已知①CO(g)+O2(g)=CO2(g) △H1=-283 kJ·mol-1,
②C(s)+O2(g)=CO(g) △H2=-110 kJ·mol-1,则碳的燃烧热△H= 。
(2)工业合成氨的热化学方程式为N2(g)+3H2(g)2NH3(g) △H=-92.4 kJ·mol-1;已知N≡N键的键能是948.9 kJ·mol-1,H-H键的键能是436.0 kJ·mol-1,则N-H键的键能是 ;向体系中加入2 mol N2充分反应,放出的热量 (填“大于”“小于”或“等于”)184.8 kJ,原因是 。
(3)已知某反应过程如图所示,则该反应为 (填“放热”或“吸热”)反应,该反应的热化学方程式为 。
16. (10分)汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g)+O2(g) 2NO(g) △H>0,已知该反应在2 404 ℃时,平衡常数K=64×10-4。请回答:
(1)某温度下,向2 L的密闭容器中充入N2和O2各1 mol,5分钟后O2的物质的量为0.5 mol,则N2的反应速率为___________, 平衡常数K=___________。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志___________(填字母序号)。
A.消耗1 mol N2同时生成1 mol O2 B.混合气体密度不变
C.混合气体平均相对分子质量不变 D.2v正(N2)= v逆(NO)
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是___________(填字母序号)。
(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气体中NO的体积分数_______ (填“变大”“变小”或“不变”)。
17.(16分) 阅读下列实验内容,根据题目要求回答问题。
某学生为测定未知浓度硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol·L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL。
(1)该学生用标准0.14mol·L-1 NaOH溶液滴定硫酸的实验操作如下:
①检查滴定管是否漏水 ②取一定体积的待测液于锥形瓶中 ③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管 ④装标准溶液和待测液并调整液面(记录初读数)⑤用蒸馏水洗涤玻璃仪器 ⑥把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
①滴定操作的正确顺序是(用序号填写)___________;
②该滴定操作中应选用的指示剂是___________;
③在⑥操作中如何确定终点?___________。
(2)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视___________。
(3)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果_________ (填“偏小”、“偏大”或“无影响”)
(4)用标准NaOH溶液滴定时,应将标准NaOH溶液注入___________(选填“甲”或“乙”)中。
(5)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值___________(选填“偏大”“偏小”或“无影响”)。
(6)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度(计算结果到小数点后二位)___________。
18. (10分)(1)①常温下,pH=3的盐酸和pH=11的氢氧化钡等体积混合,溶液的pH=___________。
②常温下pH=3的盐酸和pH=6的盐酸等体积混合,溶液的pH=___________。(lg2=0.3)
(2)在某温度下,H2O的离子积常数为1×10-13,则该温度下
①某溶液中的H+ 浓度为1×10-7mol/L,则该溶液呈___________性。
②0.01mol/LNaOH溶液的pH=___________。
③99mL pH=1的H2SO4溶液与101mL pH=12的KOH溶液混合后,溶液的pH=___________。
19. (10分)按要求回答下列问题:
(1)已知NaHSO3溶液显酸性,溶液中存在以下平衡:
HSO+H2O H2SO3+OH- ①
HSO H++SO ②
向0.1 mol·L-1的NaHSO3溶液中加入少量氢氧化钠固体,则___________(填“增大”“减小”或“不变”,下同),___________。
(2)氯常用作饮用水的杀菌剂,且HClO的杀菌能力比ClO-强。25 ℃时氯气——氯水体系中存在以下平衡关系:
Cl2(g) Cl2(aq) ①
Cl2(aq) + H2OHClO + H+ + Cl- ②
HClOH+ + ClO- ③
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。
①写出上述体系中属于电离平衡的平衡常数表达式:K=___________,由图可知该常数值为___________。
②用氯处理饮用水时,夏季的杀菌效果比冬季___________(“好”或“差”,请用勒夏特列原理解释)。
1-5 CBACD 6-10 ADCAB 11-14 BBCD
15题答案为该图片,每空两分
16. 每空两分
【答案】 (1). 0.05 mol·(L·min)-1 (2). 4 (3). AD (4). AC (5). 不变
【解析】
【分析】
【详解】(1)某温度下,向2L的密闭容器中充入N2和O2各1mol,5分钟后O2的物质的量为0.5mol,则消耗的氧气的物质的量为0.5mol,消耗的氮气的物质的量也为0.5mol,消耗的氮气的物质的量浓度为0.25mol/L,则用氮气表示的速率v(N2)==0.05mol/(L·min);起始时氧气和氮气均为1mol,都消耗了0.5mol,所以平衡时均为0.5mol,生成的NO的物质的量为1mol,平衡时NO的物质的量为1mol,容器体积为2L,所以平衡时N2、O2、NO的物质的量浓度分别为0.25mol/L、0.25mol/L、0.5mol/L,平衡常数 K= =4,故答案为0.05mol/(L·min),4;
(2)A.消耗1molN2的同时生成1molO2,说明正逆反应速率相等,说明反应达到了平衡状态,故A选;
B.容器中气体的质量不变,容器的体积不变,气体的密度始终不变,当混合气密度不变时不能说明反应达到了平衡状态,故B不选;
C.混合气体总质量不变、总物质的量不变,混合气体平均相对分子质量始终不变,当混合气的平均相对分子质量不变时不能说明反应达到了平衡状态,故C不选;
D.由化学方程式可知2v正(N2)=v正(NO),而2v正(N2)=v逆(NO),则v正(NO)=v逆(NO),正逆反应速率相等,反应到达平衡,故D正确;
故选AD;
(3)A.该反应的正反应为吸热反应,升高温度平衡正向移动,平衡常数增大,图象符合,故A正确;
B.加入催化剂,加快反应速率,但平衡不发生移动,图象中平衡发生移动,故B错误;
C.升高温度,反应速率增大,平衡正向移动,氮气的转化率增大,图象符合,故C正确;
故选AC;
(4) 向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,相当于充入等物质的量的N2和O2,与原平衡为等效平衡,平衡时相同物质的含量相等,即平衡混合气中NO的体积分数不变。
17. 每空两分
【答案】 (1). ①⑤③④②⑥ (2). 酚酞或甲基橙 (3). 无色变为浅红色且半分钟不褪去。(或红色变为黄色且半分钟不变) (4). 锥形瓶内溶液颜色的变化 (5). 偏大 (6). 乙 (7). 偏小 (8). 4.20mol/L
【解析】
【详解】(1)①用标准0.14mol/L NaOH溶液滴定硫酸的实验操作步骤为:检查滴定管是否漏水、洗涤滴定管锥形瓶、润洗滴定管,并盛装标准液和待测液、取一定体积待测液、开始滴定、重复滴定等,所以正确的操作顺序为:①⑤③④②⑥
②由于氢氧化钠与硫酸恰好中和,溶液的pH=7,所以可以选用酚酞或甲基橙作为指示剂;
③若用酚酞作指示剂,滴定结束前,滴入酚酞的硫酸溶液为无色,滴定结束时,溶液变成红色,所以滴定终点现象为:无色变为浅红色且半分钟不褪去;若用甲基橙作指示剂,则为:红色变为黄色且半分钟不变;
(2)为确定滴定终点,滴定时眼睛要注视锥形内溶液颜色的变化;
(3)碱式滴定管用蒸馏水润洗后,未用标准液润洗会稀释标准液,导致所用标准液体积偏大,测定结果偏大;
(4)NaOH溶液显碱性,应应将标准NaOH溶液注入下端由橡胶连接的碱式滴定管中,即乙;
(5)滴定前仰视,滴定后俯视,读取的标准液体积偏小,求得浓度偏小;
(6)根据反应:2NaOH+H2SO4=Na2SO4+2H2O,稀释后的硫酸溶液浓度为:c(H2SO4)=0.5×=0.042mol/L 稀释前稀硫酸的浓度为=4.20mol/L。
18. 每空两分
【答案】 (1). 7 (2). 3.3 (3). 碱 (4). 11 (5). 10
【解析】
【详解】(1)①常温下,pH=3的盐酸中mol/L, pH=11的氢氧化钡溶液中mol/L,等体积混合,恰好反应,溶液呈中性, pH=7;
②常温下pH=3的盐酸和pH=6的盐酸等体积混合,混合后溶液中 mol/L,溶液的pH=-=3.3;
(2)①某溶液中的H+ 浓度为1×10-7mol/L,H2O的离子积常数为1×10-13,,c(H+)②0.01mol/LNaOH溶液中mol/L,pH=11;
③pH=1的H2SO4溶液中 mol/L, pH=12的KOH溶液中mol/L,99mL pH=1的H2SO4溶液与101mL pH=12的KOH溶液混合后,氢氧化钠有剩余, mol/L,,溶液的pH=10。
【点睛】本题考查了溶液酸碱性与溶液pH的简单计算,掌握酸碱混合后溶液pH的计算方法,注意判断混合后溶液酸碱性,若呈碱性先计算氢氧根离子浓度,再根据水的离子积常数计算氢离子浓度。
19. 每空两分
【答案】 (1). 增大 (2). 减小 (3). (4). 10 7.5 (5). 差 温度升高,(溶解)平衡①逆向移动,Cl2(aq)浓度减小,使得(化学平衡)②逆向移动,c(HClO)减小,杀菌效果变差
【解析】
【详解】(1)向0.1 mol·L-1的NaHSO3溶液中加入少量氢氧化钠固体,氢氧根浓度增加,氢离子浓度减小,因此增大,没有加入NaOH固体时,由于亚硫酸氢根电离程度小,因此很大,加入NaOH固体,氢氧根不断消耗亚硫酸氢根生成亚硫酸根,假设恰好反应完生成亚硫酸钠,则比值等于2,因此减小;故答案为:增大;减小。
(2)①上述电离平衡的是HClOH+ + ClO-,其平衡常数表达式为K=
,根据图中pH=7.5时,次氯酸和次氯酸根的浓度相等,因此该常数值为K=;故答案为:;10 7.5。
②用氯处理饮用水时,由于夏季温度高,氯气在水中溶解度小,即(溶解)平衡①逆向移动,Cl2(aq)浓度减小,使得(化学平衡)②逆向移动,溶液中的次氯酸浓度小,因此夏季的杀菌效果比冬季差;故答案为:差;温度升高,(溶解)平衡①逆向移动,Cl2(aq)浓度减小,使得(化学平衡)②逆向移动,c(HClO)减小,杀菌效果变差。
化学 试题卷
测试时间:90分钟 满分:100分
第Ⅰ卷(选择题 共48分)
一、选择题(本题包括14小题,每小题3分,共42分)
1. 化学能与热能可相互转化,下列变化过程中一定不存在化学能转化为热能的是( )
A. 木材燃烧 B. 导弹爆炸
C. 干冰 D. 谷物酿酒
2. 某反应使用催化剂后,其反应过程中能量变化如图,下列说法错误的是( )
A. 总反应为放热反应
B. 使用催化剂后,活化能不变
C. 反应①是吸热反应,反应②是放热反应
D. ΔH=ΔH1+ΔH2
3.反应A(g)+3B(g)2C(g)+3D(g)在四种不同情况下的反应速率如下,则反应速率由快到慢的顺序为( )
①v(A)=0.01 mol·L-1·s-1 ②v(B)=0.06 mol·L-1·s-1
③v(C)=2.4 mol·L-1·min-1 ④v(D)=3.5 mol·L-1·min-1
A.②=③>④>① B.④>②=③>①
C.②>③>④>① D.④>①>②>③
4.对于反应2SO2(g)+O2(g) 2SO3(g)△H<0已达平衡,在其他条件不变的情况下,如果分别改变下列条件,对化学反应速率和化学平衡产生的影响与图像不相符的是( )
A. B.
C. D.
5.某化学反应△H<0、△S>0,则关于此反应下列说法正确的是( )
A.仅在高温下自发进行 B.仅在低温下自发进行
C. 在任何温度下都不能自发进行 D.在任何温度下都能自发进行
6.工业生产氨气的适宜条件中不包括( )
A.用浓硫酸吸收产物 B.用铁触煤作催化剂
C.温度400~500℃ D.压强为10~30MPa
7.一定条件下,可逆反应aA(g)bB(g)+cC(g)达到平衡状态后,A的转化率a(A)与温度(T)、压强(p)的关系如图所示。下列判断正确的是( )
A. a
C. 该反应用于工业生产时,采用的压强越大越好
D.若T1
A. 开始反应时,二者的速率相等 B. 盐酸放出的H2多
C. 二者放出的H2一样多 D. 醋酸消耗的Zn的质量多
9. 将0.1 mol/L CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起( )
A. 溶液的pH增大
B. CH3COOH电离度增大
C. 溶液的导电能力减弱
D. 溶液中c(OH-)减小
10. 下列事实能说明亚硝酸是弱电解质的是( )
①25℃时亚硝酸钠溶液的pH大于7 ②用HNO2溶液做导电试验,灯泡很暗 ③HNO2溶液不与Na2SO4溶液反应 ④0.1mol·L-1HNO2溶液的pH=2
A. ①②③ B.①④ C.②③④ D. ①②④
11. 25℃时,水的电离达到平衡:H2OH++ OH-;ΔH > 0,下列叙述正确的是( )
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C. 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D. 将水加热,Kw增大,pH不变
12. 25℃时,pH=2的HCl溶液中,由水电离出的H+离子浓度是( )
A. 1×10-7mol/L B. 1×10-12mol/L C. 1×10-2mol/L D. 1×10-14mol/L
13. 相同温度下,根据三种酸的电离常数,下列判断正确的是( )
酸 HX HY HZ
电离常数K 9×10-7 9×10-6 1×10-2
A. 三种酸的强弱关系:HX>HY>HZ
B. 反应HX+Y-=HY+X-能够发生
C. 相同温度下,0.1 mol·L-1的HX、HY、HZ溶液,HX溶液pH最大
D. 相同温度下,1 mol·L-1 HX溶液的电离程度大于0.1 mol·L-1 HX
14. 室温下,将0.100 0 mol·L-1盐酸滴入20.00 mL未知浓度的某一元碱MOH溶液中,溶液pH随加入盐酸体积变化曲线如图所示。下列有关说法不正确的是( )
A. 该一元碱溶液浓度为0.100 0 mol·L-1
B. A、B、C三点的水溶液导电性依次增强
C. 室温下,MOH的电离常数Kb=1×10-5
D. 该一元碱溶液浓度为0.00100 0 mol·L-1
第Ⅱ卷(非选择题 共58分)
2、非选择题(本题包括5小题,每空两分,共58分)
15. (12分)根据要求,回答下列问题:
(1)已知①CO(g)+O2(g)=CO2(g) △H1=-283 kJ·mol-1,
②C(s)+O2(g)=CO(g) △H2=-110 kJ·mol-1,则碳的燃烧热△H= 。
(2)工业合成氨的热化学方程式为N2(g)+3H2(g)2NH3(g) △H=-92.4 kJ·mol-1;已知N≡N键的键能是948.9 kJ·mol-1,H-H键的键能是436.0 kJ·mol-1,则N-H键的键能是 ;向体系中加入2 mol N2充分反应,放出的热量 (填“大于”“小于”或“等于”)184.8 kJ,原因是 。
(3)已知某反应过程如图所示,则该反应为 (填“放热”或“吸热”)反应,该反应的热化学方程式为 。
16. (10分)汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g)+O2(g) 2NO(g) △H>0,已知该反应在2 404 ℃时,平衡常数K=64×10-4。请回答:
(1)某温度下,向2 L的密闭容器中充入N2和O2各1 mol,5分钟后O2的物质的量为0.5 mol,则N2的反应速率为___________, 平衡常数K=___________。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志___________(填字母序号)。
A.消耗1 mol N2同时生成1 mol O2 B.混合气体密度不变
C.混合气体平均相对分子质量不变 D.2v正(N2)= v逆(NO)
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是___________(填字母序号)。
(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气体中NO的体积分数_______ (填“变大”“变小”或“不变”)。
17.(16分) 阅读下列实验内容,根据题目要求回答问题。
某学生为测定未知浓度硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol·L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL。
(1)该学生用标准0.14mol·L-1 NaOH溶液滴定硫酸的实验操作如下:
①检查滴定管是否漏水 ②取一定体积的待测液于锥形瓶中 ③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管 ④装标准溶液和待测液并调整液面(记录初读数)⑤用蒸馏水洗涤玻璃仪器 ⑥把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
①滴定操作的正确顺序是(用序号填写)___________;
②该滴定操作中应选用的指示剂是___________;
③在⑥操作中如何确定终点?___________。
(2)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视___________。
(3)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果_________ (填“偏小”、“偏大”或“无影响”)
(4)用标准NaOH溶液滴定时,应将标准NaOH溶液注入___________(选填“甲”或“乙”)中。
(5)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值___________(选填“偏大”“偏小”或“无影响”)。
(6)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度(计算结果到小数点后二位)___________。
18. (10分)(1)①常温下,pH=3的盐酸和pH=11的氢氧化钡等体积混合,溶液的pH=___________。
②常温下pH=3的盐酸和pH=6的盐酸等体积混合,溶液的pH=___________。(lg2=0.3)
(2)在某温度下,H2O的离子积常数为1×10-13,则该温度下
①某溶液中的H+ 浓度为1×10-7mol/L,则该溶液呈___________性。
②0.01mol/LNaOH溶液的pH=___________。
③99mL pH=1的H2SO4溶液与101mL pH=12的KOH溶液混合后,溶液的pH=___________。
19. (10分)按要求回答下列问题:
(1)已知NaHSO3溶液显酸性,溶液中存在以下平衡:
HSO+H2O H2SO3+OH- ①
HSO H++SO ②
向0.1 mol·L-1的NaHSO3溶液中加入少量氢氧化钠固体,则___________(填“增大”“减小”或“不变”,下同),___________。
(2)氯常用作饮用水的杀菌剂,且HClO的杀菌能力比ClO-强。25 ℃时氯气——氯水体系中存在以下平衡关系:
Cl2(g) Cl2(aq) ①
Cl2(aq) + H2OHClO + H+ + Cl- ②
HClOH+ + ClO- ③
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。
①写出上述体系中属于电离平衡的平衡常数表达式:K=___________,由图可知该常数值为___________。
②用氯处理饮用水时,夏季的杀菌效果比冬季___________(“好”或“差”,请用勒夏特列原理解释)。
1-5 CBACD 6-10 ADCAB 11-14 BBCD
15题答案为该图片,每空两分
16. 每空两分
【答案】 (1). 0.05 mol·(L·min)-1 (2). 4 (3). AD (4). AC (5). 不变
【解析】
【分析】
【详解】(1)某温度下,向2L的密闭容器中充入N2和O2各1mol,5分钟后O2的物质的量为0.5mol,则消耗的氧气的物质的量为0.5mol,消耗的氮气的物质的量也为0.5mol,消耗的氮气的物质的量浓度为0.25mol/L,则用氮气表示的速率v(N2)==0.05mol/(L·min);起始时氧气和氮气均为1mol,都消耗了0.5mol,所以平衡时均为0.5mol,生成的NO的物质的量为1mol,平衡时NO的物质的量为1mol,容器体积为2L,所以平衡时N2、O2、NO的物质的量浓度分别为0.25mol/L、0.25mol/L、0.5mol/L,平衡常数 K= =4,故答案为0.05mol/(L·min),4;
(2)A.消耗1molN2的同时生成1molO2,说明正逆反应速率相等,说明反应达到了平衡状态,故A选;
B.容器中气体的质量不变,容器的体积不变,气体的密度始终不变,当混合气密度不变时不能说明反应达到了平衡状态,故B不选;
C.混合气体总质量不变、总物质的量不变,混合气体平均相对分子质量始终不变,当混合气的平均相对分子质量不变时不能说明反应达到了平衡状态,故C不选;
D.由化学方程式可知2v正(N2)=v正(NO),而2v正(N2)=v逆(NO),则v正(NO)=v逆(NO),正逆反应速率相等,反应到达平衡,故D正确;
故选AD;
(3)A.该反应的正反应为吸热反应,升高温度平衡正向移动,平衡常数增大,图象符合,故A正确;
B.加入催化剂,加快反应速率,但平衡不发生移动,图象中平衡发生移动,故B错误;
C.升高温度,反应速率增大,平衡正向移动,氮气的转化率增大,图象符合,故C正确;
故选AC;
(4) 向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,相当于充入等物质的量的N2和O2,与原平衡为等效平衡,平衡时相同物质的含量相等,即平衡混合气中NO的体积分数不变。
17. 每空两分
【答案】 (1). ①⑤③④②⑥ (2). 酚酞或甲基橙 (3). 无色变为浅红色且半分钟不褪去。(或红色变为黄色且半分钟不变) (4). 锥形瓶内溶液颜色的变化 (5). 偏大 (6). 乙 (7). 偏小 (8). 4.20mol/L
【解析】
【详解】(1)①用标准0.14mol/L NaOH溶液滴定硫酸的实验操作步骤为:检查滴定管是否漏水、洗涤滴定管锥形瓶、润洗滴定管,并盛装标准液和待测液、取一定体积待测液、开始滴定、重复滴定等,所以正确的操作顺序为:①⑤③④②⑥
②由于氢氧化钠与硫酸恰好中和,溶液的pH=7,所以可以选用酚酞或甲基橙作为指示剂;
③若用酚酞作指示剂,滴定结束前,滴入酚酞的硫酸溶液为无色,滴定结束时,溶液变成红色,所以滴定终点现象为:无色变为浅红色且半分钟不褪去;若用甲基橙作指示剂,则为:红色变为黄色且半分钟不变;
(2)为确定滴定终点,滴定时眼睛要注视锥形内溶液颜色的变化;
(3)碱式滴定管用蒸馏水润洗后,未用标准液润洗会稀释标准液,导致所用标准液体积偏大,测定结果偏大;
(4)NaOH溶液显碱性,应应将标准NaOH溶液注入下端由橡胶连接的碱式滴定管中,即乙;
(5)滴定前仰视,滴定后俯视,读取的标准液体积偏小,求得浓度偏小;
(6)根据反应:2NaOH+H2SO4=Na2SO4+2H2O,稀释后的硫酸溶液浓度为:c(H2SO4)=0.5×=0.042mol/L 稀释前稀硫酸的浓度为=4.20mol/L。
18. 每空两分
【答案】 (1). 7 (2). 3.3 (3). 碱 (4). 11 (5). 10
【解析】
【详解】(1)①常温下,pH=3的盐酸中mol/L, pH=11的氢氧化钡溶液中mol/L,等体积混合,恰好反应,溶液呈中性, pH=7;
②常温下pH=3的盐酸和pH=6的盐酸等体积混合,混合后溶液中 mol/L,溶液的pH=-=3.3;
(2)①某溶液中的H+ 浓度为1×10-7mol/L,H2O的离子积常数为1×10-13,,c(H+)
③pH=1的H2SO4溶液中 mol/L, pH=12的KOH溶液中mol/L,99mL pH=1的H2SO4溶液与101mL pH=12的KOH溶液混合后,氢氧化钠有剩余, mol/L,,溶液的pH=10。
【点睛】本题考查了溶液酸碱性与溶液pH的简单计算,掌握酸碱混合后溶液pH的计算方法,注意判断混合后溶液酸碱性,若呈碱性先计算氢氧根离子浓度,再根据水的离子积常数计算氢离子浓度。
19. 每空两分
【答案】 (1). 增大 (2). 减小 (3). (4). 10 7.5 (5). 差 温度升高,(溶解)平衡①逆向移动,Cl2(aq)浓度减小,使得(化学平衡)②逆向移动,c(HClO)减小,杀菌效果变差
【解析】
【详解】(1)向0.1 mol·L-1的NaHSO3溶液中加入少量氢氧化钠固体,氢氧根浓度增加,氢离子浓度减小,因此增大,没有加入NaOH固体时,由于亚硫酸氢根电离程度小,因此很大,加入NaOH固体,氢氧根不断消耗亚硫酸氢根生成亚硫酸根,假设恰好反应完生成亚硫酸钠,则比值等于2,因此减小;故答案为:增大;减小。
(2)①上述电离平衡的是HClOH+ + ClO-,其平衡常数表达式为K=
,根据图中pH=7.5时,次氯酸和次氯酸根的浓度相等,因此该常数值为K=;故答案为:;10 7.5。
②用氯处理饮用水时,由于夏季温度高,氯气在水中溶解度小,即(溶解)平衡①逆向移动,Cl2(aq)浓度减小,使得(化学平衡)②逆向移动,溶液中的次氯酸浓度小,因此夏季的杀菌效果比冬季差;故答案为:差;温度升高,(溶解)平衡①逆向移动,Cl2(aq)浓度减小,使得(化学平衡)②逆向移动,c(HClO)减小,杀菌效果变差。
同课章节目录
