碱金属和碱土金属(兴趣小组)
图片预览






文档简介
(共28张PPT)
第 三 章
碱金属和碱土金属
(Alkali and Alkaline Earth Metals)
(IA、IIA族)
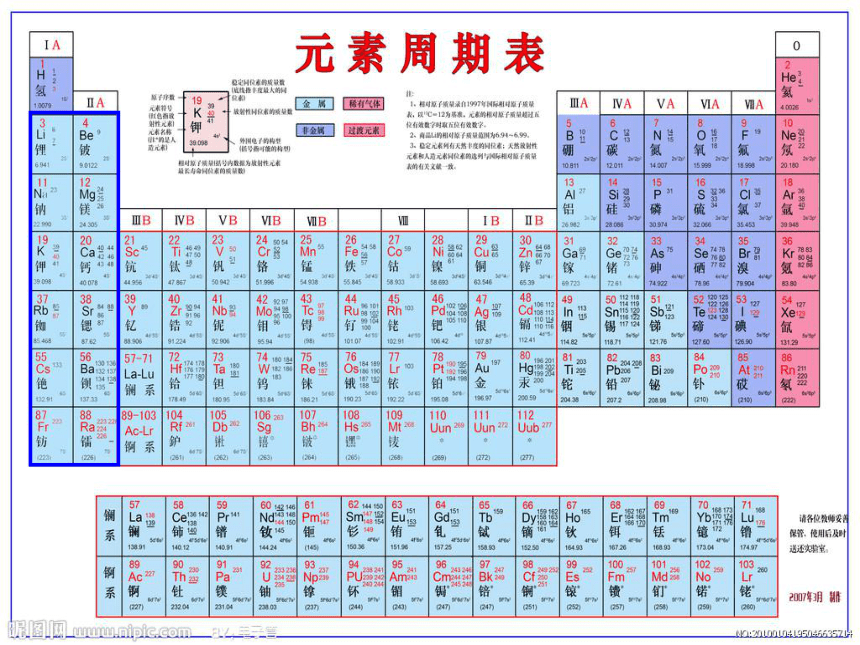
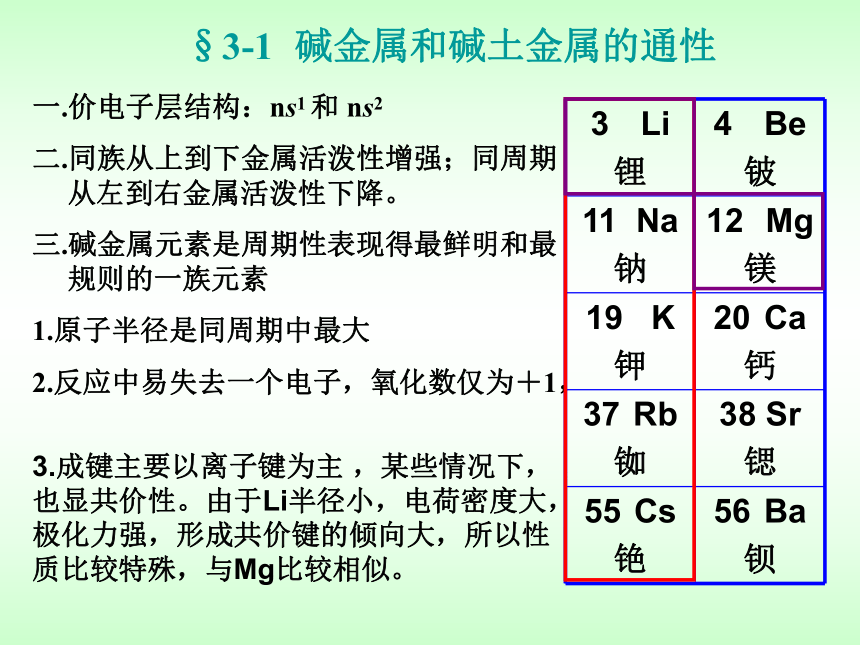
§3-1 碱金属和碱土金属的通性
Li
锂 Be
铍
11 Na
钠 Mg
镁
19 K
钾 Ca
钙
Rb
铷 38 Sr
锶
Cs
铯 Ba
钡
一.价电子层结构:ns1 和 ns2
二.同族从上到下金属活泼性增强;同周期从左到右金属活泼性下降。
三.碱金属元素是周期性表现得最鲜明和最规则的一族元素
1.原子半径是同周期中最大
2.反应中易失去一个电子,氧化数仅为+1,
3.成键主要以离子键为主 ,某些情况下,也显共价性。由于Li半径小,电荷密度大,极化力强,形成共价键的倾向大,所以性质比较特殊,与Mg比较相似。
Li
锂 Be
铍
11 Na
钠 Mg
镁
19 K
钾 Ca
钙
Rb
铷 38 Sr
锶
Cs
铯 Ba
钡
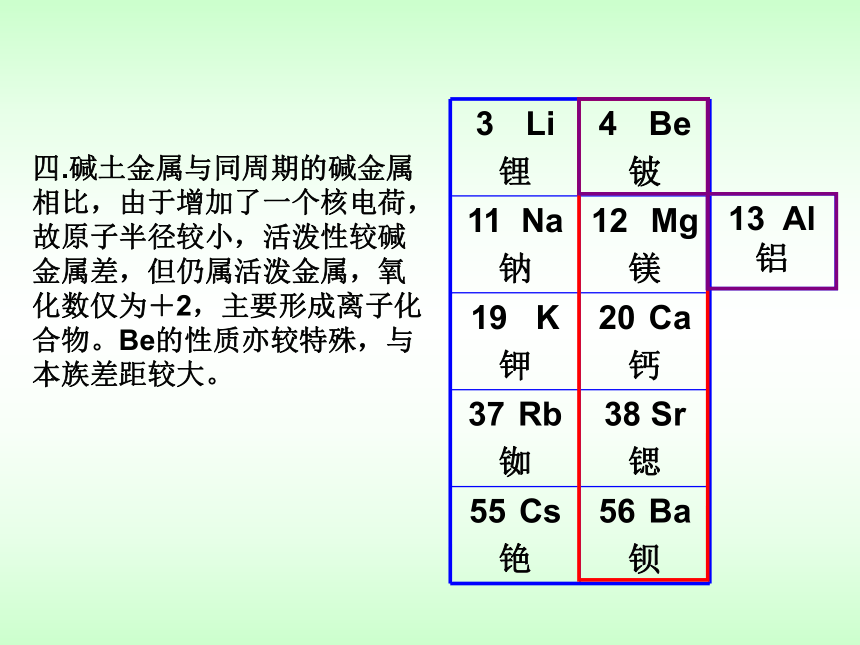
四.碱土金属与同周期的碱金属相比,由于增加了一个核电荷,故原子半径较小,活泼性较碱金属差,但仍属活泼金属,氧化数仅为+2,主要形成离子化合物。Be的性质亦较特殊,与本族差距较大。
13 Al
铝
§3-2 碱金属和碱土金属的单质
一、存在
Be: 绿柱石-3BeO·Al2O3·6SiO2、硅铍石-3BeO·SiO2、铝铍石
Mg: 菱镁矿-MgCO3、光卤石等
Ca: 分布广,以碳酸盐和硫酸盐形成存在。如方解石、石灰
石-CaCO3、石膏-CaSO4·2H2O
Sr: 天青石-SrSO4、碳酸锶矿SrCO3
Ba: 重晶石-BaSO4、毒重石BaCO3
Na、K:分布较广、丰度较高,主要以氯化物形式存在
钠长石—Na[AlSi3O8],钾长石—K[AlSi3O8] ,光卤
石— KCl·MgCl2·6H2O,明矾等
Li: 锂辉石—Li2O·Al2O3·4SiO2
二、物理性质
单质
性质 锂 钠 钾 铷 铯 铍 镁 钙 锶 钡
密度/ g.dm-3
熔点/K
沸点/K
0.534
453.7
1620 0.971
370.9
1156 0.86
337
1047 1.532
312.0
961 1.873
301.5
951.5 1.85
1551
3243 1.74
922
1363 1.55
1112
1757 2.54
1042
1657 3.5
993
1913
可保存与煤油中
某些合金常温下为液体
1. 碱金属、碱土金属的单质具有金属光泽,有良好的导电性和延展性。
2. 由于价电子数少,所以碱金属原子之间的作用力比绝大多数其
他金属原子之间的作用力要小,因此碱金属很软,低熔、沸
点,且半径大、密度小。Li的密度是所有金属中最小的,它的
密度比煤油还小,所以只能放在石蜡中保存。
3. 碱土金属由于核外有2个有效成键电子,晶体中原子间距小,
金属键强度较大,因此熔点、沸点和硬度均较碱金属高。
4. 碱土金属的物理性质变化不如碱金属那么有规律,是由于其晶
格类型不完全相同。
三、化学性质
Li2O、Li3N;
M2O2 (M = Na、K、Rb、Cs)
MO2 (M = K、Rb、Cs)
M3N2 ,
MO (M = Mg、Ca、Sr、Ba)
BaO2
碱土金属:
1、与空气作用:
碱金属:
2、与水作用:
Na反应猛烈; K、Rb、Cs燃烧,量大发生爆炸;
Li、Ca、Sr、Ba反应比较慢;Be、Mg与水蒸气反应。
元素
性质 锂 钠 钾 铷 铯 铍 镁 钙 锶 钡
φAo /V -3.045 -2.714 -2.925 -2.925 -2.923 -1.85 -2.36 -2.87 -2.89 -2.91
Li
Na
K
Ca
SiO2 + 2Mg = Si + 2MgO
TiCl4 + 4Na = Ti + 4NaCl
4. 焰色反应
3、与氧化物、卤化物反应
Li
Na
K
Ca
Sr
Ba
碱金属和钙、锶、钡的挥发性化合物在高温火焰中,电子易被激发,当电子从高能级回到低能级时,便以光能的形式释放出能量,使火焰呈现特征颜色,称为~。
紫红色
黄色
紫色
砖红色
洋红色
黄绿色
5. 与液氨的作用: 导电性、还原性
M(s) + (x+y)NH3(l) = M(NH3)x+ + e(NH3)y-
FeCl3
金属的氨溶液呈蓝色,若挥发掉溶剂,又可得到金属。金属氨溶液具有高导电性和强还原性,其强还原性(氨合电子、氨基钠)常用于有机制备反应。痕量的杂质(如过渡金属的盐类、氧化物和氢氧化物)及光化作用都能促进溶液中的碱金属和液氨之间发生氧化还原反应(如上)。
四、制备
碱金属、碱土金属具有较强的还原性,而相应的离子几乎没有氧化性,还原剂很难将其还原。常用的方法有:融盐电解法、热还原法、金属置换法等。
Na:电解40%NaCl + 60%CaCl2
2NaCl = 2Na + Cl2
CaCl2的作用:
a.降低电解质的熔点,防止钠的挥发;
b.减小金属Na的分散性(混盐密度>金属钠,钠浮在上层)。
1. 融盐电解法
2. 热还原法:一般采用焦炭或碳化物为还原剂
3. 金属置换法: 高温低压下还原氯化物。
4. 热分解法
2MN3 = 2M + 3N2 (M = Na, K, Rb, Cs)
§3-3 碱金属的氧化物(钠)
性质 LiOH* NaOH KOH RbOH CsOH
颜色 白 白 白 白 白
熔点/K 723 591 633 574 545
溶解热(288K)/kJ.mol-1 23.4 44.4 57.7 62.3 74.5
水中溶解度(288K)/mol.dm -3 5.3 26.4 19.1 17.9 25.8
性质 Be(OH)2 Mg(OH)2 Ca(OH)2 Sr(OH)2 Ba(OH)2
颜色 白 白 白 白 白
熔点/K 脱水分解 脱水分解 脱水分解 脱水分解 脱水分解
水中溶解度(293K)/mol.dm -3 8×10-6 5×10-4 1.8×10-2 6.7×10-2 2×10-1
§3-4 碱金属和碱土金属的氢氧化物
1.氢氧化物的性质递变规律
LiOH 1.2 Be(OH)2 2.54
NaOH 1.0 Mg(OH)2 1.76
KOH 0.87 Ca(OH)2 1.42
RbOH 0.82 Sr(OH)2 1.33
CsOH 0.77 Ba(OH)2 1.22
碱性增强
碱性增强
碱性增强
Be(OH)2两性,LiOH、Mg(OH)2中强碱,其余为强碱。在元素周期表中自上而下碱性增强。
Be(OH)2 + 2OH- = Be(OH)42-
(1)与酸性氧化物作用
2NaOH + CO2 = Na2CO3 + H2O
2NaOH + SiO2 = Na2SiO3 + H2O
(2)能溶解某些两性金属及其氧化物
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2 ↑
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2 ↑
2. 重要的碱--NaOH 、Ca(OH)2
(3)能溶解某些非金属
2B + 2NaOH + 2H2O = 2Na[B(OH)4] + H2 ↑
Si + 2NaOH + H2O = Na2SiO3 + 2H2 ↑
X2 + 2NaOH = NaX +NaXO + H2O (X = Cl, Br, I)
3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
4P + 3NaOH + 3H2O = 3Na2H2PO4 + PH3
BeH2、MgH2为共价型
2M + H2 = 2MH ( M= 碱金属)
M + H2 = MH2 ( M= 碱土金属 )
§3-5 碱金属和碱土金属的氢化物
性质
1、热稳定性:
碱金属氢化物稳定性依LiH→CsH次序降低
2、强还原性:
MH+H2O=MOH+H2 ↑
TiCl4+4NaH=Ti+4NaCl+2H2
3. 用途
a. 有机合成中用作还原剂;
b. LiH、CaH2为野外氢气发生剂;
c. 制备NaBH4 LiAlH4:
4NaH+BF3=NaBH4+3NaF
4LiH +AlBr3= LiAlH4 +3LiBr
除Be的某些化合物(如BeCl2易溶于有机溶剂)共价型外,
碱金属和碱土金属盐基本都是离子型的。
此外,Li 、Mg在某些盐中也表现出一定的共价性
1. 晶体晶型
§3-6 碱金属和碱土金属的盐类
由于碱金属离子M+和碱土金属离子M2+本身是无色的,所
以它们的盐类的颜色取决于阴离子的颜色。
(1) 无色阴离子:X-、NO3-、SO42-、CO32-、ClO-
(2) 有色阴离子:CrO42-、Cr2O72-、MnO4-
BaCrO4黄色,K2CrO4黄色,
K2Cr2O7橙红色,
KMnO4紫色
2. 碱金属、碱土金属盐的颜色
3. 碱金属、碱土金属盐的溶解度
锂盐:LiF、Li2CO3、Li3PO4、LiKFeIO6
钠盐:Na[Sb(OH)6](白)、NaZn(UO2)3(Ac)9.6H2O(黄绿)
钾盐:KClO4(白)、 KHC4H4O4(白)、 K2[PtCl6](淡黄)
K2Na[Co(NO2)6](亮黄) 、K[B(C6H5)4](白)
铷盐、铯盐:比上述钾盐更难溶。
碱金属盐类一般是易溶于水且完全电离形成水合离子;
a. 碱金属盐
b. 碱土金属盐
AB型多难溶:
SO42-、CO32-、C2O42-、CrO42-、PO43-
A2B(AB2)型多可溶:
NO3- 、 ClO3 - 、 ClO4- 、 Cl- 、 Br- 、 I-
碱土金属盐类的重要特征是它们的微溶性。
盐类 Mg Ca Sr Ba
MF2 6.4×10-9 3.9×10-11 3.4×10-9 1.7×10-6
MCO3 1.0×10-5 4.8×10-9 9.4×10-10 8.1×10-9
MC2O4 8.6×10-5 2.3×10-9 5.6×10-8 1.1×10-7
MSO4 溶 6.1×10-5 2.8×10-7 1.08×10-10
MCrO4 溶 2.3×10-2 3.6×10-5 2.0×10-10
一般具有较高的热稳定性。
(1)卤化物高温挥发不分解;
(2)硫酸盐既不挥发又难分解;
4、热稳定性
(3)碳酸盐:碳酸盐除Li2CO3在1000K以上部分地分解为Li2O和CO2以外,其余皆难分解;
(4) MNO3热稳定性低
4LiNO3 = 2Li2O+2N2O4+O2
2NaNO3 = 2NaNO2+O2
2KNO3 = 2KNO2+O2
碱金属盐
碱土金属盐
Be → Ba其盐的热稳定性增强
BeCO3 MgCO3 CaCO3 SrCO3 BaCO3
分解温度/K 373 813 1173 1563 1633
碱土金属的盐的热稳定性较碱金属差,但常温下也都是稳定的。
锂与镁的相似性
1、在氧气中燃烧生成正常的氧化物;
2、氢氧化物在加热时,可分解为氧化物;
3、碳酸盐受热易分解生成氧化物;
4、与N、C形成离子型氮化物和碳化物;
5、硝酸盐热分解产物为Li2O(MgO)+O2+NO2;
6、Li+、Mg2+水合热较大;
7、LiCl 、MgCl2共价性较强,可溶于有机溶剂;
8、Li、Mg的氟化物、碳酸盐、磷酸盐难溶于水;
9、水合氯化物晶体受热发生水解。
铍与铝的相似性
1、活泼金属,亲氧元素;
2、两性元素,氧化物和氢氧化物均为两性;
3、氧化物的熔点、硬度皆高;
4、 Be2+ 、Al3+均有较强的水解性;
5、无水氯化物是共价型化合物,易聚合,易升华,溶于乙醇、乙醚等有机溶剂;
6、Be、Al被冷、浓硝酸所钝化。
第 三 章
碱金属和碱土金属
(Alkali and Alkaline Earth Metals)
(IA、IIA族)
§3-1 碱金属和碱土金属的通性
Li
锂 Be
铍
11 Na
钠 Mg
镁
19 K
钾 Ca
钙
Rb
铷 38 Sr
锶
Cs
铯 Ba
钡
一.价电子层结构:ns1 和 ns2
二.同族从上到下金属活泼性增强;同周期从左到右金属活泼性下降。
三.碱金属元素是周期性表现得最鲜明和最规则的一族元素
1.原子半径是同周期中最大
2.反应中易失去一个电子,氧化数仅为+1,
3.成键主要以离子键为主 ,某些情况下,也显共价性。由于Li半径小,电荷密度大,极化力强,形成共价键的倾向大,所以性质比较特殊,与Mg比较相似。
Li
锂 Be
铍
11 Na
钠 Mg
镁
19 K
钾 Ca
钙
Rb
铷 38 Sr
锶
Cs
铯 Ba
钡
四.碱土金属与同周期的碱金属相比,由于增加了一个核电荷,故原子半径较小,活泼性较碱金属差,但仍属活泼金属,氧化数仅为+2,主要形成离子化合物。Be的性质亦较特殊,与本族差距较大。
13 Al
铝
§3-2 碱金属和碱土金属的单质
一、存在
Be: 绿柱石-3BeO·Al2O3·6SiO2、硅铍石-3BeO·SiO2、铝铍石
Mg: 菱镁矿-MgCO3、光卤石等
Ca: 分布广,以碳酸盐和硫酸盐形成存在。如方解石、石灰
石-CaCO3、石膏-CaSO4·2H2O
Sr: 天青石-SrSO4、碳酸锶矿SrCO3
Ba: 重晶石-BaSO4、毒重石BaCO3
Na、K:分布较广、丰度较高,主要以氯化物形式存在
钠长石—Na[AlSi3O8],钾长石—K[AlSi3O8] ,光卤
石— KCl·MgCl2·6H2O,明矾等
Li: 锂辉石—Li2O·Al2O3·4SiO2
二、物理性质
单质
性质 锂 钠 钾 铷 铯 铍 镁 钙 锶 钡
密度/ g.dm-3
熔点/K
沸点/K
0.534
453.7
1620 0.971
370.9
1156 0.86
337
1047 1.532
312.0
961 1.873
301.5
951.5 1.85
1551
3243 1.74
922
1363 1.55
1112
1757 2.54
1042
1657 3.5
993
1913
可保存与煤油中
某些合金常温下为液体
1. 碱金属、碱土金属的单质具有金属光泽,有良好的导电性和延展性。
2. 由于价电子数少,所以碱金属原子之间的作用力比绝大多数其
他金属原子之间的作用力要小,因此碱金属很软,低熔、沸
点,且半径大、密度小。Li的密度是所有金属中最小的,它的
密度比煤油还小,所以只能放在石蜡中保存。
3. 碱土金属由于核外有2个有效成键电子,晶体中原子间距小,
金属键强度较大,因此熔点、沸点和硬度均较碱金属高。
4. 碱土金属的物理性质变化不如碱金属那么有规律,是由于其晶
格类型不完全相同。
三、化学性质
Li2O、Li3N;
M2O2 (M = Na、K、Rb、Cs)
MO2 (M = K、Rb、Cs)
M3N2 ,
MO (M = Mg、Ca、Sr、Ba)
BaO2
碱土金属:
1、与空气作用:
碱金属:
2、与水作用:
Na反应猛烈; K、Rb、Cs燃烧,量大发生爆炸;
Li、Ca、Sr、Ba反应比较慢;Be、Mg与水蒸气反应。
元素
性质 锂 钠 钾 铷 铯 铍 镁 钙 锶 钡
φAo /V -3.045 -2.714 -2.925 -2.925 -2.923 -1.85 -2.36 -2.87 -2.89 -2.91
Li
Na
K
Ca
SiO2 + 2Mg = Si + 2MgO
TiCl4 + 4Na = Ti + 4NaCl
4. 焰色反应
3、与氧化物、卤化物反应
Li
Na
K
Ca
Sr
Ba
碱金属和钙、锶、钡的挥发性化合物在高温火焰中,电子易被激发,当电子从高能级回到低能级时,便以光能的形式释放出能量,使火焰呈现特征颜色,称为~。
紫红色
黄色
紫色
砖红色
洋红色
黄绿色
5. 与液氨的作用: 导电性、还原性
M(s) + (x+y)NH3(l) = M(NH3)x+ + e(NH3)y-
FeCl3
金属的氨溶液呈蓝色,若挥发掉溶剂,又可得到金属。金属氨溶液具有高导电性和强还原性,其强还原性(氨合电子、氨基钠)常用于有机制备反应。痕量的杂质(如过渡金属的盐类、氧化物和氢氧化物)及光化作用都能促进溶液中的碱金属和液氨之间发生氧化还原反应(如上)。
四、制备
碱金属、碱土金属具有较强的还原性,而相应的离子几乎没有氧化性,还原剂很难将其还原。常用的方法有:融盐电解法、热还原法、金属置换法等。
Na:电解40%NaCl + 60%CaCl2
2NaCl = 2Na + Cl2
CaCl2的作用:
a.降低电解质的熔点,防止钠的挥发;
b.减小金属Na的分散性(混盐密度>金属钠,钠浮在上层)。
1. 融盐电解法
2. 热还原法:一般采用焦炭或碳化物为还原剂
3. 金属置换法: 高温低压下还原氯化物。
4. 热分解法
2MN3 = 2M + 3N2 (M = Na, K, Rb, Cs)
§3-3 碱金属的氧化物(钠)
性质 LiOH* NaOH KOH RbOH CsOH
颜色 白 白 白 白 白
熔点/K 723 591 633 574 545
溶解热(288K)/kJ.mol-1 23.4 44.4 57.7 62.3 74.5
水中溶解度(288K)/mol.dm -3 5.3 26.4 19.1 17.9 25.8
性质 Be(OH)2 Mg(OH)2 Ca(OH)2 Sr(OH)2 Ba(OH)2
颜色 白 白 白 白 白
熔点/K 脱水分解 脱水分解 脱水分解 脱水分解 脱水分解
水中溶解度(293K)/mol.dm -3 8×10-6 5×10-4 1.8×10-2 6.7×10-2 2×10-1
§3-4 碱金属和碱土金属的氢氧化物
1.氢氧化物的性质递变规律
LiOH 1.2 Be(OH)2 2.54
NaOH 1.0 Mg(OH)2 1.76
KOH 0.87 Ca(OH)2 1.42
RbOH 0.82 Sr(OH)2 1.33
CsOH 0.77 Ba(OH)2 1.22
碱性增强
碱性增强
碱性增强
Be(OH)2两性,LiOH、Mg(OH)2中强碱,其余为强碱。在元素周期表中自上而下碱性增强。
Be(OH)2 + 2OH- = Be(OH)42-
(1)与酸性氧化物作用
2NaOH + CO2 = Na2CO3 + H2O
2NaOH + SiO2 = Na2SiO3 + H2O
(2)能溶解某些两性金属及其氧化物
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2 ↑
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2 ↑
2. 重要的碱--NaOH 、Ca(OH)2
(3)能溶解某些非金属
2B + 2NaOH + 2H2O = 2Na[B(OH)4] + H2 ↑
Si + 2NaOH + H2O = Na2SiO3 + 2H2 ↑
X2 + 2NaOH = NaX +NaXO + H2O (X = Cl, Br, I)
3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
4P + 3NaOH + 3H2O = 3Na2H2PO4 + PH3
BeH2、MgH2为共价型
2M + H2 = 2MH ( M= 碱金属)
M + H2 = MH2 ( M= 碱土金属 )
§3-5 碱金属和碱土金属的氢化物
性质
1、热稳定性:
碱金属氢化物稳定性依LiH→CsH次序降低
2、强还原性:
MH+H2O=MOH+H2 ↑
TiCl4+4NaH=Ti+4NaCl+2H2
3. 用途
a. 有机合成中用作还原剂;
b. LiH、CaH2为野外氢气发生剂;
c. 制备NaBH4 LiAlH4:
4NaH+BF3=NaBH4+3NaF
4LiH +AlBr3= LiAlH4 +3LiBr
除Be的某些化合物(如BeCl2易溶于有机溶剂)共价型外,
碱金属和碱土金属盐基本都是离子型的。
此外,Li 、Mg在某些盐中也表现出一定的共价性
1. 晶体晶型
§3-6 碱金属和碱土金属的盐类
由于碱金属离子M+和碱土金属离子M2+本身是无色的,所
以它们的盐类的颜色取决于阴离子的颜色。
(1) 无色阴离子:X-、NO3-、SO42-、CO32-、ClO-
(2) 有色阴离子:CrO42-、Cr2O72-、MnO4-
BaCrO4黄色,K2CrO4黄色,
K2Cr2O7橙红色,
KMnO4紫色
2. 碱金属、碱土金属盐的颜色
3. 碱金属、碱土金属盐的溶解度
锂盐:LiF、Li2CO3、Li3PO4、LiKFeIO6
钠盐:Na[Sb(OH)6](白)、NaZn(UO2)3(Ac)9.6H2O(黄绿)
钾盐:KClO4(白)、 KHC4H4O4(白)、 K2[PtCl6](淡黄)
K2Na[Co(NO2)6](亮黄) 、K[B(C6H5)4](白)
铷盐、铯盐:比上述钾盐更难溶。
碱金属盐类一般是易溶于水且完全电离形成水合离子;
a. 碱金属盐
b. 碱土金属盐
AB型多难溶:
SO42-、CO32-、C2O42-、CrO42-、PO43-
A2B(AB2)型多可溶:
NO3- 、 ClO3 - 、 ClO4- 、 Cl- 、 Br- 、 I-
碱土金属盐类的重要特征是它们的微溶性。
盐类 Mg Ca Sr Ba
MF2 6.4×10-9 3.9×10-11 3.4×10-9 1.7×10-6
MCO3 1.0×10-5 4.8×10-9 9.4×10-10 8.1×10-9
MC2O4 8.6×10-5 2.3×10-9 5.6×10-8 1.1×10-7
MSO4 溶 6.1×10-5 2.8×10-7 1.08×10-10
MCrO4 溶 2.3×10-2 3.6×10-5 2.0×10-10
一般具有较高的热稳定性。
(1)卤化物高温挥发不分解;
(2)硫酸盐既不挥发又难分解;
4、热稳定性
(3)碳酸盐:碳酸盐除Li2CO3在1000K以上部分地分解为Li2O和CO2以外,其余皆难分解;
(4) MNO3热稳定性低
4LiNO3 = 2Li2O+2N2O4+O2
2NaNO3 = 2NaNO2+O2
2KNO3 = 2KNO2+O2
碱金属盐
碱土金属盐
Be → Ba其盐的热稳定性增强
BeCO3 MgCO3 CaCO3 SrCO3 BaCO3
分解温度/K 373 813 1173 1563 1633
碱土金属的盐的热稳定性较碱金属差,但常温下也都是稳定的。
锂与镁的相似性
1、在氧气中燃烧生成正常的氧化物;
2、氢氧化物在加热时,可分解为氧化物;
3、碳酸盐受热易分解生成氧化物;
4、与N、C形成离子型氮化物和碳化物;
5、硝酸盐热分解产物为Li2O(MgO)+O2+NO2;
6、Li+、Mg2+水合热较大;
7、LiCl 、MgCl2共价性较强,可溶于有机溶剂;
8、Li、Mg的氟化物、碳酸盐、磷酸盐难溶于水;
9、水合氯化物晶体受热发生水解。
铍与铝的相似性
1、活泼金属,亲氧元素;
2、两性元素,氧化物和氢氧化物均为两性;
3、氧化物的熔点、硬度皆高;
4、 Be2+ 、Al3+均有较强的水解性;
5、无水氯化物是共价型化合物,易聚合,易升华,溶于乙醇、乙醚等有机溶剂;
6、Be、Al被冷、浓硝酸所钝化。
同课章节目录
