2.3 氧化还原反应(课件)
文档属性
| 名称 | 2.3 氧化还原反应(课件) |

|
|
| 格式 | zip | ||
| 文件大小 | 934.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-10-22 00:00:00 | ||
图片预览





文档简介
(共25张PPT)
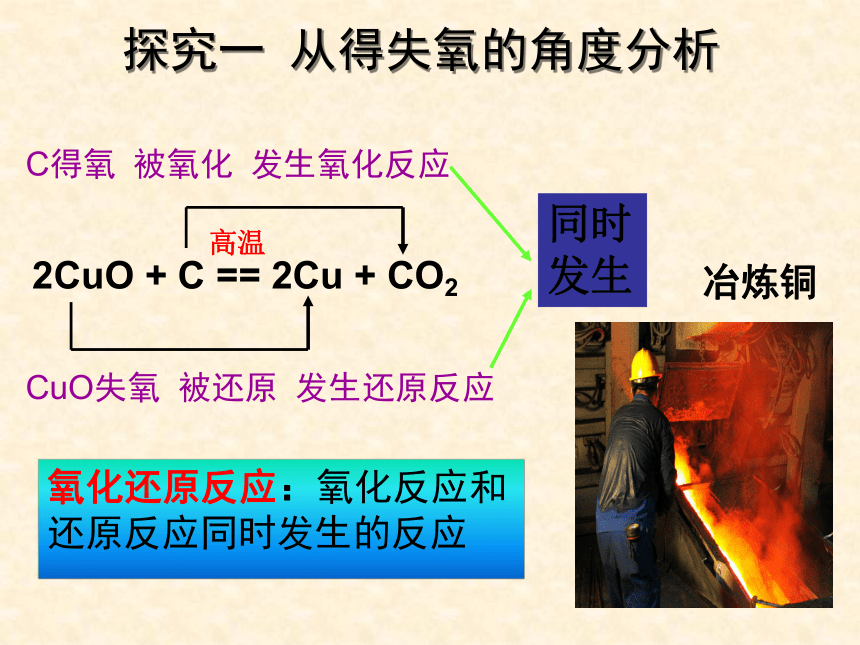
2CuO + C == 2Cu + CO2
C得氧 被氧化 发生氧化反应
CuO失氧 被还原 发生还原反应
同时发生
高温
冶炼铜
探究一 从得失氧的角度分析
氧化还原反应:氧化反应和还原反应同时发生的反应
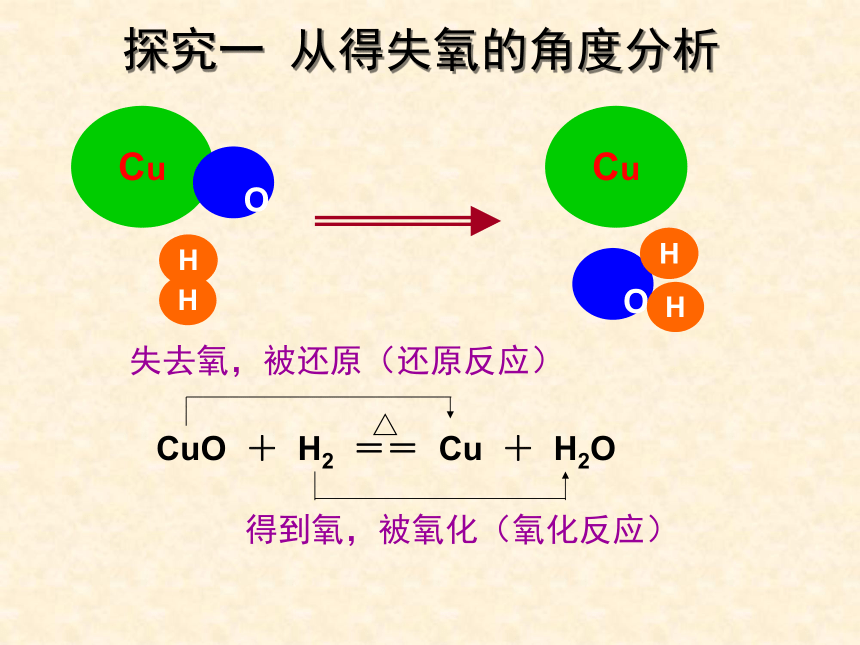
得到氧,被氧化(氧化反应)
△
CuO + H2 == Cu + H2O
失去氧,被还原(还原反应)
Cu
O
H
H
H
H
Cu
O
探究一 从得失氧的角度分析
思考与交流
探究二 从化合价升降的角度分析
以上反应在得氧失氧的同时,元素的化合价是否发生了变化?
+2
0
0
+4
2CuO + C === 2Cu + CO2
探究二 从化合价升降的角度分析
高温
+2
0
0
+1
化合价升高 得氧 被氧化(氧化反应)
△
CuO + H2 === Cu + H2O
化合价降低 失氧 被还原(还原反应)
化合价升高 得氧 被氧化(氧化反应)
化合价降低 失氧 被还原(还原反应)
探究二 从化合价升降的角度分析
氧化反应:物质所含元素化合价升高的反应
还原反应:物质所含元素化合价降低的反应
氧化还原反应:有元素化合价升降的化学反应
探究二 从化合价升降的角度分析
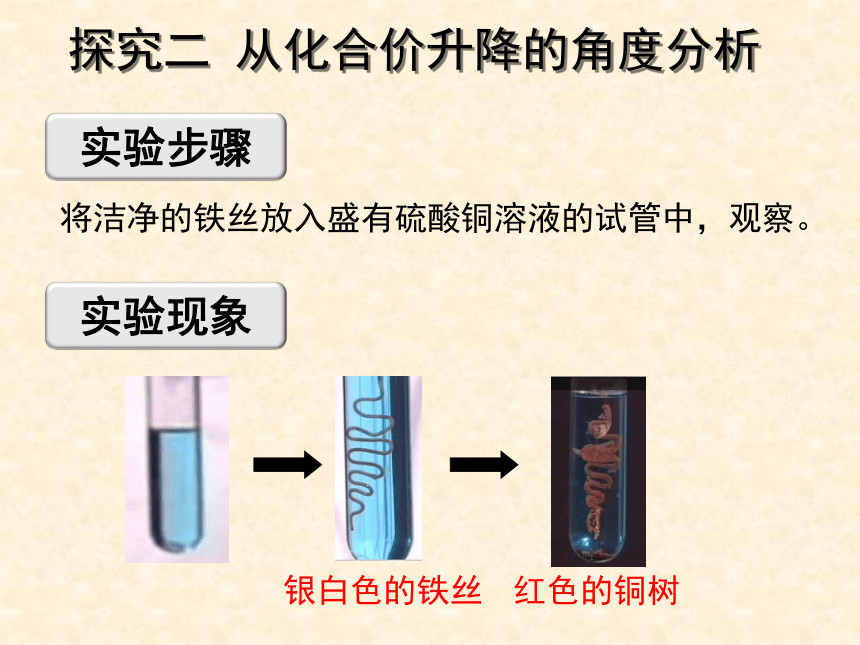
将洁净的铁丝放入盛有硫酸铜溶液的试管中,观察。
实验现象
实验步骤
红色的铜树
银白色的铁丝
实验方程式
探究二 从化合价升降的角度分析
CuSO4 + Fe === Cu + FeSO4
化合价降低 被还原(还原反应)
+2
0
0
+2
化合价升高 被氧化(氧化反应)
并非只有得失氧的反应才是氧化还原反应。
结论:
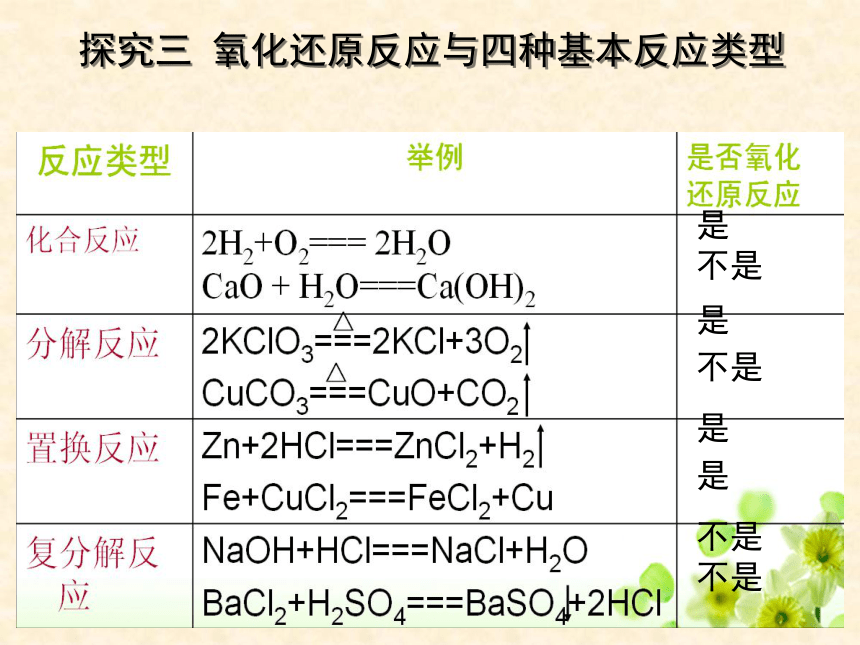
探究三 氧化还原反应与四种基本反应类型
是
是
是
是
不是
不是
不是
不是
化学反应
非氧化还原反应
氧化还原反应
复分解反应
分解反应
化合反应
置换反应
探究三 氧化还原反应与四种基本反应类型
生活中的氧化还原反应
2、有元素化合价升降的化学反应称为氧化还原反应。
3、氧化还原反应的特征现象:反应前后元素化合价发生变化(也是判断依据)。
学会比较 学会总结
1、得氧和失氧的反应只是氧化还原反应中的一部分。
练一练
下列反应属于氧化还原反应的是( )
A.CuO+2HCl=CuCl2+H2O
B.2Na2O2+2H2O=4NaOH+O2
C.Zn+CuSO4=ZnSO4+Cu
D.Ca(OH)2+CO2=CaCO3 + H2O
BC
复习旧知:
1、氧化还原反应
1、定义:
2、特征:
3、本质:
凡有电子转移(得失或偏移)的反应叫氧化还原反应。
反应中有元素化合价的升降
反应中有电子的得失或电子对的偏移
2.在下列各式中,当左边的物质能生成右边的物质时,试指出下列带短线的元素是被氧化还是被还原?
(1)KClO3→KCl (2)HClO→O2
(3)KI→I2 (4)NO2→HNO3
氧 化 剂:
还 原 剂:
氧化产物:
还原产物:
所含元素化合价降低的反应物
所含元素化合价升高的反应物
还原剂失去电子被氧化后的产物
氧化剂得到电子被还原后的产物
1、氧化剂还原剂相关概念
CuO +H2 = Cu + H2O
判断下列哪些反应是氧化还原反应?是的话判断反应中的氧化剂、还原剂、氧化产物、还原产物。
1. Na2O + H2O = 2NaOH
2. 2Fe + Al2O3 = 2Al + Fe2O3
3. Br 2+ H2O = HBr + HBrO
△
练习1
氧化剂
还原剂
氧化产物
还原产物
氧化剂
还原剂
氧化产物
还原产物
2、氧化还原反应各相关概念间的关系
氧化剂→氧化性→得电子→价降低→被还原→还原产物
↑ ↑ ↑ ↑ ↑ ↑
反应物—性质 — 本质 — 特征 —反应 — 生成物
↓ ↓ ↓ ↓ ↓ ↓
还原剂→还原性→失电子→价升高→被氧化→氧化产物
CuO +H2 = Cu + H2O
氧化剂 + 还原剂 还原产物 + 氧化产物
3、文字表达式:
相互关系:
氧化剂 + 还原剂 还原产物 + 氧化产物
得ne-,化合价降低,被还原,发生还原反应
失ne-,化合价升高,被氧化,发生氧化反应
4、双线桥法表示氧化还原反应中电子转移的情况:
例1:CuO +H2 = Cu + H2O
得2e-,化合价降低,被还原
失2e-,化合价升高,被氧化
例2:
MnO2
△
失6×2e-,化合价升高,被氧化
得2×6e-,化合价降低,被还原
2KClO3 == 2KCl + 3 O2
+2
0
0
+1
+5
-1
-2
0
讨论:
双线桥法表示电子转移情况的特点:
1、箭头从反应物指向生成物,起止为同一元素
2、箭头不代表电子转移方向 3、要标明“得”“失”电子,且得失电子总数应相等
双线桥法表示电子转移情况应注意什么?
注意:
小结1:判断微粒(分子、原子、
离子)是否有氧化性或还原性。
(1)元素处于最高价态---只能得电子----只有氧化性
(2)元素处于最低价态---只能失电子----只有还原性
(3)元素处于中间价态---
即能得电子 ---既有氧化性
又能失电子 ---又有还原性
小结2:常见的氧化剂、还原剂
(1)常见的氧化剂:活泼的非金属如:卤素单质、氧气;含有高价态元素的化合物如:HNO3、 KMnO4 、KClO3、浓H2SO4等。
(2)常见的还原剂:活泼的金属如:Na、K、Zn、Al、Fe;某些非金属如:H2、C; 含有低价态元素的化合物如:H2S、CO、HI等。
下列微粒中只有氧化性的是 ;只有还原性的是---------------
既有氧化性又有还原性的是 。
Cl2 (2)Cl- (3)Fe (4)Fe2+
(5)Fe3+ (6) O2 (7) S2- (8) S
(9) SO2 (10) HCl
5、6
2、3、7
1、4、8、9、10
2CuO + C == 2Cu + CO2
C得氧 被氧化 发生氧化反应
CuO失氧 被还原 发生还原反应
同时发生
高温
冶炼铜
探究一 从得失氧的角度分析
氧化还原反应:氧化反应和还原反应同时发生的反应
得到氧,被氧化(氧化反应)
△
CuO + H2 == Cu + H2O
失去氧,被还原(还原反应)
Cu
O
H
H
H
H
Cu
O
探究一 从得失氧的角度分析
思考与交流
探究二 从化合价升降的角度分析
以上反应在得氧失氧的同时,元素的化合价是否发生了变化?
+2
0
0
+4
2CuO + C === 2Cu + CO2
探究二 从化合价升降的角度分析
高温
+2
0
0
+1
化合价升高 得氧 被氧化(氧化反应)
△
CuO + H2 === Cu + H2O
化合价降低 失氧 被还原(还原反应)
化合价升高 得氧 被氧化(氧化反应)
化合价降低 失氧 被还原(还原反应)
探究二 从化合价升降的角度分析
氧化反应:物质所含元素化合价升高的反应
还原反应:物质所含元素化合价降低的反应
氧化还原反应:有元素化合价升降的化学反应
探究二 从化合价升降的角度分析
将洁净的铁丝放入盛有硫酸铜溶液的试管中,观察。
实验现象
实验步骤
红色的铜树
银白色的铁丝
实验方程式
探究二 从化合价升降的角度分析
CuSO4 + Fe === Cu + FeSO4
化合价降低 被还原(还原反应)
+2
0
0
+2
化合价升高 被氧化(氧化反应)
并非只有得失氧的反应才是氧化还原反应。
结论:
探究三 氧化还原反应与四种基本反应类型
是
是
是
是
不是
不是
不是
不是
化学反应
非氧化还原反应
氧化还原反应
复分解反应
分解反应
化合反应
置换反应
探究三 氧化还原反应与四种基本反应类型
生活中的氧化还原反应
2、有元素化合价升降的化学反应称为氧化还原反应。
3、氧化还原反应的特征现象:反应前后元素化合价发生变化(也是判断依据)。
学会比较 学会总结
1、得氧和失氧的反应只是氧化还原反应中的一部分。
练一练
下列反应属于氧化还原反应的是( )
A.CuO+2HCl=CuCl2+H2O
B.2Na2O2+2H2O=4NaOH+O2
C.Zn+CuSO4=ZnSO4+Cu
D.Ca(OH)2+CO2=CaCO3 + H2O
BC
复习旧知:
1、氧化还原反应
1、定义:
2、特征:
3、本质:
凡有电子转移(得失或偏移)的反应叫氧化还原反应。
反应中有元素化合价的升降
反应中有电子的得失或电子对的偏移
2.在下列各式中,当左边的物质能生成右边的物质时,试指出下列带短线的元素是被氧化还是被还原?
(1)KClO3→KCl (2)HClO→O2
(3)KI→I2 (4)NO2→HNO3
氧 化 剂:
还 原 剂:
氧化产物:
还原产物:
所含元素化合价降低的反应物
所含元素化合价升高的反应物
还原剂失去电子被氧化后的产物
氧化剂得到电子被还原后的产物
1、氧化剂还原剂相关概念
CuO +H2 = Cu + H2O
判断下列哪些反应是氧化还原反应?是的话判断反应中的氧化剂、还原剂、氧化产物、还原产物。
1. Na2O + H2O = 2NaOH
2. 2Fe + Al2O3 = 2Al + Fe2O3
3. Br 2+ H2O = HBr + HBrO
△
练习1
氧化剂
还原剂
氧化产物
还原产物
氧化剂
还原剂
氧化产物
还原产物
2、氧化还原反应各相关概念间的关系
氧化剂→氧化性→得电子→价降低→被还原→还原产物
↑ ↑ ↑ ↑ ↑ ↑
反应物—性质 — 本质 — 特征 —反应 — 生成物
↓ ↓ ↓ ↓ ↓ ↓
还原剂→还原性→失电子→价升高→被氧化→氧化产物
CuO +H2 = Cu + H2O
氧化剂 + 还原剂 还原产物 + 氧化产物
3、文字表达式:
相互关系:
氧化剂 + 还原剂 还原产物 + 氧化产物
得ne-,化合价降低,被还原,发生还原反应
失ne-,化合价升高,被氧化,发生氧化反应
4、双线桥法表示氧化还原反应中电子转移的情况:
例1:CuO +H2 = Cu + H2O
得2e-,化合价降低,被还原
失2e-,化合价升高,被氧化
例2:
MnO2
△
失6×2e-,化合价升高,被氧化
得2×6e-,化合价降低,被还原
2KClO3 == 2KCl + 3 O2
+2
0
0
+1
+5
-1
-2
0
讨论:
双线桥法表示电子转移情况的特点:
1、箭头从反应物指向生成物,起止为同一元素
2、箭头不代表电子转移方向 3、要标明“得”“失”电子,且得失电子总数应相等
双线桥法表示电子转移情况应注意什么?
注意:
小结1:判断微粒(分子、原子、
离子)是否有氧化性或还原性。
(1)元素处于最高价态---只能得电子----只有氧化性
(2)元素处于最低价态---只能失电子----只有还原性
(3)元素处于中间价态---
即能得电子 ---既有氧化性
又能失电子 ---又有还原性
小结2:常见的氧化剂、还原剂
(1)常见的氧化剂:活泼的非金属如:卤素单质、氧气;含有高价态元素的化合物如:HNO3、 KMnO4 、KClO3、浓H2SO4等。
(2)常见的还原剂:活泼的金属如:Na、K、Zn、Al、Fe;某些非金属如:H2、C; 含有低价态元素的化合物如:H2S、CO、HI等。
下列微粒中只有氧化性的是 ;只有还原性的是---------------
既有氧化性又有还原性的是 。
Cl2 (2)Cl- (3)Fe (4)Fe2+
(5)Fe3+ (6) O2 (7) S2- (8) S
(9) SO2 (10) HCl
5、6
2、3、7
1、4、8、9、10
