辽宁省朝阳市建平县普通高中2021-2022学年高二上学期第二次月考(12月)化学试题(Word版含答案)
文档属性
| 名称 | 辽宁省朝阳市建平县普通高中2021-2022学年高二上学期第二次月考(12月)化学试题(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 741.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-18 20:45:42 | ||
图片预览



文档简介
建平县普通高中2021-2022学年高二上学期第二次月考
化学试题
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请将答案正确填写在答题卡上
可能用到的相对原子质量:H:1 C:12 O:16 N:14 S:32 Na:23 Al:27 Cl:35.5
K:39 Fe:56 Mn:55 Cu:64 Zn:65 Ba:137 Co:59
第I卷(选择题 45分)
一、单选题(每小题只有一个选项符合题意,每小题3分,共45分)
1.下列溶液中,一定呈中性的是
A.NaHCO3 B.c(H+)=1×10-7mol/L C.c(OH-)= D.pH=7
2.下列关于实验现象的描述不正确的是
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片作负极,铜片作正极,在溶液中,铜片质量增加
C. 把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
3.下列应用与盐类水解无主要关系的是
A.用铝盐和铁盐作净水剂
B.不用玻璃试剂瓶盛放NaF溶液
C.将固体溶解于浓盐酸,再加水稀释到所需浓度
D. 溶液制备晶体时,不能采用直接蒸干溶液的方法获取结晶
4. 的溶液中加入蒸馏水,将其稀释到后,下列数值减小的是
A. B.
C.的电离度: D.的电离度:
5.下列说法正确的是
A.常温下,将pH=2的HA溶液与pH=12的BOH溶液等体积混合后,溶液的pH<7,则BA为强酸弱碱盐
B.弱电解质溶液稀释后,溶液中各离子浓度一定都减小
C.常温下,向体积相同pH均为1的盐酸和醋酸溶液中分别加入足量锌片,两种溶液生成H2的体积相同
D.常温下,将pH均为13的NaOH溶液和氨水分别加水稀释100倍后,氨水的碱性强于NaOH溶液
6.室温下,将两种溶液等体积混合,若溶液混合引起的体积变化可忽略,下列各混合溶液中微粒物质的量浓度关系正确的是
A.0.1mol·L-1HF(Ka=6.8×10-4)溶液和0.1mol·L-1NaOH溶液混合:c(Na+)>c(OH-)>c(F-)>c(H+)
B.0.1mol·L-1NaOH溶液和0.1mol·L-1H2C2O4(Ka1=5.4×10 2,Ka2=5.4×10-5)溶液混合:
c(Na+)>c(HC2O)>c(C2O)>c(H2C2O4)
C.0.1mol·L-1NaHCO3溶液和0.1mol·L-1Na2CO3溶液混合:3c(Na+)=2c(CO)+2c(HCO)+2c(H2CO3)
D.0.1mol·L-1CH3COONa和0.1mol·L-1HCl溶液混合:c(Na+)+c(CH3COO-)=c(Cl-)+c(H+)
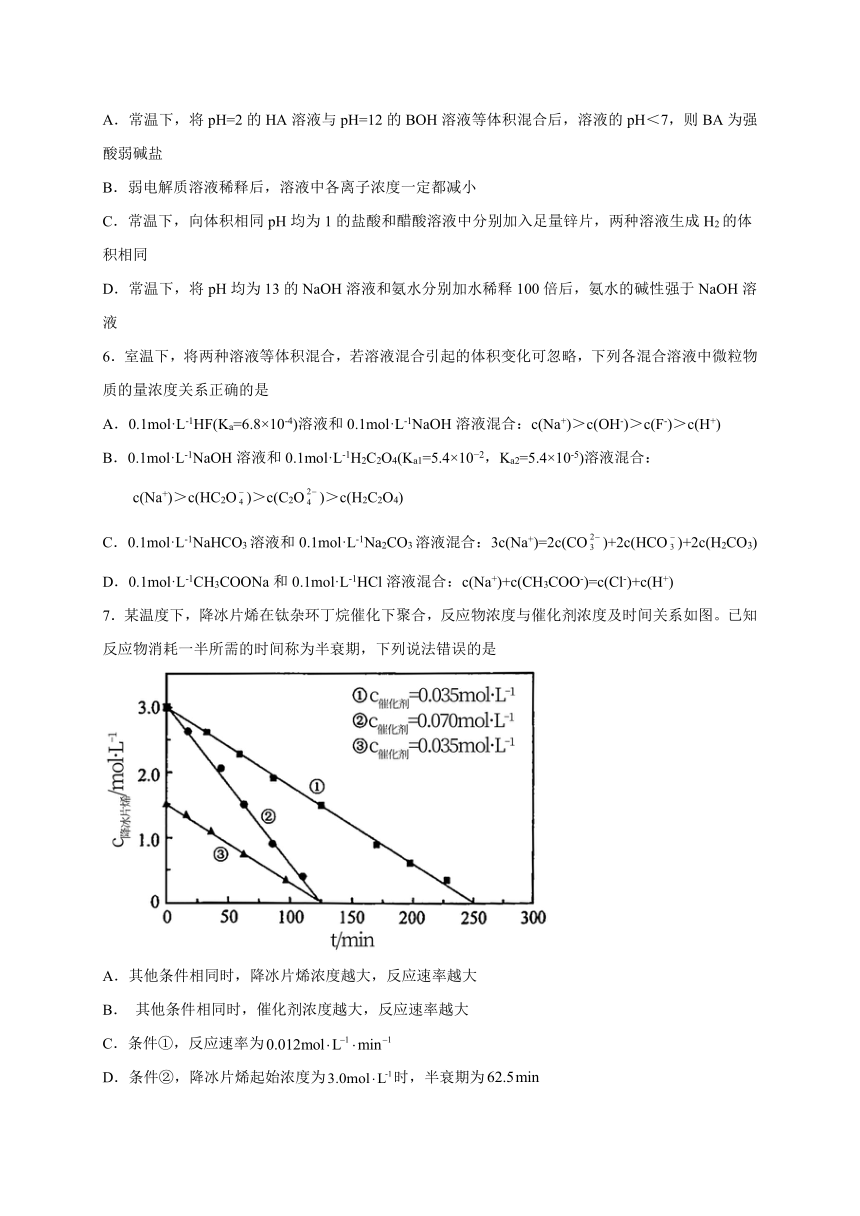
7.某温度下,降冰片烯在钛杂环丁烷催化下聚合,反应物浓度与催化剂浓度及时间关系如图。已知反应物消耗一半所需的时间称为半衰期,下列说法错误的是
A.其他条件相同时,降冰片烯浓度越大,反应速率越大
B. 其他条件相同时,催化剂浓度越大,反应速率越大
C.条件①,反应速率为
D.条件②,降冰片烯起始浓度为时,半衰期为
8.下列实验能达到预期目的是
实验内容 实验目的
A 将的KI溶液和的溶液等体积混合,充分反应后,取少许混合液滴加溶液 验证与的反应有一定限度
B 将碱式滴定管的尖嘴朝下,慢慢挤压胶管内玻璃球将气泡排出 除去碱式滴定管胶管内气泡
C 相同条件下,向一支试管中加入和,向另一支试管中加入和溶液,观察并比较实验现象 探究对分解速率的影响
D 向2支盛有5mL不同浓度溶液的试管中,同时加入溶液,观察并比较实验现象 探究浓度对反应速率的影响
9.常温下,下列各种情况下一定能大量共存的离子组为
A.的溶液中:
B.的溶液中:
C.由水电离出的的溶液中:
D.无色溶液中:
10.一种应用比较广泛的甲醇燃料电池,电解液是酸性溶液,其工作原理如图所示,下列说法正确的是
A.若有生成,则有从甲池通过交换膜进入乙池
B.N极电极反应为
C.甲池溶液增大,乙池溶液减小
D.M极为负极,发生还原反应
11. SnCl2易水解,是常见的抗氧化剂。实验室以SnCl2为原料制备SnSO4·2H2O的流程如下,下列说法错误的是
A.溶解时,将SnCl2固体溶于浓盐酸,加水稀释至所需浓度,再加入适量Sn粉
B.反应1的离子方程式为Sn2++2=SnO↓+H2O+2CO2↑
C.洗涤SnO沉淀的方法是向过滤器中加入蒸馏水至浸没沉淀,搅拌,待水完全流出后重复操作2-3次
D.可用HNO3酸化的AgNO3溶液检验SnO沉淀是否已被洗涤干净
12.恒温恒容条件下,建立化学平衡。平衡后,再向体系中充入一定量的,下列叙述正确的是
A.化学平衡正向移动 B.再次达到平衡时,的转化率提高
C.再次达到平衡时,的浓度增大 D.再次达到平衡时,的百分含量增大
13.下列选项正确的是
A.图①可表示的能量变化
B.图②中表示碳的燃烧热
C.实验的环境温度为20 ℃,将物质的量浓度相等、体积分别为、的、NaOH溶液混合,测得混合液最高温度如图③所示(已知)
D.已知稳定性:B<A<C,某反应由两步构成A→B→C,反应过程中的能量变化曲线如图④所示
14.(本题0分)常温下,用0.10 mol·L-1NaOH溶液分别滴定20.00 mL浓度均为0.10 mol·L-1CH3COOH溶液和HCN溶液,所得滴定曲线如图。下列说法不正确的是
A.点①和点②所示溶液中:c(CN-)>c(CH3COO-)
B.点①所示溶液中,CN-的水解程度大于HCN的电离程度
C.点③所示溶液中:c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
D.点④所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
15.t℃时,在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
A.t℃时,的Ksp数量级是10-9
B.在饱和溶液中加入固体可使溶液由Y点到X点
C.t℃时,用液滴定和的混合液,先沉淀
D.t℃时:的平衡常数(t℃时)
第II卷(非选择题 55分)
16.(本题10分)常温下,有四种溶液:
①0.1 mol·L-1 CH3COOH溶液 ②0.1 mol·L-1 CH3COONa溶液 ③0.1 mol·L-1 NaHSO3溶液④0.1 mol·L-1 NaHCO3溶液
(1)溶液①的pH____(填“>”“<”或“=”)7,溶液中离子的电荷守恒关系式是___。
(2)溶液②呈______(填“酸”“碱”或“中”)性。其原因是___(用离子方程式说明)。
(3)下列有关①和②两种溶液的说法正确的是____(填字母)。
a. 两种溶液中c(CH3COO-) 都小于0.1 mol·L-1
b. 两种溶液中c(CH3COO-) 都等于0.1 mol·L-1
c. CH3COOH溶液中c(CH3COO-) 小于CH3COONa溶液中c(CH3COO-)
(4)NaHCO3溶液的pH>7,NaHSO3溶液的pH<7,则,NaHCO3溶液中c(H2CO3)______ (填“>”“<”或“=”,下同)c(),NaHSO3溶液中c(H2SO3)____c().
17.(本题10分)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
(1)当电极a为Fe,电极b为Cu,且两极板质量相等。电解质溶液为CuSO4溶液时,当电路中有1mole-通过时,两极板的质量差为___________g。
(2)当电极a为Fe,电极b为Cu,电解质溶液为浓硝酸溶液时,___________作负极,正极的电极反应式为___________。
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所产生的化学能转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,CO为燃料,采用NaOH溶液为电解液,则CO通入的电极反应式为___________。
(4)理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“”设计一个双液原电池,并在下面方框内画出双液原电池实验装置图,注明电极材料和电解质溶液等。___________
18.(本题12分)页岩气是从页岩层中开采的一种非常重要的天然气资源,页岩气的主要成分是甲烷,是公认的洁净能源。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和),与通入聚焦太阳能反应器,发生反应 。已知:
①
②
③
则___________(用含、、的代数式表示)
(2)用合成气生成甲醇的反应为 ,在10L恒容密闭容器中按物质的量之比1:2充入CO和,测得CO的平衡转化率与温度和压强的关系如图所示:
200℃时随时间的变化如下表所示:
t/min 0 1 3 5
8.0 5.4 4.0 4.0
①该反应的平衡常数表达式为___________;___________(填“>”“<”或“=”)0。
②写出一条可同时提高反应速率和CO转化率的措施:___________。
③下列说法正确的是___________(填字母)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强:
④0~1min内用表示的反应速率___________。
⑤向上述200℃达到平衡的恒容密闭容器中再加入2 mol CO、4 mol 、2 mol ,保持温度不变,则化学平衡___________(填“正向”“逆向”或“不”)移动。
19.(本题11分)滴定是分析化学中重要的分析方法之一,酸碱中和滴定是最基本的滴定方法。根据其原理回答下列问题:
(1)①滴定管在使用之前应进行的操作是_______;
②滴定时右手_______,眼睛应注意观察_______;
(2)食醋是日常饮食中的一种调味剂,国家标准规定酿造食醋中醋酸含量不得低于0.035 g/mL。选择酚酞作指示剂,用0.0250 mol/L的标准NaOH溶液可以测定食醋中醋酸的浓度,以检测白醋是否符合国家标准。某品牌白醋的醋酸浓度测定过程如下图所示。
回答下列问题:
①滴定达到终点时的现象是_______。
②某次实验滴定开始和结束时,碱式滴定管中的液面如图所示,则所用NaOH溶液的体积为_______mL。
③通过实验测得稀释后白醋的物质的量浓度为_______,则该白醋_______ (“符合”或“不符合”)国家标准。
④下列操作中,可能使所测白醋中醋酸的浓度数值偏低的是_______ (填编号)。
A.碱式滴定管未用标准NaOH溶液润洗就直接注入标准NaOH溶液
B.滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后没有干燥
C.滴定过程中振荡时有液滴溅出
D.读取NaOH溶液体积时,开始时仰视读数,滴定结束时俯视读数
E.碱式滴定管在滴定前有气泡,滴定后气泡消失
20.(本题11分)某矿渣的成分为主要有Cu2O、还有Al2O3、Fe2O3、SiO2等杂质,工业上用该矿渣获取铜和胆矾的操作流程如下:
已知:①Cu2O+2H+=Cu+Cu2++H2O。
②部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
沉淀物 Cu(OH)2 Al(OH)3 Fe(OH)3 Fe(OH)2
开始沉淀pH 5.4 4.0 2.7 5.8
沉淀完全pH 6.7 5.2 3.7 8.8
(1)为了加快反应Ⅰ的速率,可以采取的措施是___________(写两条)。
(2)固体混合物A中的成分是___________。
(3)反应Ⅰ完成后,铁元素的存在形式为___________(填离子符号);写出生成该离子的离子方程式___________。
(4)操作1主要包括:蒸发浓缩、冷却结晶、___________。
(5)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,利用题中所给信息分析沉淀B为___________, 该反应的离子方程式为______
第7页 共10页 ◎ 第8页 共10页
参考答案
1.C2.C3.D4.A5.D6.B7.A8.C9.B10.A11.C12.C13.D14.A15.D
16.(10分 除标注外均为1分)
< c(H+)=c(CH3COO-)+c(OH-)(2分) 碱 CH3COO-+H2OCH3COOH+OH-,(2分)ac (2分) > <
17.(10分 除标注外均为2分)
(1)60(2分)
(2) Cu
(3)
(4)
18.(12分 除标注外均为1分) (1)(2分)
(2) < 增大浓度(或增大压强) (2分) cd (2分) 0.13(2分) 正向 (2分)
19.(12分 除标注外均为1分))
(1) 检查是否漏液 摇动锥形瓶 锥形瓶内溶液颜色的变化
(2) 当滴入最后半滴标准 NaOH 溶液时,溶液颜色由无色刚好变为浅(粉)红色,且半分钟内不褪色 (2分) 26.10ml 0.0261mol/L(2分) 符合(2分) CD(2分)
20.(11分除标注外均为1分)
适当升高温度;不断搅拌;将矿渣粉碎;适当增大硫酸的浓度等(2分) SiO2、Cu(2分) Fe2+ 2Fe3++Cu=Cu2++2Fe2+ (2分) 过滤 Fe(OH)3 2Fe2++5ClO-+5H2O=2Fe(OH)3+Cl-+4HClO (2分)
化学试题
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请将答案正确填写在答题卡上
可能用到的相对原子质量:H:1 C:12 O:16 N:14 S:32 Na:23 Al:27 Cl:35.5
K:39 Fe:56 Mn:55 Cu:64 Zn:65 Ba:137 Co:59
第I卷(选择题 45分)
一、单选题(每小题只有一个选项符合题意,每小题3分,共45分)
1.下列溶液中,一定呈中性的是
A.NaHCO3 B.c(H+)=1×10-7mol/L C.c(OH-)= D.pH=7
2.下列关于实验现象的描述不正确的是
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片作负极,铜片作正极,在溶液中,铜片质量增加
C. 把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
3.下列应用与盐类水解无主要关系的是
A.用铝盐和铁盐作净水剂
B.不用玻璃试剂瓶盛放NaF溶液
C.将固体溶解于浓盐酸,再加水稀释到所需浓度
D. 溶液制备晶体时,不能采用直接蒸干溶液的方法获取结晶
4. 的溶液中加入蒸馏水,将其稀释到后,下列数值减小的是
A. B.
C.的电离度: D.的电离度:
5.下列说法正确的是
A.常温下,将pH=2的HA溶液与pH=12的BOH溶液等体积混合后,溶液的pH<7,则BA为强酸弱碱盐
B.弱电解质溶液稀释后,溶液中各离子浓度一定都减小
C.常温下,向体积相同pH均为1的盐酸和醋酸溶液中分别加入足量锌片,两种溶液生成H2的体积相同
D.常温下,将pH均为13的NaOH溶液和氨水分别加水稀释100倍后,氨水的碱性强于NaOH溶液
6.室温下,将两种溶液等体积混合,若溶液混合引起的体积变化可忽略,下列各混合溶液中微粒物质的量浓度关系正确的是
A.0.1mol·L-1HF(Ka=6.8×10-4)溶液和0.1mol·L-1NaOH溶液混合:c(Na+)>c(OH-)>c(F-)>c(H+)
B.0.1mol·L-1NaOH溶液和0.1mol·L-1H2C2O4(Ka1=5.4×10 2,Ka2=5.4×10-5)溶液混合:
c(Na+)>c(HC2O)>c(C2O)>c(H2C2O4)
C.0.1mol·L-1NaHCO3溶液和0.1mol·L-1Na2CO3溶液混合:3c(Na+)=2c(CO)+2c(HCO)+2c(H2CO3)
D.0.1mol·L-1CH3COONa和0.1mol·L-1HCl溶液混合:c(Na+)+c(CH3COO-)=c(Cl-)+c(H+)
7.某温度下,降冰片烯在钛杂环丁烷催化下聚合,反应物浓度与催化剂浓度及时间关系如图。已知反应物消耗一半所需的时间称为半衰期,下列说法错误的是
A.其他条件相同时,降冰片烯浓度越大,反应速率越大
B. 其他条件相同时,催化剂浓度越大,反应速率越大
C.条件①,反应速率为
D.条件②,降冰片烯起始浓度为时,半衰期为
8.下列实验能达到预期目的是
实验内容 实验目的
A 将的KI溶液和的溶液等体积混合,充分反应后,取少许混合液滴加溶液 验证与的反应有一定限度
B 将碱式滴定管的尖嘴朝下,慢慢挤压胶管内玻璃球将气泡排出 除去碱式滴定管胶管内气泡
C 相同条件下,向一支试管中加入和,向另一支试管中加入和溶液,观察并比较实验现象 探究对分解速率的影响
D 向2支盛有5mL不同浓度溶液的试管中,同时加入溶液,观察并比较实验现象 探究浓度对反应速率的影响
9.常温下,下列各种情况下一定能大量共存的离子组为
A.的溶液中:
B.的溶液中:
C.由水电离出的的溶液中:
D.无色溶液中:
10.一种应用比较广泛的甲醇燃料电池,电解液是酸性溶液,其工作原理如图所示,下列说法正确的是
A.若有生成,则有从甲池通过交换膜进入乙池
B.N极电极反应为
C.甲池溶液增大,乙池溶液减小
D.M极为负极,发生还原反应
11. SnCl2易水解,是常见的抗氧化剂。实验室以SnCl2为原料制备SnSO4·2H2O的流程如下,下列说法错误的是
A.溶解时,将SnCl2固体溶于浓盐酸,加水稀释至所需浓度,再加入适量Sn粉
B.反应1的离子方程式为Sn2++2=SnO↓+H2O+2CO2↑
C.洗涤SnO沉淀的方法是向过滤器中加入蒸馏水至浸没沉淀,搅拌,待水完全流出后重复操作2-3次
D.可用HNO3酸化的AgNO3溶液检验SnO沉淀是否已被洗涤干净
12.恒温恒容条件下,建立化学平衡。平衡后,再向体系中充入一定量的,下列叙述正确的是
A.化学平衡正向移动 B.再次达到平衡时,的转化率提高
C.再次达到平衡时,的浓度增大 D.再次达到平衡时,的百分含量增大
13.下列选项正确的是
A.图①可表示的能量变化
B.图②中表示碳的燃烧热
C.实验的环境温度为20 ℃,将物质的量浓度相等、体积分别为、的、NaOH溶液混合,测得混合液最高温度如图③所示(已知)
D.已知稳定性:B<A<C,某反应由两步构成A→B→C,反应过程中的能量变化曲线如图④所示
14.(本题0分)常温下,用0.10 mol·L-1NaOH溶液分别滴定20.00 mL浓度均为0.10 mol·L-1CH3COOH溶液和HCN溶液,所得滴定曲线如图。下列说法不正确的是
A.点①和点②所示溶液中:c(CN-)>c(CH3COO-)
B.点①所示溶液中,CN-的水解程度大于HCN的电离程度
C.点③所示溶液中:c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
D.点④所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
15.t℃时,在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
A.t℃时,的Ksp数量级是10-9
B.在饱和溶液中加入固体可使溶液由Y点到X点
C.t℃时,用液滴定和的混合液,先沉淀
D.t℃时:的平衡常数(t℃时)
第II卷(非选择题 55分)
16.(本题10分)常温下,有四种溶液:
①0.1 mol·L-1 CH3COOH溶液 ②0.1 mol·L-1 CH3COONa溶液 ③0.1 mol·L-1 NaHSO3溶液④0.1 mol·L-1 NaHCO3溶液
(1)溶液①的pH____(填“>”“<”或“=”)7,溶液中离子的电荷守恒关系式是___。
(2)溶液②呈______(填“酸”“碱”或“中”)性。其原因是___(用离子方程式说明)。
(3)下列有关①和②两种溶液的说法正确的是____(填字母)。
a. 两种溶液中c(CH3COO-) 都小于0.1 mol·L-1
b. 两种溶液中c(CH3COO-) 都等于0.1 mol·L-1
c. CH3COOH溶液中c(CH3COO-) 小于CH3COONa溶液中c(CH3COO-)
(4)NaHCO3溶液的pH>7,NaHSO3溶液的pH<7,则,NaHCO3溶液中c(H2CO3)______ (填“>”“<”或“=”,下同)c(),NaHSO3溶液中c(H2SO3)____c().
17.(本题10分)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
(1)当电极a为Fe,电极b为Cu,且两极板质量相等。电解质溶液为CuSO4溶液时,当电路中有1mole-通过时,两极板的质量差为___________g。
(2)当电极a为Fe,电极b为Cu,电解质溶液为浓硝酸溶液时,___________作负极,正极的电极反应式为___________。
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所产生的化学能转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,CO为燃料,采用NaOH溶液为电解液,则CO通入的电极反应式为___________。
(4)理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“”设计一个双液原电池,并在下面方框内画出双液原电池实验装置图,注明电极材料和电解质溶液等。___________
18.(本题12分)页岩气是从页岩层中开采的一种非常重要的天然气资源,页岩气的主要成分是甲烷,是公认的洁净能源。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和),与通入聚焦太阳能反应器,发生反应 。已知:
①
②
③
则___________(用含、、的代数式表示)
(2)用合成气生成甲醇的反应为 ,在10L恒容密闭容器中按物质的量之比1:2充入CO和,测得CO的平衡转化率与温度和压强的关系如图所示:
200℃时随时间的变化如下表所示:
t/min 0 1 3 5
8.0 5.4 4.0 4.0
①该反应的平衡常数表达式为___________;___________(填“>”“<”或“=”)0。
②写出一条可同时提高反应速率和CO转化率的措施:___________。
③下列说法正确的是___________(填字母)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强:
④0~1min内用表示的反应速率___________。
⑤向上述200℃达到平衡的恒容密闭容器中再加入2 mol CO、4 mol 、2 mol ,保持温度不变,则化学平衡___________(填“正向”“逆向”或“不”)移动。
19.(本题11分)滴定是分析化学中重要的分析方法之一,酸碱中和滴定是最基本的滴定方法。根据其原理回答下列问题:
(1)①滴定管在使用之前应进行的操作是_______;
②滴定时右手_______,眼睛应注意观察_______;
(2)食醋是日常饮食中的一种调味剂,国家标准规定酿造食醋中醋酸含量不得低于0.035 g/mL。选择酚酞作指示剂,用0.0250 mol/L的标准NaOH溶液可以测定食醋中醋酸的浓度,以检测白醋是否符合国家标准。某品牌白醋的醋酸浓度测定过程如下图所示。
回答下列问题:
①滴定达到终点时的现象是_______。
②某次实验滴定开始和结束时,碱式滴定管中的液面如图所示,则所用NaOH溶液的体积为_______mL。
③通过实验测得稀释后白醋的物质的量浓度为_______,则该白醋_______ (“符合”或“不符合”)国家标准。
④下列操作中,可能使所测白醋中醋酸的浓度数值偏低的是_______ (填编号)。
A.碱式滴定管未用标准NaOH溶液润洗就直接注入标准NaOH溶液
B.滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后没有干燥
C.滴定过程中振荡时有液滴溅出
D.读取NaOH溶液体积时,开始时仰视读数,滴定结束时俯视读数
E.碱式滴定管在滴定前有气泡,滴定后气泡消失
20.(本题11分)某矿渣的成分为主要有Cu2O、还有Al2O3、Fe2O3、SiO2等杂质,工业上用该矿渣获取铜和胆矾的操作流程如下:
已知:①Cu2O+2H+=Cu+Cu2++H2O。
②部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
沉淀物 Cu(OH)2 Al(OH)3 Fe(OH)3 Fe(OH)2
开始沉淀pH 5.4 4.0 2.7 5.8
沉淀完全pH 6.7 5.2 3.7 8.8
(1)为了加快反应Ⅰ的速率,可以采取的措施是___________(写两条)。
(2)固体混合物A中的成分是___________。
(3)反应Ⅰ完成后,铁元素的存在形式为___________(填离子符号);写出生成该离子的离子方程式___________。
(4)操作1主要包括:蒸发浓缩、冷却结晶、___________。
(5)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,利用题中所给信息分析沉淀B为___________, 该反应的离子方程式为______
第7页 共10页 ◎ 第8页 共10页
参考答案
1.C2.C3.D4.A5.D6.B7.A8.C9.B10.A11.C12.C13.D14.A15.D
16.(10分 除标注外均为1分)
< c(H+)=c(CH3COO-)+c(OH-)(2分) 碱 CH3COO-+H2OCH3COOH+OH-,(2分)ac (2分) > <
17.(10分 除标注外均为2分)
(1)60(2分)
(2) Cu
(3)
(4)
18.(12分 除标注外均为1分) (1)(2分)
(2) < 增大浓度(或增大压强) (2分) cd (2分) 0.13(2分) 正向 (2分)
19.(12分 除标注外均为1分))
(1) 检查是否漏液 摇动锥形瓶 锥形瓶内溶液颜色的变化
(2) 当滴入最后半滴标准 NaOH 溶液时,溶液颜色由无色刚好变为浅(粉)红色,且半分钟内不褪色 (2分) 26.10ml 0.0261mol/L(2分) 符合(2分) CD(2分)
20.(11分除标注外均为1分)
适当升高温度;不断搅拌;将矿渣粉碎;适当增大硫酸的浓度等(2分) SiO2、Cu(2分) Fe2+ 2Fe3++Cu=Cu2++2Fe2+ (2分) 过滤 Fe(OH)3 2Fe2++5ClO-+5H2O=2Fe(OH)3+Cl-+4HClO (2分)
同课章节目录
