2021年九年级化学人教版下册8.2金属的化学性质第一课时说课课件(共25张PPT)
文档属性
| 名称 | 2021年九年级化学人教版下册8.2金属的化学性质第一课时说课课件(共25张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 582.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-17 23:49:37 | ||
图片预览








文档简介
(共25张PPT)
8.2.1
金属的化学性质
Chemical properties of metals
初中化学人教版 九年级下册
第八单元 金属和金属材料 课题2
一、【教材分析】
本节教材介绍金属的化学性质,金属与氧气、酸和某些盐溶液的反应,总结概括出金属活动序。从整个初中化学内容体系上看,属于“身边的化学物质”。前面已经学习了氧气、水、二氧化碳(典型代表物)、酸、碱、盐(类别物质)等知识,本节一方面要系统认识.金属的化学性质,完善和建构初中元素化合物知识体系;另一方面要.通过实验探究、比较分析等方法认识金属化学性质差异的规律性一金属活动性顺序,以此发展学生认识一类物质化学性质的研究思路。在金属化学性质学习中,通过比较金属与酸或某些盐溶液反应的共同特点,归纳、概括得出置换反应的概念,从而完成了初中化学四大反应基本类型的学习。此内容学习不仅能帮助学生进一步建立分类观、体会分类价值,还能提高学生对化学反应本质的认识。
在学习本单元金属和金属材料之前,学生已对常见非金属氧气、碳单质及它们的化合物有了一定认识,对金属的性质和相关反应已有所涉及,如第二单元、第五单元已做过铁丝、镁条与氧气的实验,铁钉与硫酸铜溶液的实验;第五单元也做过镁条与盐酸,锌粒与稀硫酸的实验。
可通过本单元学习对金属的物理性质及用途、金属的化学性质及用途、金属资源及利用进行系统整合,也为后一阶段学习溶液、酸碱盐知识打下一定基础。
二、【学情分析】
三、【教学目标】
(1)知道铁、铝、铜等常见金属与氧气的反应。
(2)初步认识常见金属与盐酸、硫酸的置换反应,以及与盐溶液的置换反应,能用置换反应解释一些与日常生活有关的化学问题。
(3)能用金属活动性顺序对有关的置换反应进行简单地判断,并能利用金属活动性顺序解释一些与日常生活有关的化学问题。
知识与技能
三、【教学目标】
(1)认识科学探究的基本过程,能进行初步的探究活动。
(2)初步学会运用观察、实验等方法获取信息,并能用图表和化学语言表达有关的信息。
(3)初步学会运用比较、归纳、概括等方法对获取的信息进行加工。
过程与方法
(1)激发学习化学的兴趣。
(2)培养勤于思考、严谨求实、勇于实践的科学精神。
(3)了解化学与日常生活和生产的密切关系。
情感、态度与价值观
A
B
【教学重点】金属活动性顺序
【教学重点】对金属活动性顺序的初步探究
四、【教学重难点】
C
D
【教法】根据学生已有知识和经验,设置问题情境引入;以实验探究为突破口,引导学生分类研究、对比分析、总结规律;总结提高,练习巩固。
》问题情景→实验探究→得出结论→练习巩固→联系实际《
【学法】通过回忆镁、铝、铁与氧气的反应事实,总结不同金属与氧气的反应规律和活泼程度;
实验探究不同金属与稀酸、金属的化合物溶液能否反应及反应剧烈程度,通过观察、对比、分析、归纳,总结金属的活动性顺序和认识置换反应;学会运用图表、框架,归纳整合知识。
五、【教法-学法】
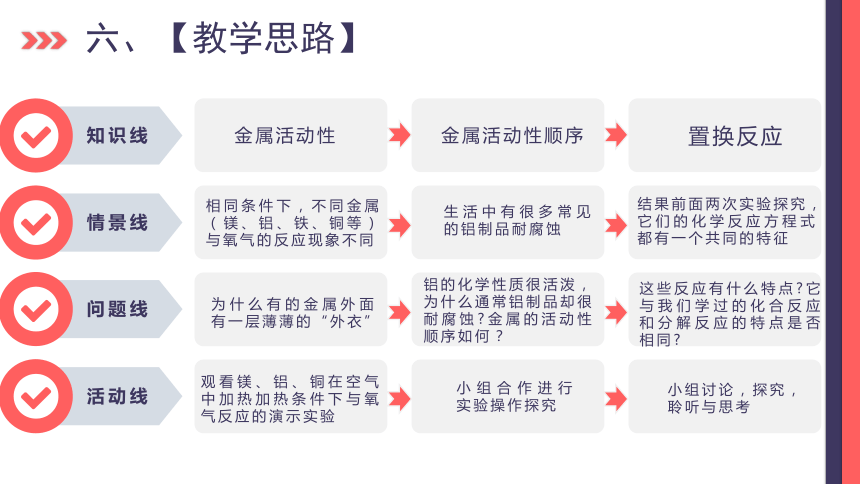
六、【教学思路】
知识线
情景线
问题线
活动线
金属活动性
金属活动性顺序
置换反应
相同条件下,不同金属(镁、铝、铁、铜等)与氧气的反应现象不同
生活中有很多常见的铝制品耐腐蚀
结果前面两次实验探究,它们的化学反应方程式都有一个共同的特征
为什么有的金属外面有一层薄薄的“外衣”
铝的化学性质很活泼,为什么通常铝制品却很耐腐蚀 金属的活动性顺序如何?
这些反应有什么特点 它与我们学过的化合反应和分解反应的特点是否相同
观看镁、铝、铜在空气中加热加热条件下与氧气反应的演示实验
小组合作进行实验操作探究
小组讨论,探究,聆听与思考
教师用具:
投影仪、镁条、铝片、铜片、被氧化了的镁条与铝片、酒精灯、坩埚钳、火柴、砂纸。
学生用具:
稀HCl、稀H2SO4、硝酸银溶液、硫酸铜溶液、硫酸铝溶液、铝丝、铜丝、镁条、锌粒、铜片、铁片、砂纸、火柴、试管(若干)。
七、【教具准备】
教学环节 教师活动 学生活动 设计意图
新课导入 [问题情景]黄铜(铜锌合金)与黄金的外观很相似,我们可用什么办法来鉴别它们呢 [小结]甲、乙两种方法利用的是金属的物理性质。丙方法利用的是金属的化学性质。 [引言]要想更好地使用金属,就需了解金属的各种性质。上节课我们学习了金属的物理性质,本节课我们来学习金属的化学性质。 [答]甲:黄铜与黄金的密度不同,测一下它们的密度即可区别。 乙:黄铜与黄金的硬度不同,把它们互相刻画,硬度大的为黄铜,小的为黄金。 丙:“真金不怕火炼”。用火烧一下,变黑的为黄铜,不变色的为黄金。 …… 从生活中常见的“铜”“金”设问引入,引起同学们思考,利用以往知识解决问题,并且引入今天的课题
八、【教学过程】
教学环节 教师活动 学生活动 设计意图
金属与氧气的反应 [展示被空气中的O2氧化了的镁条和铝片,并把其与砂纸打磨后的镁条与铝片相比较] [问]是谁给纯净的镁条和铝片穿上了“外衣”呢 [师]确切地讲,是空气中的氧气。 [生]是空气! 师生互动,引起同学思考互动,提升学习积极性
[过渡]如果我们把镁条、铝片、铜片分别在空气中加热,会有什么现象发生呢 [演示实验]分别把镁条、铝片、铜片用砂纸打磨后在空气中加热。 现象:镁条在空气中剧烈燃烧;铝片表面失去光泽;铜片表面变黑。 通过生动的实验演示视频,引发学生对实验探究的兴趣
[师]请大家写出以上反应的化学方程式。 [学生活动,请一位同学上黑板书写] [学生板书]2Mg+O2 =2MgO 4Al+3O2 =2Al2O3 2Cu+O2 =2CuO 学生通过自主思考,写出化学反应方程式,体会化学反应的过程
八、【教学过程】
教学环节 教师活动 学生活动 设计意图
金属与氧气的反应 [问]铁在纯氧中点燃能反应吗 若能,写出反应的化学方程式。 [问]根据上面的反应,我们可得出金属具有什么样的化学性质 [讲解]实验表明,大多数金属都能与氧气发生反应,但反应的难易和剧烈程度是不同的。如镁、铝等在常温下就能与氧气反应,铁、铜等在常温下几乎不与氧气反应,但在高温时能与氧气反应。“真金不怕火炼”说明金即使在高温时也不与氧气反应。根据上述事实,我们可判断出这些金属的活泼程度,即金属活动性。 [板书]活动性:Mg、Al>Fe、Cu>Au 学生小组讨论研究,提出设想 [学生活动,教师板书]3Fe+2O2 Fe3O4 [生]金属可与氧气发生化学反应。 通过对已有知识经验,进行设想,推理假设,体会化学探究的过程,构建化学知识体系
八、【教学过程】
教学环节 教师活动 学生活动 设计意图
金属与氧气的反应 [讲解]金属与氧气反应的性质除了可用于鉴别物质(如黄铜与黄金的鉴别)外,还有其他的一些用途。 【思考】铝的化学性质很活泼,为什么通常铝制品却很耐腐蚀 为什么不宜用钢刷、沙等来擦洗铝制品 [补充]我们平常所说的“电化铝”实际上就是用特殊方法使铝表面形成加厚的氧化铝保护层的铝制品。 [答案]铝制品耐腐蚀是由于铝可和空气中的氧气反应,使其表面形成一层致密的氧化铝保护膜之故;若用钢刷、沙等来擦洗铝制品,容易把氧化铝薄膜除掉,从而起不到保护作用。 学生通过讨论思考,理解明白氧化铝的特殊性,理解明白铝制品为什么耐腐蚀
[过渡]很多金属不仅能与氧气反应,而且还能与盐酸或稀硫酸反应。金属与盐酸或稀硫酸能否反应以及反应的剧烈程度,也可反映出金属的活泼程度。下面,我们就通过实验来比较镁、锌、铁、铜的活动性。
八、【教学过程】
教学环节 教师活动 学生活动 设计意图
金属活动性—活动与探究① 活动与探究 [投影展示活动与探究内容] (1)在试管里放入两小块镁,加入5 mL稀盐酸,用燃着的小木条放在试管口,观察现象,并判断反应后生成了什么气体。 (2)参照上述实验步骤,分别在放有两小块锌、铁或铜的试管中加入稀盐酸,观察现象,比较反应的剧烈程度。如果有气体生成,判断生成的是什么气体。 (3)用稀硫酸代替稀盐酸进行实验,并比较发生的现象。 [学生活动,教师巡视指导] 学生完成实验 学生根据以上实验,填写下表: 附件1 在老师的引导下,学生通过自主探究实验,切实观察实验现象,体会化学实验探究过程,使知识点掌握更牢固;并且有趣的化学实验可以增加学生的学习兴趣与学习积极性
八、【教学过程】
教学环节 教师活动 学生活动 设计意图
金属活动性—活动与探究① [请一位同学上黑板写出反应的化学方程式,现象可由学生口述] [问]通过以上实验,你得出的结论是什么 [注:教师此时可引导学生一起欣赏课本图8—13金属与盐酸反应的比较] [评价]大家回答得都很好。 [过渡]那么,我们还有没有其他的办法来证明不同金属活动性的相对强弱呢 答案是肯定的,那就是: [投影]活动性强的金属能把活动性弱的金属从它们的化合物中反应出来。 [生]甲:镁、锌、铁可与稀盐酸和稀硫酸反应生成H2,铜不能与稀盐酸或稀硫酸反应。 乙:与酸反应时,能生成H2的金属活动性强,否则,就较弱。 丙:镁、锌、铁与稀盐酸或稀硫酸反应时的剧烈程度不同。镁反应最剧烈,其次是锌,然后是铁。 丁:镁、锌、铁、铜的金属活动性由强到弱。 通过实验探究中观察到的实验现象进行解释、说明,理解实验原理与实验现象的关系,通过这种方式,理解金属活动性的具体表现
八、【教学过程】
教学环节 教师活动 学生活动 设计意图
金属活动性顺序-活动与探究② [过渡]下面,我们通过此结论来探究铝、铜、银三种金属的活动性顺序。
[投影] [活动与探究] 1. 把一根用砂纸打磨过的铝丝浸入硫酸铜溶液中,过一会儿取出,观察,有什么现象发生 2.把一根洁净的铜丝浸入硝酸银溶液中,过一会儿取出,观察,有什么现象发生 3.把另一根洁净的铜丝浸入硫酸铝溶液中,过一会儿取出,观察,有什么现象发生 学生完成实验 学生根据以上实验,填写下表: 附件2 再次通过探究实验,在前部分学习了金属活动性的基础上进一步通过实验验证之前的结论,并且进一步研究金属活动性顺序
八、【教学过程】
教学环节 教师活动 学生活动 设计意图
金属活动性顺序-活动与探究② [问]通过实验1.2. 3.你可分别得出什么结论 能否据此得出铝、铜、银的金属活动性顺序 [答]实验1说明铝的活动性弱于铜。 实验2说明铜的活动性强于银。 实验3说明铜的活动性弱于铝。 综合以上结论,可知铜、铝、银三种金属的活动性顺序为:铝>铜>银。 [板书]二、金属活动性顺序 K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au [答]实验1说明铝的活动性弱于铜。 实验2说明铜的活动性强于银。 实验3说明铜的活动性弱于铝。 综合以上结论,可知铜、铝、银三种金属的活动性顺序为:铝>铜>银。 同学们从实验现象中总结实验结论,掌握金属活动性顺序
八、【教学过程】
教学环节 教师活动 学生活动 设计意图
置换反应 [师]请大家从反应物和生成物的物质类别如单质、化合物的角度分析,这些反应有什么特点 它与我们学过的化合反应和分解反应的特点是否相同 [师]回答得很好。化学上,我们把具有这一特点的反应叫做置换反应。 [板书]三、置换反应 由一种单质与一种化合物反应。生成另一种单质与另一种化合物的反应叫做置换反应。 [讲解]金属活动性顺序可以作为金属能否在溶液中发生置换反应的一种判断依据。 [学生讨论后回答]这些反应的特点是:一种单质和一种化合物反应,生成另一种单质和另一种化合物。其特点不同于化合反应和分解反应。 从前部分完成的反应方程式中总结出其共同特点,研究得出结论,体会化学研究的过程,培养学生从多角度分析化学实验及结果
八、【教学过程】
教学环节 教师活动 学生活动 设计意图
金属活动性的研究用途 [投影] 金属活动性顺序在工农业生产和科学研究中有重要应用,它可以给你以下一些判断的依据: 1.在金属活动性顺序里,金属的位置越靠前,它的活动性就越强。 2.在金属活动性顺序里,位于氢前面的金属能置换出盐酸、稀硫酸中的氢。 3.在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。 化学源于生活,学习将化学知识总结应用到生活中去,掌握金属活动性顺序的用途、意义
八、【教学过程】
教学环节 教师活动 学生活动 设计意图
随堂练习 [投影练习]下列物质能否发生反应 写出能发生反应的化学方程式并判断它们是否为置换反应。 (1)银与稀盐酸 (2)锌与硫酸铜溶液 (3)铜与硫酸锌溶液 (4)铝与硝酸银溶液 思考题1:波尔多液是一种农业上常用的杀菌剂,它是由硫酸铜、石灰加水配制而成,为什么不能用铁制容器来配制波尔多液 思考题2:学完本课题后,你能否想出另外的办法来鉴别黄铜与黄金 [答案](1)(3)不反应;(2)(4)反应,且均为置换反应;方程式略。 思考题答案:1.因波尔多液中的硫酸铜要与铁反应:CuSO4+Fe====FeSO4+Cu,从而腐蚀铁制容器;2.可用稀盐酸来鉴别黄铜与黄金。因黄铜中含有锌,遇盐酸会有气体生成,而黄金则不与盐酸反应。 通过随堂练习以及思考题,进一步掌握本堂课所学习的知识点
八、【教学过程】
教学环节 教师活动 学生活动 设计意图
课堂小结 [小结]通过本课题的学习,我们知道了多数金属能与氧气反应,且不同金属的活动性各不相同,根据金属与酸或金属与另一种金属化合物的反应,可判断出金属活动性的相对强弱。同时,我们也认识了一种新的反应类型——置换反应。 [布置作业]习题3、4、6、8 *设计、观察与思考 铁在常温下几乎不与氧气反应,但在潮湿的空气中却易和空气中的氧气反应而生锈。现有洁净无锈的铁钉、试管、稀硫酸(或醋酸(亦可用食醋代替))、食盐水、经煮沸迅速冷却的蒸溜水、植物油、棉花和干燥剂氯化钙。试设计实验比较铁钉在不同环境中的锈蚀速度,以供我们在后面课题的学习中进行交流。 归纳本堂课的学习内容,布置课后习题供学生们进一步掌握知识点
八、【教学过程】
金属的化学性质
一、金属与氧气的反应
活动性:Mg、Al>Fe、Cu>Au
二、金属活动顺序表
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
三、置换反应
由一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应叫做置换反应。
九、【板书设计】
8.2.1
金属的化学性质
Chemical properties of metals
初中化学人教版 九年级下册
第八单元 金属和金属材料 课题2
感谢聆听
金属 现象 反应的化
稀盐酸 稀硫酸 稀盐酸 稀硫酸
镁 Mg+2HCl====MgCl2+H2↑ Mg+H2SO4====MgSO4+H2↑
锌 Zn+2HCl====ZnCl2+H2↑ Zn+H2SO4====ZnSO2+H2↑
铁 Fe+2HCl====FeCl2+H2↑ Fe+H2SO4====FeSO4+H2↑
铜
附件1 :表格
附件2 :表格
实验 现象 反应的化学方程式
铝丝浸入硫酸铜溶液中 溶液蓝色变浅,铝丝上附着一层红色固体 2Al+3CuSO4====Al2(SO4)3+3Cu
铜丝浸入硝酸银溶液中 铜丝上附有白色固体,溶液由无色变为蓝色 Cu+2AgNO3====Cu(NO3)2+2Ag
铜丝浸入硫酸铝溶液中 无明显现象
8.2.1
金属的化学性质
Chemical properties of metals
初中化学人教版 九年级下册
第八单元 金属和金属材料 课题2
一、【教材分析】
本节教材介绍金属的化学性质,金属与氧气、酸和某些盐溶液的反应,总结概括出金属活动序。从整个初中化学内容体系上看,属于“身边的化学物质”。前面已经学习了氧气、水、二氧化碳(典型代表物)、酸、碱、盐(类别物质)等知识,本节一方面要系统认识.金属的化学性质,完善和建构初中元素化合物知识体系;另一方面要.通过实验探究、比较分析等方法认识金属化学性质差异的规律性一金属活动性顺序,以此发展学生认识一类物质化学性质的研究思路。在金属化学性质学习中,通过比较金属与酸或某些盐溶液反应的共同特点,归纳、概括得出置换反应的概念,从而完成了初中化学四大反应基本类型的学习。此内容学习不仅能帮助学生进一步建立分类观、体会分类价值,还能提高学生对化学反应本质的认识。
在学习本单元金属和金属材料之前,学生已对常见非金属氧气、碳单质及它们的化合物有了一定认识,对金属的性质和相关反应已有所涉及,如第二单元、第五单元已做过铁丝、镁条与氧气的实验,铁钉与硫酸铜溶液的实验;第五单元也做过镁条与盐酸,锌粒与稀硫酸的实验。
可通过本单元学习对金属的物理性质及用途、金属的化学性质及用途、金属资源及利用进行系统整合,也为后一阶段学习溶液、酸碱盐知识打下一定基础。
二、【学情分析】
三、【教学目标】
(1)知道铁、铝、铜等常见金属与氧气的反应。
(2)初步认识常见金属与盐酸、硫酸的置换反应,以及与盐溶液的置换反应,能用置换反应解释一些与日常生活有关的化学问题。
(3)能用金属活动性顺序对有关的置换反应进行简单地判断,并能利用金属活动性顺序解释一些与日常生活有关的化学问题。
知识与技能
三、【教学目标】
(1)认识科学探究的基本过程,能进行初步的探究活动。
(2)初步学会运用观察、实验等方法获取信息,并能用图表和化学语言表达有关的信息。
(3)初步学会运用比较、归纳、概括等方法对获取的信息进行加工。
过程与方法
(1)激发学习化学的兴趣。
(2)培养勤于思考、严谨求实、勇于实践的科学精神。
(3)了解化学与日常生活和生产的密切关系。
情感、态度与价值观
A
B
【教学重点】金属活动性顺序
【教学重点】对金属活动性顺序的初步探究
四、【教学重难点】
C
D
【教法】根据学生已有知识和经验,设置问题情境引入;以实验探究为突破口,引导学生分类研究、对比分析、总结规律;总结提高,练习巩固。
》问题情景→实验探究→得出结论→练习巩固→联系实际《
【学法】通过回忆镁、铝、铁与氧气的反应事实,总结不同金属与氧气的反应规律和活泼程度;
实验探究不同金属与稀酸、金属的化合物溶液能否反应及反应剧烈程度,通过观察、对比、分析、归纳,总结金属的活动性顺序和认识置换反应;学会运用图表、框架,归纳整合知识。
五、【教法-学法】
六、【教学思路】
知识线
情景线
问题线
活动线
金属活动性
金属活动性顺序
置换反应
相同条件下,不同金属(镁、铝、铁、铜等)与氧气的反应现象不同
生活中有很多常见的铝制品耐腐蚀
结果前面两次实验探究,它们的化学反应方程式都有一个共同的特征
为什么有的金属外面有一层薄薄的“外衣”
铝的化学性质很活泼,为什么通常铝制品却很耐腐蚀 金属的活动性顺序如何?
这些反应有什么特点 它与我们学过的化合反应和分解反应的特点是否相同
观看镁、铝、铜在空气中加热加热条件下与氧气反应的演示实验
小组合作进行实验操作探究
小组讨论,探究,聆听与思考
教师用具:
投影仪、镁条、铝片、铜片、被氧化了的镁条与铝片、酒精灯、坩埚钳、火柴、砂纸。
学生用具:
稀HCl、稀H2SO4、硝酸银溶液、硫酸铜溶液、硫酸铝溶液、铝丝、铜丝、镁条、锌粒、铜片、铁片、砂纸、火柴、试管(若干)。
七、【教具准备】
教学环节 教师活动 学生活动 设计意图
新课导入 [问题情景]黄铜(铜锌合金)与黄金的外观很相似,我们可用什么办法来鉴别它们呢 [小结]甲、乙两种方法利用的是金属的物理性质。丙方法利用的是金属的化学性质。 [引言]要想更好地使用金属,就需了解金属的各种性质。上节课我们学习了金属的物理性质,本节课我们来学习金属的化学性质。 [答]甲:黄铜与黄金的密度不同,测一下它们的密度即可区别。 乙:黄铜与黄金的硬度不同,把它们互相刻画,硬度大的为黄铜,小的为黄金。 丙:“真金不怕火炼”。用火烧一下,变黑的为黄铜,不变色的为黄金。 …… 从生活中常见的“铜”“金”设问引入,引起同学们思考,利用以往知识解决问题,并且引入今天的课题
八、【教学过程】
教学环节 教师活动 学生活动 设计意图
金属与氧气的反应 [展示被空气中的O2氧化了的镁条和铝片,并把其与砂纸打磨后的镁条与铝片相比较] [问]是谁给纯净的镁条和铝片穿上了“外衣”呢 [师]确切地讲,是空气中的氧气。 [生]是空气! 师生互动,引起同学思考互动,提升学习积极性
[过渡]如果我们把镁条、铝片、铜片分别在空气中加热,会有什么现象发生呢 [演示实验]分别把镁条、铝片、铜片用砂纸打磨后在空气中加热。 现象:镁条在空气中剧烈燃烧;铝片表面失去光泽;铜片表面变黑。 通过生动的实验演示视频,引发学生对实验探究的兴趣
[师]请大家写出以上反应的化学方程式。 [学生活动,请一位同学上黑板书写] [学生板书]2Mg+O2 =2MgO 4Al+3O2 =2Al2O3 2Cu+O2 =2CuO 学生通过自主思考,写出化学反应方程式,体会化学反应的过程
八、【教学过程】
教学环节 教师活动 学生活动 设计意图
金属与氧气的反应 [问]铁在纯氧中点燃能反应吗 若能,写出反应的化学方程式。 [问]根据上面的反应,我们可得出金属具有什么样的化学性质 [讲解]实验表明,大多数金属都能与氧气发生反应,但反应的难易和剧烈程度是不同的。如镁、铝等在常温下就能与氧气反应,铁、铜等在常温下几乎不与氧气反应,但在高温时能与氧气反应。“真金不怕火炼”说明金即使在高温时也不与氧气反应。根据上述事实,我们可判断出这些金属的活泼程度,即金属活动性。 [板书]活动性:Mg、Al>Fe、Cu>Au 学生小组讨论研究,提出设想 [学生活动,教师板书]3Fe+2O2 Fe3O4 [生]金属可与氧气发生化学反应。 通过对已有知识经验,进行设想,推理假设,体会化学探究的过程,构建化学知识体系
八、【教学过程】
教学环节 教师活动 学生活动 设计意图
金属与氧气的反应 [讲解]金属与氧气反应的性质除了可用于鉴别物质(如黄铜与黄金的鉴别)外,还有其他的一些用途。 【思考】铝的化学性质很活泼,为什么通常铝制品却很耐腐蚀 为什么不宜用钢刷、沙等来擦洗铝制品 [补充]我们平常所说的“电化铝”实际上就是用特殊方法使铝表面形成加厚的氧化铝保护层的铝制品。 [答案]铝制品耐腐蚀是由于铝可和空气中的氧气反应,使其表面形成一层致密的氧化铝保护膜之故;若用钢刷、沙等来擦洗铝制品,容易把氧化铝薄膜除掉,从而起不到保护作用。 学生通过讨论思考,理解明白氧化铝的特殊性,理解明白铝制品为什么耐腐蚀
[过渡]很多金属不仅能与氧气反应,而且还能与盐酸或稀硫酸反应。金属与盐酸或稀硫酸能否反应以及反应的剧烈程度,也可反映出金属的活泼程度。下面,我们就通过实验来比较镁、锌、铁、铜的活动性。
八、【教学过程】
教学环节 教师活动 学生活动 设计意图
金属活动性—活动与探究① 活动与探究 [投影展示活动与探究内容] (1)在试管里放入两小块镁,加入5 mL稀盐酸,用燃着的小木条放在试管口,观察现象,并判断反应后生成了什么气体。 (2)参照上述实验步骤,分别在放有两小块锌、铁或铜的试管中加入稀盐酸,观察现象,比较反应的剧烈程度。如果有气体生成,判断生成的是什么气体。 (3)用稀硫酸代替稀盐酸进行实验,并比较发生的现象。 [学生活动,教师巡视指导] 学生完成实验 学生根据以上实验,填写下表: 附件1 在老师的引导下,学生通过自主探究实验,切实观察实验现象,体会化学实验探究过程,使知识点掌握更牢固;并且有趣的化学实验可以增加学生的学习兴趣与学习积极性
八、【教学过程】
教学环节 教师活动 学生活动 设计意图
金属活动性—活动与探究① [请一位同学上黑板写出反应的化学方程式,现象可由学生口述] [问]通过以上实验,你得出的结论是什么 [注:教师此时可引导学生一起欣赏课本图8—13金属与盐酸反应的比较] [评价]大家回答得都很好。 [过渡]那么,我们还有没有其他的办法来证明不同金属活动性的相对强弱呢 答案是肯定的,那就是: [投影]活动性强的金属能把活动性弱的金属从它们的化合物中反应出来。 [生]甲:镁、锌、铁可与稀盐酸和稀硫酸反应生成H2,铜不能与稀盐酸或稀硫酸反应。 乙:与酸反应时,能生成H2的金属活动性强,否则,就较弱。 丙:镁、锌、铁与稀盐酸或稀硫酸反应时的剧烈程度不同。镁反应最剧烈,其次是锌,然后是铁。 丁:镁、锌、铁、铜的金属活动性由强到弱。 通过实验探究中观察到的实验现象进行解释、说明,理解实验原理与实验现象的关系,通过这种方式,理解金属活动性的具体表现
八、【教学过程】
教学环节 教师活动 学生活动 设计意图
金属活动性顺序-活动与探究② [过渡]下面,我们通过此结论来探究铝、铜、银三种金属的活动性顺序。
[投影] [活动与探究] 1. 把一根用砂纸打磨过的铝丝浸入硫酸铜溶液中,过一会儿取出,观察,有什么现象发生 2.把一根洁净的铜丝浸入硝酸银溶液中,过一会儿取出,观察,有什么现象发生 3.把另一根洁净的铜丝浸入硫酸铝溶液中,过一会儿取出,观察,有什么现象发生 学生完成实验 学生根据以上实验,填写下表: 附件2 再次通过探究实验,在前部分学习了金属活动性的基础上进一步通过实验验证之前的结论,并且进一步研究金属活动性顺序
八、【教学过程】
教学环节 教师活动 学生活动 设计意图
金属活动性顺序-活动与探究② [问]通过实验1.2. 3.你可分别得出什么结论 能否据此得出铝、铜、银的金属活动性顺序 [答]实验1说明铝的活动性弱于铜。 实验2说明铜的活动性强于银。 实验3说明铜的活动性弱于铝。 综合以上结论,可知铜、铝、银三种金属的活动性顺序为:铝>铜>银。 [板书]二、金属活动性顺序 K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au [答]实验1说明铝的活动性弱于铜。 实验2说明铜的活动性强于银。 实验3说明铜的活动性弱于铝。 综合以上结论,可知铜、铝、银三种金属的活动性顺序为:铝>铜>银。 同学们从实验现象中总结实验结论,掌握金属活动性顺序
八、【教学过程】
教学环节 教师活动 学生活动 设计意图
置换反应 [师]请大家从反应物和生成物的物质类别如单质、化合物的角度分析,这些反应有什么特点 它与我们学过的化合反应和分解反应的特点是否相同 [师]回答得很好。化学上,我们把具有这一特点的反应叫做置换反应。 [板书]三、置换反应 由一种单质与一种化合物反应。生成另一种单质与另一种化合物的反应叫做置换反应。 [讲解]金属活动性顺序可以作为金属能否在溶液中发生置换反应的一种判断依据。 [学生讨论后回答]这些反应的特点是:一种单质和一种化合物反应,生成另一种单质和另一种化合物。其特点不同于化合反应和分解反应。 从前部分完成的反应方程式中总结出其共同特点,研究得出结论,体会化学研究的过程,培养学生从多角度分析化学实验及结果
八、【教学过程】
教学环节 教师活动 学生活动 设计意图
金属活动性的研究用途 [投影] 金属活动性顺序在工农业生产和科学研究中有重要应用,它可以给你以下一些判断的依据: 1.在金属活动性顺序里,金属的位置越靠前,它的活动性就越强。 2.在金属活动性顺序里,位于氢前面的金属能置换出盐酸、稀硫酸中的氢。 3.在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。 化学源于生活,学习将化学知识总结应用到生活中去,掌握金属活动性顺序的用途、意义
八、【教学过程】
教学环节 教师活动 学生活动 设计意图
随堂练习 [投影练习]下列物质能否发生反应 写出能发生反应的化学方程式并判断它们是否为置换反应。 (1)银与稀盐酸 (2)锌与硫酸铜溶液 (3)铜与硫酸锌溶液 (4)铝与硝酸银溶液 思考题1:波尔多液是一种农业上常用的杀菌剂,它是由硫酸铜、石灰加水配制而成,为什么不能用铁制容器来配制波尔多液 思考题2:学完本课题后,你能否想出另外的办法来鉴别黄铜与黄金 [答案](1)(3)不反应;(2)(4)反应,且均为置换反应;方程式略。 思考题答案:1.因波尔多液中的硫酸铜要与铁反应:CuSO4+Fe====FeSO4+Cu,从而腐蚀铁制容器;2.可用稀盐酸来鉴别黄铜与黄金。因黄铜中含有锌,遇盐酸会有气体生成,而黄金则不与盐酸反应。 通过随堂练习以及思考题,进一步掌握本堂课所学习的知识点
八、【教学过程】
教学环节 教师活动 学生活动 设计意图
课堂小结 [小结]通过本课题的学习,我们知道了多数金属能与氧气反应,且不同金属的活动性各不相同,根据金属与酸或金属与另一种金属化合物的反应,可判断出金属活动性的相对强弱。同时,我们也认识了一种新的反应类型——置换反应。 [布置作业]习题3、4、6、8 *设计、观察与思考 铁在常温下几乎不与氧气反应,但在潮湿的空气中却易和空气中的氧气反应而生锈。现有洁净无锈的铁钉、试管、稀硫酸(或醋酸(亦可用食醋代替))、食盐水、经煮沸迅速冷却的蒸溜水、植物油、棉花和干燥剂氯化钙。试设计实验比较铁钉在不同环境中的锈蚀速度,以供我们在后面课题的学习中进行交流。 归纳本堂课的学习内容,布置课后习题供学生们进一步掌握知识点
八、【教学过程】
金属的化学性质
一、金属与氧气的反应
活动性:Mg、Al>Fe、Cu>Au
二、金属活动顺序表
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
三、置换反应
由一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应叫做置换反应。
九、【板书设计】
8.2.1
金属的化学性质
Chemical properties of metals
初中化学人教版 九年级下册
第八单元 金属和金属材料 课题2
感谢聆听
金属 现象 反应的化
稀盐酸 稀硫酸 稀盐酸 稀硫酸
镁 Mg+2HCl====MgCl2+H2↑ Mg+H2SO4====MgSO4+H2↑
锌 Zn+2HCl====ZnCl2+H2↑ Zn+H2SO4====ZnSO2+H2↑
铁 Fe+2HCl====FeCl2+H2↑ Fe+H2SO4====FeSO4+H2↑
铜
附件1 :表格
附件2 :表格
实验 现象 反应的化学方程式
铝丝浸入硫酸铜溶液中 溶液蓝色变浅,铝丝上附着一层红色固体 2Al+3CuSO4====Al2(SO4)3+3Cu
铜丝浸入硝酸银溶液中 铜丝上附有白色固体,溶液由无色变为蓝色 Cu+2AgNO3====Cu(NO3)2+2Ag
铜丝浸入硫酸铝溶液中 无明显现象
同课章节目录
