2013高一化学人教版必修一课件第三章 第二节 第一课时 钠的重要化合物
文档属性
| 名称 | 2013高一化学人教版必修一课件第三章 第二节 第一课时 钠的重要化合物 | 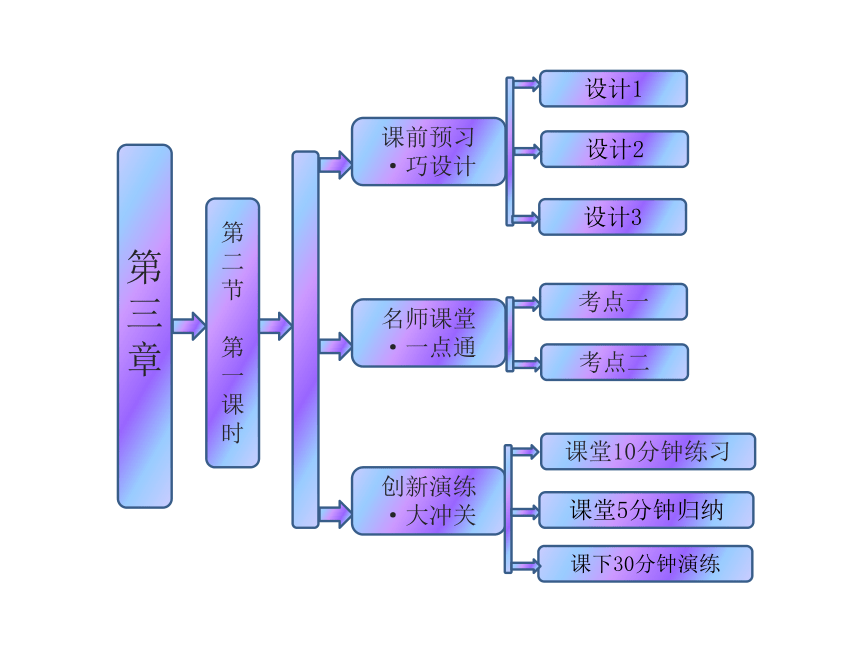 | |
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-10-24 11:22:54 | ||
图片预览









文档简介
课件43张PPT。第三章
第二节
第一课时 课前预习
·巧设计名师课堂
·一点通考点一创新演练
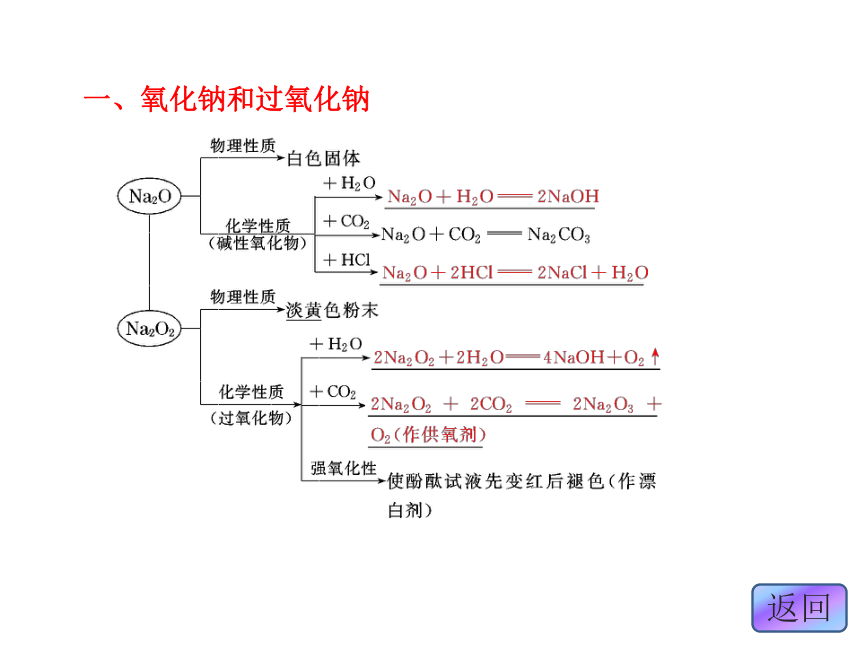
·大冲关设计1设计2考点二设计3课下30分钟演练课堂10分钟练习课堂5分钟归纳第二节 几种重要的金属化合物第一课时 钠的重要化合物Na2ONaOHNa2CO3+1-2-1。NaOH+CO2===NaHCO3 一、氧化钠和过氧化钠二、碳酸钠和碳酸氢钠
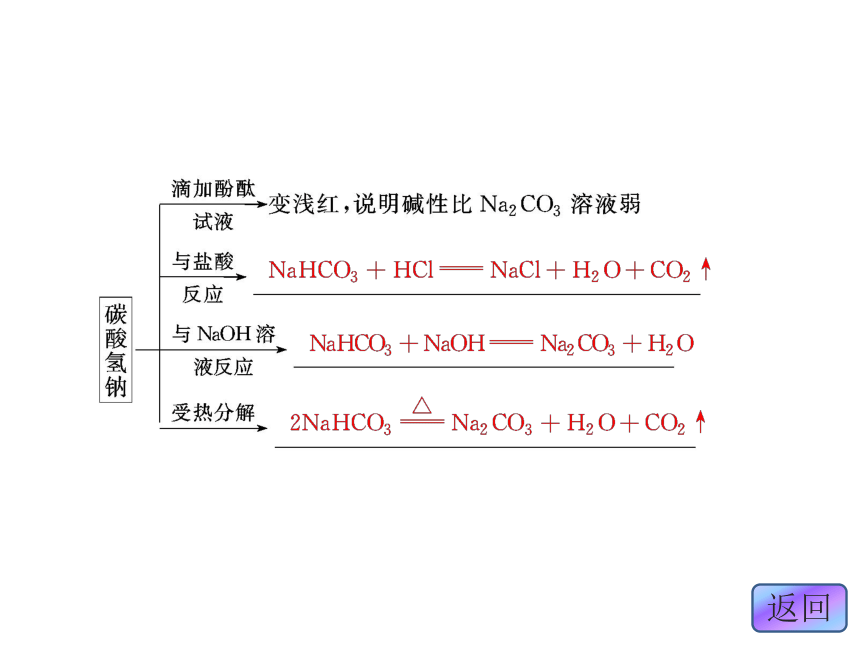
1.物理性质Na2CO3NaHCO3纯碱 苏打小苏打易溶小2.化学性质 三、焰色反应
1.定义
很多金属或它们的化合物在灼烧时都会使火焰呈现
。 特殊的颜色2.操作 3.几种金属元素的焰色
钠: 色,钾: 色(观察时要透过 ),铜:绿色。 黄紫蓝色钴玻璃1.将下列物质与其用途连线。
①Na2CO3 A.供氧剂
②Na2O2 B.食用碱
③NaHCO3 C.食盐
④NaOH D.工业用碱
⑤NaCl E.治疗胃酸过多
答案:①-B,②-A,③-BE,④-D,⑤-C2.Na2O与Na2O2都能与水反应生成NaOH,所以Na2O
与Na2O2都是碱性氧化物,你同意这种观点吗?
答案:不同意。Na2O2不是碱性氧化物,碱性氧化物指能与酸反应只生成盐和水的氧化物,Na2O2与盐酸反应时不仅生成NaCl和水,还会有氧气生成,故不属于碱性氧化物。3.能否用澄清石灰水来鉴别Na2CO3和NaHCO3溶液?
答案:不能,因为二者均能与石灰水反应产生白色沉淀,反应的化学方程式分别为:
Na2CO3+Ca(OH)2===CaCO3↓+2NaOH
2NaHCO3+Ca(OH)2===CaCO3↓+Na2CO3+2H2O4.判断正误(正确的打“√”,错误的打“×”号)。
(1)Na2O和Na2O2中的氧元素都是-2价 ( )
(2)CaCO3的溶解度小于Ca(HCO3)2的溶解度,则Na2CO3溶液度小于NaHCO3的溶解度 ( )
(3)Na2CO3不与NaOH反应,则Na2CO3与Ca(OH)2也不能反应 ( )
(4)焰色反应属于化学变化 ( )
答案:(1)× (2)× (3)× (4)×关于Na2O2与CO2、H2O的反应 2.三个关系
(1)固体质量关系:
①与CO2的反应:
2CO2+2Na2O2===2Na2CO3+O2 固体的质量差
2×44 g 32 g 88 g-32 g=56 g(2×28)
结论:Na2O2固体与CO2反应时,固体增加的质量等于与参加反应的CO2等物质的量的CO的质量,即Na2O2+CO===Na2CO3(实际上该反应不能发生)。 ②与H2O的反应:
2H2O+2Na2O2===4NaOH+O2↑ 固体的质量差
2×18 g 32 g 36 g-32 g=4 g(2×2)
结论:Na2O2固体与H2O反应时,固体增加的质量等
于与参加反应的H2O等物质的量的H2的质量,即Na2O2+H2===2NaOH(实际上该反应不能发生)。 (2)气体体积关系:
①与CO2的反应:
2CO2+2Na2O2===2Na2CO3+O2 气体的体积差
2 L 1 L2 L-1 L=1 L
②与H2O的反应:
2H2O(g)+2Na2O2===4NaOH+O2 气体的体积差
2 L 1 L 2 L-1 L=1 L 结论:若CO2和水蒸气(或二者的混合气体)通过足量的Na2O2,气体体积的减少量为原气体(或混合气体)体积的一半,即为生成氧气的量。
(3)电子转移关系:
当Na2O2与足量CO2、H2O反应时,1 mol Na2O2转移1 mol电子。 [例1] 200℃时CO2和水蒸气的混合气体共23.2 g与足量的Na2O2充分反应后,固体质量增加了7.2 g,则原混合气体的物质的量为 ( )
A.0.2 mol B.0.6 mol
C.0.8 mol D.1.0 mol [解析] 设混合气体中CO2、H2O的物质的量分别为x、y。
2CO2+2Na2O2===2Na2CO3+O2 固体的质量差
2 mol 88 g-32 g=56 g
x 28 x
2H2O(g)+2Na2O2===4NaOH+O2 固体的质量差
2 mol 36 g-32 g=4 g
y 2y 则:44x+18y=23.2 28x+2y=7.2
解得:x=0.2 mol y=0.8 mol
所以混合气体的总物质的量为0.2 mol+0.8 mol=1.0 mol。
[答案] D
一定量的Na2O2与一定量CO2和H2O(g)的混合物的反应,可视作Na2O2先与CO2反应,待CO2反应完全后,Na2O2再与H2O(g)发生反应。Na2CO3与NaHCO3的鉴别、除杂与转化1.鉴别2.除杂(括号内为杂质)3.转化
[例2] 有两试管分别装有Na2CO3和NaHCO3溶液,下列操作或判断正确的是 ( ) [解析] A项中发生的反应分别为:Na2CO3+Ca(OH)2===CaCO3↓+2NaOH,2NaHCO3+Ca(OH)2===CaCO3↓+Na2CO3+2H2O,两者现象相同(产生白色沉淀);B项滴加等浓度的稀盐酸时NaHCO3溶液反应更剧烈;C项Na2CO3与CaCl2发生反应:Na2CO3+CaCl2===CaCO3↓+2NaCl,产生白色沉淀,NaHCO3与CaCl2不反应;D项逐滴加入盐酸时,NaHCO3立即产生气泡,Na2CO3开始无气泡产生,过一会儿才产生气泡。
[答案] C 点击下图进入 (1)Na2O2为淡黄色固体,能与CO2、H2O反应放出O2,可作供氧剂。反应方程式为:2Na2O2+2CO2===2Na2CO3+O2,2Na2O2+2H2O===4NaOH+O2↑。
(2)Na2CO3俗名纯碱、苏打,NaHCO3俗名小苏打,二
者水溶液均呈碱性,均能与酸反应。点击下图进入
第二节
第一课时 课前预习
·巧设计名师课堂
·一点通考点一创新演练
·大冲关设计1设计2考点二设计3课下30分钟演练课堂10分钟练习课堂5分钟归纳第二节 几种重要的金属化合物第一课时 钠的重要化合物Na2ONaOHNa2CO3+1-2-1。NaOH+CO2===NaHCO3 一、氧化钠和过氧化钠二、碳酸钠和碳酸氢钠
1.物理性质Na2CO3NaHCO3纯碱 苏打小苏打易溶小2.化学性质 三、焰色反应
1.定义
很多金属或它们的化合物在灼烧时都会使火焰呈现
。 特殊的颜色2.操作 3.几种金属元素的焰色
钠: 色,钾: 色(观察时要透过 ),铜:绿色。 黄紫蓝色钴玻璃1.将下列物质与其用途连线。
①Na2CO3 A.供氧剂
②Na2O2 B.食用碱
③NaHCO3 C.食盐
④NaOH D.工业用碱
⑤NaCl E.治疗胃酸过多
答案:①-B,②-A,③-BE,④-D,⑤-C2.Na2O与Na2O2都能与水反应生成NaOH,所以Na2O
与Na2O2都是碱性氧化物,你同意这种观点吗?
答案:不同意。Na2O2不是碱性氧化物,碱性氧化物指能与酸反应只生成盐和水的氧化物,Na2O2与盐酸反应时不仅生成NaCl和水,还会有氧气生成,故不属于碱性氧化物。3.能否用澄清石灰水来鉴别Na2CO3和NaHCO3溶液?
答案:不能,因为二者均能与石灰水反应产生白色沉淀,反应的化学方程式分别为:
Na2CO3+Ca(OH)2===CaCO3↓+2NaOH
2NaHCO3+Ca(OH)2===CaCO3↓+Na2CO3+2H2O4.判断正误(正确的打“√”,错误的打“×”号)。
(1)Na2O和Na2O2中的氧元素都是-2价 ( )
(2)CaCO3的溶解度小于Ca(HCO3)2的溶解度,则Na2CO3溶液度小于NaHCO3的溶解度 ( )
(3)Na2CO3不与NaOH反应,则Na2CO3与Ca(OH)2也不能反应 ( )
(4)焰色反应属于化学变化 ( )
答案:(1)× (2)× (3)× (4)×关于Na2O2与CO2、H2O的反应 2.三个关系
(1)固体质量关系:
①与CO2的反应:
2CO2+2Na2O2===2Na2CO3+O2 固体的质量差
2×44 g 32 g 88 g-32 g=56 g(2×28)
结论:Na2O2固体与CO2反应时,固体增加的质量等于与参加反应的CO2等物质的量的CO的质量,即Na2O2+CO===Na2CO3(实际上该反应不能发生)。 ②与H2O的反应:
2H2O+2Na2O2===4NaOH+O2↑ 固体的质量差
2×18 g 32 g 36 g-32 g=4 g(2×2)
结论:Na2O2固体与H2O反应时,固体增加的质量等
于与参加反应的H2O等物质的量的H2的质量,即Na2O2+H2===2NaOH(实际上该反应不能发生)。 (2)气体体积关系:
①与CO2的反应:
2CO2+2Na2O2===2Na2CO3+O2 气体的体积差
2 L 1 L2 L-1 L=1 L
②与H2O的反应:
2H2O(g)+2Na2O2===4NaOH+O2 气体的体积差
2 L 1 L 2 L-1 L=1 L 结论:若CO2和水蒸气(或二者的混合气体)通过足量的Na2O2,气体体积的减少量为原气体(或混合气体)体积的一半,即为生成氧气的量。
(3)电子转移关系:
当Na2O2与足量CO2、H2O反应时,1 mol Na2O2转移1 mol电子。 [例1] 200℃时CO2和水蒸气的混合气体共23.2 g与足量的Na2O2充分反应后,固体质量增加了7.2 g,则原混合气体的物质的量为 ( )
A.0.2 mol B.0.6 mol
C.0.8 mol D.1.0 mol [解析] 设混合气体中CO2、H2O的物质的量分别为x、y。
2CO2+2Na2O2===2Na2CO3+O2 固体的质量差
2 mol 88 g-32 g=56 g
x 28 x
2H2O(g)+2Na2O2===4NaOH+O2 固体的质量差
2 mol 36 g-32 g=4 g
y 2y 则:44x+18y=23.2 28x+2y=7.2
解得:x=0.2 mol y=0.8 mol
所以混合气体的总物质的量为0.2 mol+0.8 mol=1.0 mol。
[答案] D
一定量的Na2O2与一定量CO2和H2O(g)的混合物的反应,可视作Na2O2先与CO2反应,待CO2反应完全后,Na2O2再与H2O(g)发生反应。Na2CO3与NaHCO3的鉴别、除杂与转化1.鉴别2.除杂(括号内为杂质)3.转化
[例2] 有两试管分别装有Na2CO3和NaHCO3溶液,下列操作或判断正确的是 ( ) [解析] A项中发生的反应分别为:Na2CO3+Ca(OH)2===CaCO3↓+2NaOH,2NaHCO3+Ca(OH)2===CaCO3↓+Na2CO3+2H2O,两者现象相同(产生白色沉淀);B项滴加等浓度的稀盐酸时NaHCO3溶液反应更剧烈;C项Na2CO3与CaCl2发生反应:Na2CO3+CaCl2===CaCO3↓+2NaCl,产生白色沉淀,NaHCO3与CaCl2不反应;D项逐滴加入盐酸时,NaHCO3立即产生气泡,Na2CO3开始无气泡产生,过一会儿才产生气泡。
[答案] C 点击下图进入 (1)Na2O2为淡黄色固体,能与CO2、H2O反应放出O2,可作供氧剂。反应方程式为:2Na2O2+2CO2===2Na2CO3+O2,2Na2O2+2H2O===4NaOH+O2↑。
(2)Na2CO3俗名纯碱、苏打,NaHCO3俗名小苏打,二
者水溶液均呈碱性,均能与酸反应。点击下图进入
