2013高一化学人教版必修一课件第三章 第二节 第二课时 铝的重要化合物
文档属性
| 名称 | 2013高一化学人教版必修一课件第三章 第二节 第二课时 铝的重要化合物 |  | |
| 格式 | zip | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-10-24 11:23:45 | ||
图片预览










文档简介
课件38张PPT。第三章
第二节
第二课时 课前预习
·巧设计名师课堂
·一点通考点一创新演练
·大冲关设计1设计2考点二设计3课下30分钟演练课堂10分钟练习课堂5分钟归纳第二节 几种重要的金属化合物第二课时 铝的重要化合物 (1)Fe2O3是 氧化物,与盐酸反应生成盐和水,离子方程式是 。
(2)CO2是 氧化物,与足量NaOH反应生成盐和水,离子方程式是CO2+2OH-===CO +H2O。
(3)氯化铝溶液与氨水反应的离子方程式为
。
(4)Al(OH)3溶于盐酸的离子方程式为
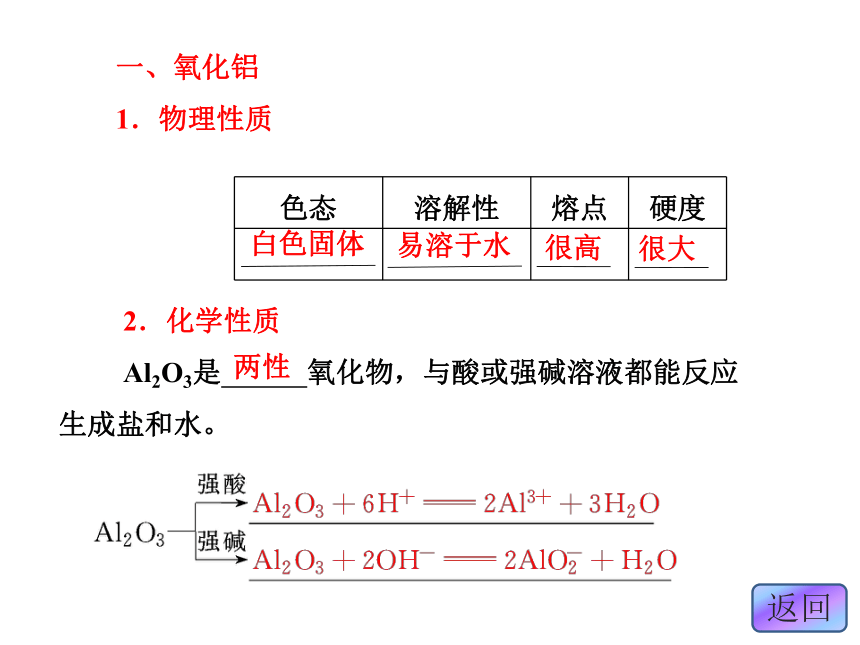
。碱性Fe2O3+6H+===2Fe3++3H2O酸性Al(OH)3+3H+===Al3++3H2O一、氧化铝
1.物理性质白色固体
易溶于水很高很大? 2.化学性质
Al2O3是 氧化物,与酸或强碱溶液都能反应生成盐和水。两性3.用途
(1)冶炼金属铝的原料;
(2)良好的耐火材料。
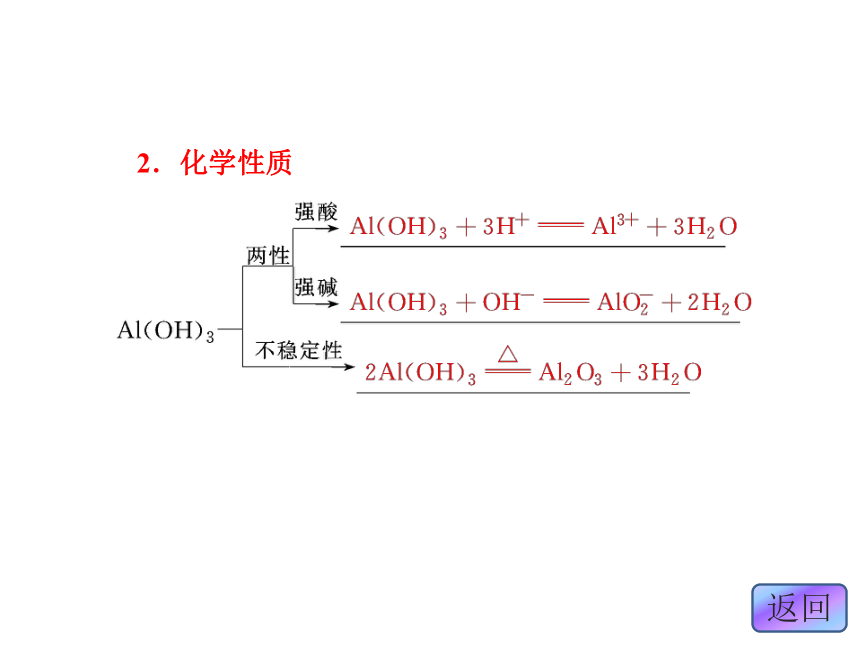
二、氢氧化铝
1.物理性质
(1)色态:白色固体。
(2)溶解性:难溶于水。2.化学性质 3.制备
实验室常用可溶性铝盐Al2(SO4)3与氨水反应制取Al(OH)3。
(1)离子方程式为: 。
(2)现象: ,氨水过量时,
。
4.用途
(1)能凝聚水中的悬浮物并能吸附色素,可用来净水。
(2)利用其 性,可用作胃酸中和剂。 有白色胶状沉淀产生沉淀不溶解弱碱Al3++3NH3·H2O===Al(OH)3↓+3NH+4三、硫酸铝钾[KAl(SO4)2]
(1)电离方程式: 。
(2)明矾:1.判断正误(正确的打“√”号,错误的打“×”号)。
(1)Al2O3含有金属元素,是一种碱性氧化物 ( )
(2)Al2O3能溶于任何酸碱溶液 ( )
(3)Al(OH)3可溶于过量的氨水 ( )
(4)氢氧化铝能中和胃酸,可用于制胃药 ( )
(5)明矾的化学式为KAlSO4·12H2O ( )
答案:(1)× (2)× (3)× (4)√ (5)×2.下列关于Al(OH)3的性质叙述错误的是 ( )
A.Al(OH)3是两性氢氧化物
B.Al(OH)3是难溶于水的白色胶状物质
C.Al(OH)3能凝聚水中悬浮物,也能吸附色素
D.Al(OH)3既溶于NaOH溶液、氨水,又能溶于盐酸
解析:Al(OH)3能溶于强酸、强碱溶液,不溶于弱碱
溶液。
答案:D3.连线找用途。
①Al A.治疗胃酸过多
②明矾、AlCl3 B.门窗合金、飞机材料
③Al(OH)3 C.耐火材料
④Al2O3 D.净水剂
答案:①-B,②-D,③-A,④-C4.思考:
(1)医用胃酸中和剂用Al(OH)3,为什么不用NaOH?
(2)实验室常用Al2(SO4)3与氨水反应制备Al(OH)3,为什么不使用NaOH溶液?
答案:(1)NaOH碱性太强,对人体有腐蚀作用,且与酸反应过于剧烈,对人体有极大危害。
(2)NaOH过量会继续与Al(OH)3反应生成NaAlO2,故不用NaOH。铝的化合物之间的相互转化——铝三角 [例1] 已知单质A、B、C和甲、乙、丙、丁四种化合物有如图的转化关系,C为密度最小的气体,甲是一种高熔点的物质,丙常温下是一种液体。根据以上转化关系回答:
(1)写出下列物质的化学式:
A________;B________;乙________。
(2)A原子的原子结构示意图为________。
(3)写出下列变化的方程式:
①A与NaOH溶液反应的化学方程式___________________
__________________________________________________。
②甲与NaOH溶液反应的离子方程式__________________
__________________________________________________。 [解析] 本题主要考查铝的化合物之间的相互转化关系,从物质A作为突破口,A与NaOH反应放出H2,判断A是Al;由C+B→水,判断B为O2;由A+B→甲,判断甲为Al2O3;其余则容易判断:乙为NaAlO2,丁为Al(OH)3。关于Al(OH)3沉淀的图像分析 [例2] 向MgSO4和Al2(SO4)3的混合溶液中逐滴加入NaOH溶液至过量。下列图像中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量) ( ) [解析] 上述过程中发生的反应为MgSO4+2NaOH===Mg(OH)2↓+Na2SO4,Al2(SO4)3+6NaOH===2Al(OH)3↓+3Na2SO4,当NaOH过量时Al(OH)3+NaOH===NaAlO2+2H2O,所以开始时沉淀逐渐增多,达到最大值后,Al(OH)3被溶解,沉淀量逐渐减少,因为Mg(OH)2不溶于NaOH溶液,所以最后沉淀不完全消失。D项正确。
[答案] D 解答图像计算题,必须抓住有关化学原理和有关物质的性质,结合图像的特点,综合分析逐步计算求解,其关键是抓住图像四点(原点、交点、转折点、终点),数形结合,分析计算。点击下图进入点击下图进入
第二节
第二课时 课前预习
·巧设计名师课堂
·一点通考点一创新演练
·大冲关设计1设计2考点二设计3课下30分钟演练课堂10分钟练习课堂5分钟归纳第二节 几种重要的金属化合物第二课时 铝的重要化合物 (1)Fe2O3是 氧化物,与盐酸反应生成盐和水,离子方程式是 。
(2)CO2是 氧化物,与足量NaOH反应生成盐和水,离子方程式是CO2+2OH-===CO +H2O。
(3)氯化铝溶液与氨水反应的离子方程式为
。
(4)Al(OH)3溶于盐酸的离子方程式为
。碱性Fe2O3+6H+===2Fe3++3H2O酸性Al(OH)3+3H+===Al3++3H2O一、氧化铝
1.物理性质白色固体
易溶于水很高很大? 2.化学性质
Al2O3是 氧化物,与酸或强碱溶液都能反应生成盐和水。两性3.用途
(1)冶炼金属铝的原料;
(2)良好的耐火材料。
二、氢氧化铝
1.物理性质
(1)色态:白色固体。
(2)溶解性:难溶于水。2.化学性质 3.制备
实验室常用可溶性铝盐Al2(SO4)3与氨水反应制取Al(OH)3。
(1)离子方程式为: 。
(2)现象: ,氨水过量时,
。
4.用途
(1)能凝聚水中的悬浮物并能吸附色素,可用来净水。
(2)利用其 性,可用作胃酸中和剂。 有白色胶状沉淀产生沉淀不溶解弱碱Al3++3NH3·H2O===Al(OH)3↓+3NH+4三、硫酸铝钾[KAl(SO4)2]
(1)电离方程式: 。
(2)明矾:1.判断正误(正确的打“√”号,错误的打“×”号)。
(1)Al2O3含有金属元素,是一种碱性氧化物 ( )
(2)Al2O3能溶于任何酸碱溶液 ( )
(3)Al(OH)3可溶于过量的氨水 ( )
(4)氢氧化铝能中和胃酸,可用于制胃药 ( )
(5)明矾的化学式为KAlSO4·12H2O ( )
答案:(1)× (2)× (3)× (4)√ (5)×2.下列关于Al(OH)3的性质叙述错误的是 ( )
A.Al(OH)3是两性氢氧化物
B.Al(OH)3是难溶于水的白色胶状物质
C.Al(OH)3能凝聚水中悬浮物,也能吸附色素
D.Al(OH)3既溶于NaOH溶液、氨水,又能溶于盐酸
解析:Al(OH)3能溶于强酸、强碱溶液,不溶于弱碱
溶液。
答案:D3.连线找用途。
①Al A.治疗胃酸过多
②明矾、AlCl3 B.门窗合金、飞机材料
③Al(OH)3 C.耐火材料
④Al2O3 D.净水剂
答案:①-B,②-D,③-A,④-C4.思考:
(1)医用胃酸中和剂用Al(OH)3,为什么不用NaOH?
(2)实验室常用Al2(SO4)3与氨水反应制备Al(OH)3,为什么不使用NaOH溶液?
答案:(1)NaOH碱性太强,对人体有腐蚀作用,且与酸反应过于剧烈,对人体有极大危害。
(2)NaOH过量会继续与Al(OH)3反应生成NaAlO2,故不用NaOH。铝的化合物之间的相互转化——铝三角 [例1] 已知单质A、B、C和甲、乙、丙、丁四种化合物有如图的转化关系,C为密度最小的气体,甲是一种高熔点的物质,丙常温下是一种液体。根据以上转化关系回答:
(1)写出下列物质的化学式:
A________;B________;乙________。
(2)A原子的原子结构示意图为________。
(3)写出下列变化的方程式:
①A与NaOH溶液反应的化学方程式___________________
__________________________________________________。
②甲与NaOH溶液反应的离子方程式__________________
__________________________________________________。 [解析] 本题主要考查铝的化合物之间的相互转化关系,从物质A作为突破口,A与NaOH反应放出H2,判断A是Al;由C+B→水,判断B为O2;由A+B→甲,判断甲为Al2O3;其余则容易判断:乙为NaAlO2,丁为Al(OH)3。关于Al(OH)3沉淀的图像分析 [例2] 向MgSO4和Al2(SO4)3的混合溶液中逐滴加入NaOH溶液至过量。下列图像中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量) ( ) [解析] 上述过程中发生的反应为MgSO4+2NaOH===Mg(OH)2↓+Na2SO4,Al2(SO4)3+6NaOH===2Al(OH)3↓+3Na2SO4,当NaOH过量时Al(OH)3+NaOH===NaAlO2+2H2O,所以开始时沉淀逐渐增多,达到最大值后,Al(OH)3被溶解,沉淀量逐渐减少,因为Mg(OH)2不溶于NaOH溶液,所以最后沉淀不完全消失。D项正确。
[答案] D 解答图像计算题,必须抓住有关化学原理和有关物质的性质,结合图像的特点,综合分析逐步计算求解,其关键是抓住图像四点(原点、交点、转折点、终点),数形结合,分析计算。点击下图进入点击下图进入
