2013高一化学人教版必修一课件第三章 第二节 第三课时 铁的重要化合物
文档属性
| 名称 | 2013高一化学人教版必修一课件第三章 第二节 第三课时 铁的重要化合物 |  | |
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-10-24 11:52:14 | ||
图片预览










文档简介
课件45张PPT。第三章
第二节
第三课时 课前预习
·巧设计名师课堂
·一点通考点一创新演练
·大冲关设计1设计2考点二设计3课下30分钟演练课堂10分钟练习课堂5分钟归纳第二节 几种重要的金属化合物第三课时 铁的重要化合物 (1)铁与盐酸、CuSO4溶液发生反应的离子方程式分别为 , 。
(2)铁与O2、高温水蒸气反应的化学方程式分别为
,
。
(3)FeCl2溶液与NaOH溶液、FeCl3溶液与氨水反应的离子方程式分别为: ,
。 一、铁的主要化合物
1.铁元素的存在
地壳中金属元素的含量居前两位的是 、 ,铁元素主要以 和 的化合物形式存在。AlFe+2价+3价2.铁的氧化物
(1)物理性质:FeOFe3O4铁红磁性氧化铁+3红棕色粉末黑色晶体 (2)化学性质:
①稳定性:
Fe2O3、Fe3O4较稳定;FeO不稳定,受热能氧化为Fe3O4。
②与酸反应:
FeO、Fe2O3是 氧化物,与盐酸反应的离子方程式为: ,
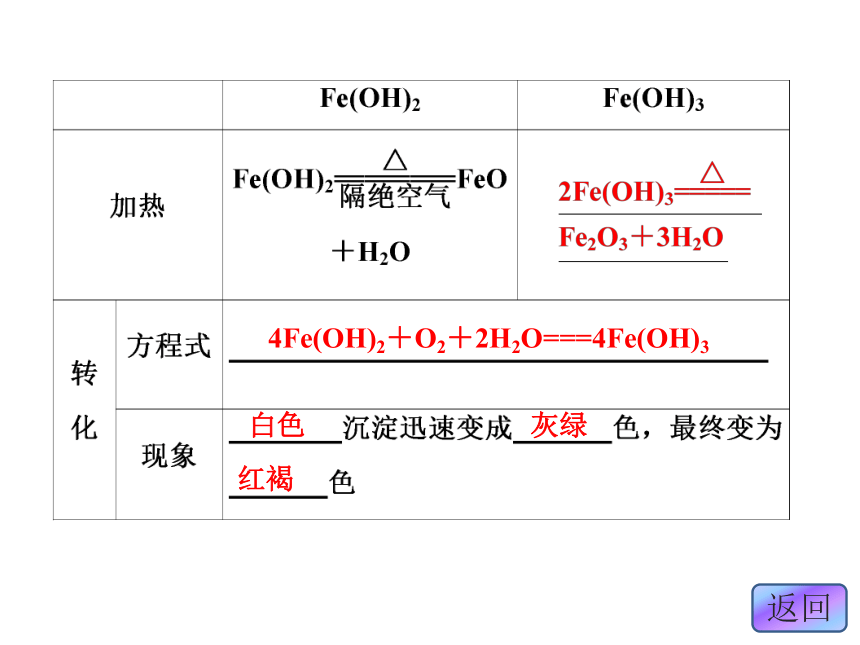
。碱性FeO+2H+===Fe2++H2OFe2O3+6H+===2Fe3++3H2O3.铁的氢氧化物白色红褐色不溶于水不溶于水Fe(OH)2+2H+===Fe2++2H2OFe(OH)3+3H+===Fe3++3H2O4Fe(OH)2+O2+2H2O===4Fe(OH)3白色灰绿红褐4.铁盐和亚铁盐
(1)Fe3+、Fe2+的检验:(2)Fe3+、Fe2+的相互转化:
①实验及现象: 溶液由棕黄色→ →溶液 →溶液变成 。浅绿色无明显变化红色②反应的离子方程式:
,
,
。Fe+2Fe3+===3Fe2+2Fe2++Cl2===2Fe3++2Cl-Fe3++3SCN-===Fe(SCN)3 (4)铁盐的净水作用:
向混有少量泥沙的浑水中加入少量Fe2(SO4)3,浑水会变 。澄清 二、铜盐
1.物理性质
硫酸铜、氯化铜、硝酸铜等铜盐 于水;铜绿的主要成分是 ,其难溶于水。
2.化学性质
①铜的化学性质 ,使用铜器皿比较安全。
②铜盐属于重金属盐,都有毒,原因是铜离子能与蛋白质作用,使蛋白质 而失去生理活性。易溶Cu2(OH)2CO3不活泼变性1.下列物质的主要成分正确的是 ( )
A.赤铁矿:Fe3O4 B.铜绿:Cu2(OH)2CO3
C.磁铁矿:Fe2O3 D.明矾:2KAl(SO4)2
分析:赤铁矿的主要成分是Fe2O3,磁铁矿的主要成分是Fe3O4,明矾的主要成分为KAl(SO4)2·12H2O。
答案:B2.将下列物质的颜色和用途或性质连接起来。
Fe2O3 红褐色 具有较强的还原性
Fe(OH)2 红棕色 易被氧化变成灰绿
色,最终变成红褐色
Fe(OH)3 白色 红色油漆、涂料
Fe2+ 棕黄色 受热分解生成红棕色粉末
Fe3+ 浅绿色 具有较强的氧化性答案:3.Fe3O4与盐酸反应的产物是什么?
分析:Fe3O4中铁元素的化合价为+2价和+3价,和盐酸反应时生成FeCl2和FeCl3。反应方程式为:Fe3O4+8HCl===FeCl2+2FeCl3+4H2O。
答案:FeCl2和FeCl34.Fe(OH)2很容易被空气中的氧气氧化,在制备
Fe(OH)2时应如何防止Fe(OH)2被氧化?
答案:(1)隔绝空气;(2)排除溶液中溶解的O2。5.判断正误(正确打“√”,错误打“×”)。
(1)Fe2O3、Fe3O4都是黑色的固体,都不溶于水 ( )
(2)Fe2O3是碱性氧化物,其和水反应可制备Fe(OH)3 ( )
(3)铁和FeCl3溶液反应的离子方程式为Fe+Fe3+===2Fe2+ ( )
(4)向FeCl3溶液中滴加适量的KSCN溶液,会产生红色的沉淀 ( )
(5)误食CuSO4溶液可服用牛奶或鸡蛋清进行解毒 ( )
答案:(1)× (2)× (3)× (4)× (5)√Fe、Fe2+、Fe3+的相互转化—铁三角 1.Fe→Fe2+或Fe3+
(1)与弱氧化剂反应生成Fe2+:
与S、Fe3+、Cu2+、H+等弱氧化剂反应生成+2价铁,例如:
Fe+2Fe3+===3Fe2+,
Fe+Cu2+===Fe2++Cu,
Fe+2H+===Fe2++H2↑。2.Fe2+→Fe或Fe3+
(1)与氧化剂反应生成Fe3+:
与Cl2、HNO3等强氧化剂反应生成Fe3+,例如:
2Fe2++Cl2===2Fe3++2Cl-。
(2)与还原剂反应生成Fe:
与C、CO、Al、Zn等还原剂反应生成Fe,例如:
Zn+Fe2+===Fe+Zn2+。 [例1] 已知A是一种常见金属,F是一种红褐色沉淀。试根据图中转化关系,回答下列问题。 (1)写出A、C、F、G的化学式
A、_______C、_______F、_______、G、_______。
(2)保存C溶液时要加固体A的原因________________
_________________________________________________。
(3)写出下列转化的离子方程式或化学方程式。
①E→F:___________________________________。
②C→D:___________________________________。 [解析] 根据F是红褐色沉淀知F是Fe(OH)3,从而推知A为Fe,B为Fe3O4,C是FeCl2,D是FeCl3,E为Fe(OH)2,F为Fe(OH)3,G为Fe2O3,X为H2。
[答案] (1)Fe FeCl2 Fe(OH)3 Fe2O3
(2)防止Fe2+被O2氧化
(3)①4Fe(OH)2+O2+2H2O===4Fe(OH)3
②2Fe2++Cl2===2Fe3++2Cl- (1)Fe只有还原性;Fe2+既有还原性,又有氧化性;Fe3+只有氧化性。
(2)利用Fe、Fe2+、Fe3+的相互转化,可以应用于试剂的保存、配制及除杂,如配制硫酸亚铁溶液时加入少量的铁粉以防止Fe2+被氧化。
(3)“变价金属元素、红褐色沉淀、遇SCN-溶液变红色”等,是有关铁及其化合物推断题的突破口。Fe3+、Fe2+的检验1.加碱法2.硫氰化物法 [例2] 下列离子的检验方法合理的是 ( )
A.向某溶液中滴入KSCN溶液呈红色,说明原溶液中不含Fe2+
B.向某溶液中通入Cl2,然后再加入KSCN溶液变红色,说明原溶液中含有Fe2+
C.向某溶液中加入NaOH溶液,得到红褐色沉淀,说明原溶液中含有Fe3+
D.向某溶液中加入NaOH溶液得白色沉淀,又观察到沉淀颜色逐渐变为红褐色,说明原溶液中含有Fe2+, 不含有Mg2+[答案] C (1)含Fe3+的溶液与含SCN-的溶液混合后的现象不是出现红色沉淀,而是形成红色溶液。
(2)鉴别Fe3+与Fe2+也可以用其他试剂,如向溶液中分别加入少量KMnO4溶液,振荡,能使KMnO4溶液褪色的溶液含有Fe2+,不能使之褪色的溶液含有Fe3+。点击下图进入 (1)FeO、Fe2O3、Fe3O4均能与酸反应生成盐和水。其中Fe2O3溶于酸反应的离子方程式为:Fe2O3+6H+===2Fe3++3H2O。
(2)在含Fe2+的溶液中加入碱溶液时,生成白色絮状沉淀,迅速变成灰绿色,最后变成红褐色。
化学方程式为:Fe2++2OH-===Fe(OH)2↓,
4Fe(OH)2+O2+2H2O===Fe(OH)3。 (3)Fe(OH)2和Fe(OH)3都是不溶性碱,Fe(OH)3受热分解生成红棕色的Fe2O3。
(4)Fe3+遇到SCN-时溶液变成红色,利用这一反应可检验Fe3+的存在。
(5)Fe2+与Fe3+在一定条件下可以相互转化,Fe3+遇到Fe、Cu等可被还原为Fe2+,Fe2+遇到氯水、溴水、酸性KMnO4等可被氧化为Fe3+。离子方程式如下:2Fe3++Fe===3Fe2+,2Fe3++Cu===2Fe2++Cu2+,2Fe2++Cl2===2Fe3++2Cl-。点击下图进入
第二节
第三课时 课前预习
·巧设计名师课堂
·一点通考点一创新演练
·大冲关设计1设计2考点二设计3课下30分钟演练课堂10分钟练习课堂5分钟归纳第二节 几种重要的金属化合物第三课时 铁的重要化合物 (1)铁与盐酸、CuSO4溶液发生反应的离子方程式分别为 , 。
(2)铁与O2、高温水蒸气反应的化学方程式分别为
,
。
(3)FeCl2溶液与NaOH溶液、FeCl3溶液与氨水反应的离子方程式分别为: ,
。 一、铁的主要化合物
1.铁元素的存在
地壳中金属元素的含量居前两位的是 、 ,铁元素主要以 和 的化合物形式存在。AlFe+2价+3价2.铁的氧化物
(1)物理性质:FeOFe3O4铁红磁性氧化铁+3红棕色粉末黑色晶体 (2)化学性质:
①稳定性:
Fe2O3、Fe3O4较稳定;FeO不稳定,受热能氧化为Fe3O4。
②与酸反应:
FeO、Fe2O3是 氧化物,与盐酸反应的离子方程式为: ,
。碱性FeO+2H+===Fe2++H2OFe2O3+6H+===2Fe3++3H2O3.铁的氢氧化物白色红褐色不溶于水不溶于水Fe(OH)2+2H+===Fe2++2H2OFe(OH)3+3H+===Fe3++3H2O4Fe(OH)2+O2+2H2O===4Fe(OH)3白色灰绿红褐4.铁盐和亚铁盐
(1)Fe3+、Fe2+的检验:(2)Fe3+、Fe2+的相互转化:
①实验及现象: 溶液由棕黄色→ →溶液 →溶液变成 。浅绿色无明显变化红色②反应的离子方程式:
,
,
。Fe+2Fe3+===3Fe2+2Fe2++Cl2===2Fe3++2Cl-Fe3++3SCN-===Fe(SCN)3 (4)铁盐的净水作用:
向混有少量泥沙的浑水中加入少量Fe2(SO4)3,浑水会变 。澄清 二、铜盐
1.物理性质
硫酸铜、氯化铜、硝酸铜等铜盐 于水;铜绿的主要成分是 ,其难溶于水。
2.化学性质
①铜的化学性质 ,使用铜器皿比较安全。
②铜盐属于重金属盐,都有毒,原因是铜离子能与蛋白质作用,使蛋白质 而失去生理活性。易溶Cu2(OH)2CO3不活泼变性1.下列物质的主要成分正确的是 ( )
A.赤铁矿:Fe3O4 B.铜绿:Cu2(OH)2CO3
C.磁铁矿:Fe2O3 D.明矾:2KAl(SO4)2
分析:赤铁矿的主要成分是Fe2O3,磁铁矿的主要成分是Fe3O4,明矾的主要成分为KAl(SO4)2·12H2O。
答案:B2.将下列物质的颜色和用途或性质连接起来。
Fe2O3 红褐色 具有较强的还原性
Fe(OH)2 红棕色 易被氧化变成灰绿
色,最终变成红褐色
Fe(OH)3 白色 红色油漆、涂料
Fe2+ 棕黄色 受热分解生成红棕色粉末
Fe3+ 浅绿色 具有较强的氧化性答案:3.Fe3O4与盐酸反应的产物是什么?
分析:Fe3O4中铁元素的化合价为+2价和+3价,和盐酸反应时生成FeCl2和FeCl3。反应方程式为:Fe3O4+8HCl===FeCl2+2FeCl3+4H2O。
答案:FeCl2和FeCl34.Fe(OH)2很容易被空气中的氧气氧化,在制备
Fe(OH)2时应如何防止Fe(OH)2被氧化?
答案:(1)隔绝空气;(2)排除溶液中溶解的O2。5.判断正误(正确打“√”,错误打“×”)。
(1)Fe2O3、Fe3O4都是黑色的固体,都不溶于水 ( )
(2)Fe2O3是碱性氧化物,其和水反应可制备Fe(OH)3 ( )
(3)铁和FeCl3溶液反应的离子方程式为Fe+Fe3+===2Fe2+ ( )
(4)向FeCl3溶液中滴加适量的KSCN溶液,会产生红色的沉淀 ( )
(5)误食CuSO4溶液可服用牛奶或鸡蛋清进行解毒 ( )
答案:(1)× (2)× (3)× (4)× (5)√Fe、Fe2+、Fe3+的相互转化—铁三角 1.Fe→Fe2+或Fe3+
(1)与弱氧化剂反应生成Fe2+:
与S、Fe3+、Cu2+、H+等弱氧化剂反应生成+2价铁,例如:
Fe+2Fe3+===3Fe2+,
Fe+Cu2+===Fe2++Cu,
Fe+2H+===Fe2++H2↑。2.Fe2+→Fe或Fe3+
(1)与氧化剂反应生成Fe3+:
与Cl2、HNO3等强氧化剂反应生成Fe3+,例如:
2Fe2++Cl2===2Fe3++2Cl-。
(2)与还原剂反应生成Fe:
与C、CO、Al、Zn等还原剂反应生成Fe,例如:
Zn+Fe2+===Fe+Zn2+。 [例1] 已知A是一种常见金属,F是一种红褐色沉淀。试根据图中转化关系,回答下列问题。 (1)写出A、C、F、G的化学式
A、_______C、_______F、_______、G、_______。
(2)保存C溶液时要加固体A的原因________________
_________________________________________________。
(3)写出下列转化的离子方程式或化学方程式。
①E→F:___________________________________。
②C→D:___________________________________。 [解析] 根据F是红褐色沉淀知F是Fe(OH)3,从而推知A为Fe,B为Fe3O4,C是FeCl2,D是FeCl3,E为Fe(OH)2,F为Fe(OH)3,G为Fe2O3,X为H2。
[答案] (1)Fe FeCl2 Fe(OH)3 Fe2O3
(2)防止Fe2+被O2氧化
(3)①4Fe(OH)2+O2+2H2O===4Fe(OH)3
②2Fe2++Cl2===2Fe3++2Cl- (1)Fe只有还原性;Fe2+既有还原性,又有氧化性;Fe3+只有氧化性。
(2)利用Fe、Fe2+、Fe3+的相互转化,可以应用于试剂的保存、配制及除杂,如配制硫酸亚铁溶液时加入少量的铁粉以防止Fe2+被氧化。
(3)“变价金属元素、红褐色沉淀、遇SCN-溶液变红色”等,是有关铁及其化合物推断题的突破口。Fe3+、Fe2+的检验1.加碱法2.硫氰化物法 [例2] 下列离子的检验方法合理的是 ( )
A.向某溶液中滴入KSCN溶液呈红色,说明原溶液中不含Fe2+
B.向某溶液中通入Cl2,然后再加入KSCN溶液变红色,说明原溶液中含有Fe2+
C.向某溶液中加入NaOH溶液,得到红褐色沉淀,说明原溶液中含有Fe3+
D.向某溶液中加入NaOH溶液得白色沉淀,又观察到沉淀颜色逐渐变为红褐色,说明原溶液中含有Fe2+, 不含有Mg2+[答案] C (1)含Fe3+的溶液与含SCN-的溶液混合后的现象不是出现红色沉淀,而是形成红色溶液。
(2)鉴别Fe3+与Fe2+也可以用其他试剂,如向溶液中分别加入少量KMnO4溶液,振荡,能使KMnO4溶液褪色的溶液含有Fe2+,不能使之褪色的溶液含有Fe3+。点击下图进入 (1)FeO、Fe2O3、Fe3O4均能与酸反应生成盐和水。其中Fe2O3溶于酸反应的离子方程式为:Fe2O3+6H+===2Fe3++3H2O。
(2)在含Fe2+的溶液中加入碱溶液时,生成白色絮状沉淀,迅速变成灰绿色,最后变成红褐色。
化学方程式为:Fe2++2OH-===Fe(OH)2↓,
4Fe(OH)2+O2+2H2O===Fe(OH)3。 (3)Fe(OH)2和Fe(OH)3都是不溶性碱,Fe(OH)3受热分解生成红棕色的Fe2O3。
(4)Fe3+遇到SCN-时溶液变成红色,利用这一反应可检验Fe3+的存在。
(5)Fe2+与Fe3+在一定条件下可以相互转化,Fe3+遇到Fe、Cu等可被还原为Fe2+,Fe2+遇到氯水、溴水、酸性KMnO4等可被氧化为Fe3+。离子方程式如下:2Fe3++Fe===3Fe2+,2Fe3++Cu===2Fe2++Cu2+,2Fe2++Cl2===2Fe3++2Cl-。点击下图进入
