2013高一化学人教版必修一课件第二章 第三节 第一课时 氧化还原反应
文档属性
| 名称 | 2013高一化学人教版必修一课件第二章 第三节 第一课时 氧化还原反应 | 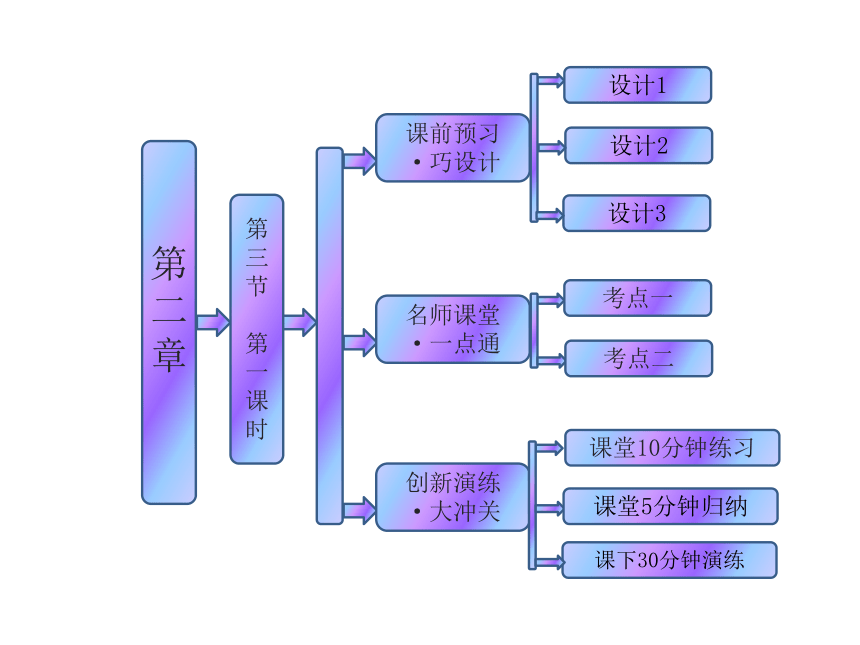 | |
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-10-24 11:53:23 | ||
图片预览









文档简介
课件38张PPT。第二章
第三节
第一课时 课前预习
·巧设计名师课堂
·一点通考点一创新演练
·大冲关设计1设计2考点二设计3课下30分钟演练课堂10分钟练习课堂5分钟归纳第三节 氧化还原反应 第一课时 氧化还原反应得到氧失去氧氧化还原H2H2OCuOCu (3)在反应Fe+CuSO4===FeSO4+Cu中,Fe元素的化合价从 升高到 价,Cu元素的化合价从 价降低到 价。
(4)在下列物质H2O、H2O2、CaH2中,氢元素的化合价是 价,氧元素的化合价是 价。0价+2+2+1和-10-2和-1从不同角度认识氧化还原反应
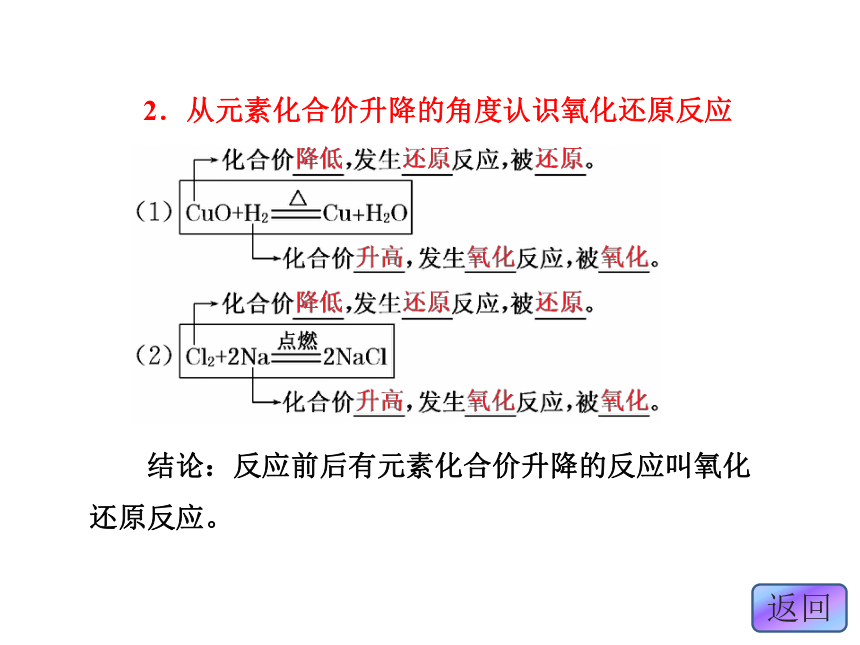
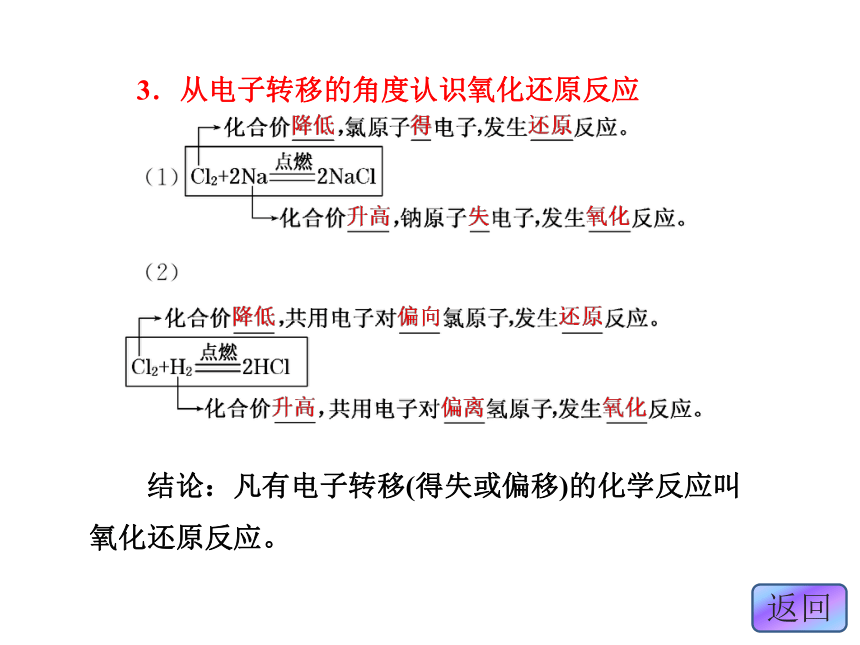
1.从得失氧的角度认识氧化还原反应 结论:一种物质被氧化,另一种物质被还原的反应叫氧化还原反应。2.从元素化合价升降的角度认识氧化还原反应 结论:反应前后有元素化合价升降的反应叫氧化还原反应。3.从电子转移的角度认识氧化还原反应 结论:凡有电子转移(得失或偏移)的化学反应叫氧化还原反应。分析:反应前后元素的化合价是否变化,是判断反应是否是氧化还原反应的依据。分析元素化合价可知A项元素的化合价在反应前后有变化。
答案:A2.将下列反应类型与相应的反应连接起来。
反应类型 化学反应答案:(1)—B (2)—A (3)—D (4)—A、C、D3.判断正误(正确的打“√”,错误的打“×”号)。
(1)只有反应中有物质得氧、失氧的反应才是氧化还原反应 ( )
(2)置换反应一定是氧化还原反应 ( )
(3)氧化还原反应的本质是电子的转移 ( )
(4)在HNO3、N2O4、NaNO2、NO、N2和NH4Cl中氮元素的化合价分别为+5、+4、+3、+2、0和-3价 ( )
答案:(1)× (2)√ (3)√ (4)√分析:根据氧化还原反应的基本概念可以得出正确结果。答案:(1)得到 降低 还原 (2)失去 升高 氧化
氧化还原反应基本概念间的关系2.氧化还原反应概念间的关系 3.氧化还原反应与四种基本反应类型的关系
(1)置换反应一定是氧化还原反应;
(2)复分解反应一定不是氧化还原反应;
(3)有单质参加的化合反应和有单质生成的分解反应是氧化还原反应。
关系如图所示: [例1] 已知CaH2中Ca为+2价,对于CaH2+2H2O===
Ca(OH)2+2H2↑下列说法正确的是 ( )
A.H2都是还原产物
B.H2都是氧化产物
C.CaH2中的氢元素既被氧化又被还原
D.氧化产物与还原产物的质量比为1∶1[答案] D 分析氧化还原反应中基本概念及其关系的方法
(1)正确标出反应前后变价元素的化合价。
(2)找出化合价变化(升、降)与氧化还原反应中各概念之间的对应关系。
(3)在分析电子转移总数时,不能将得电子数和失电子数加和作为转移电子数。氧化还原反应中电子转移的表示方法1.双线桥法
表示反应前后同一元素原子间电子的转移情况。
(1)双线桥法的基本写法思路:(2)注意事项:
①箭头、箭尾对应化合价变化的同种元素。
②必须注明“得到”或“失去”的字样。
③还原剂失去电子总数与氧化剂得到电子总数相等。2.单线桥法
表示反应前后不同元素原子间电子的转移情况。
(1)单线桥法的基本写法思路:(2)注意事项:
①单线桥表示反应物中变价元素原子得失电子的情况;
②不需标明“得”或“失”,只标明电子转移数目;
③箭头标明电子转移的方向;
④单线桥箭头从失电子的元素原子指向得电子的元素
原子。 [例2] (1)分析下列反应的化学方程式,是氧化还原反应的用双线桥法标出电子转移的方向和数目,指出被氧化和被还原的元素。
①2Na+ Cl22NaCl__________________________
②NaOH+HCl===NaCl+H2O_____________________
(2)分析下列反应的化学方程式,是氧化还原反应的用单线桥法标出电子转移的方向和数目。
①BaCl2+Na2SO4===BaSO4↓+2NaCl_______________
②Fe+2HCl===FeCl2+H2↑________________________ [解析] 首先分析各个反应中元素的化合价的变化,根据化合价升高的元素,失去电子,被氧化;化合价降低的元素,得到电子,被还原;用箭头标出电子转移的情况时,要注意单、双线桥的表示方法的特点及各自的注意事项。 (1)表示氧化还原反应中电子转移、化合价升降、物质被氧化、被还原等关系时,用“双线桥”法较方便;表示电子转移的方向和数目时,用“单线桥”法较方便。
(2)双线桥法“线桥”上以“a×be-”的形式表示电子转移数。a表示得或失电子的原子个数,b表示每个原子得到或失去的电子数,当a或b为1时,可省略。点击下图进入 (1)氧化还原反应的本质是电子转移(得失或偏移);特征是反应前后元素的化合价发生变化。判断方法为标明元素的化合价,分析元素的化合价是否变化。 (3)有单质参加的化合反应和有单质生成的分解反应是氧化还原反应;置换反应都是氧化还原反应;复分解反应都不是氧化还原反应。点击下图进入
第三节
第一课时 课前预习
·巧设计名师课堂
·一点通考点一创新演练
·大冲关设计1设计2考点二设计3课下30分钟演练课堂10分钟练习课堂5分钟归纳第三节 氧化还原反应 第一课时 氧化还原反应得到氧失去氧氧化还原H2H2OCuOCu (3)在反应Fe+CuSO4===FeSO4+Cu中,Fe元素的化合价从 升高到 价,Cu元素的化合价从 价降低到 价。
(4)在下列物质H2O、H2O2、CaH2中,氢元素的化合价是 价,氧元素的化合价是 价。0价+2+2+1和-10-2和-1从不同角度认识氧化还原反应
1.从得失氧的角度认识氧化还原反应 结论:一种物质被氧化,另一种物质被还原的反应叫氧化还原反应。2.从元素化合价升降的角度认识氧化还原反应 结论:反应前后有元素化合价升降的反应叫氧化还原反应。3.从电子转移的角度认识氧化还原反应 结论:凡有电子转移(得失或偏移)的化学反应叫氧化还原反应。分析:反应前后元素的化合价是否变化,是判断反应是否是氧化还原反应的依据。分析元素化合价可知A项元素的化合价在反应前后有变化。
答案:A2.将下列反应类型与相应的反应连接起来。
反应类型 化学反应答案:(1)—B (2)—A (3)—D (4)—A、C、D3.判断正误(正确的打“√”,错误的打“×”号)。
(1)只有反应中有物质得氧、失氧的反应才是氧化还原反应 ( )
(2)置换反应一定是氧化还原反应 ( )
(3)氧化还原反应的本质是电子的转移 ( )
(4)在HNO3、N2O4、NaNO2、NO、N2和NH4Cl中氮元素的化合价分别为+5、+4、+3、+2、0和-3价 ( )
答案:(1)× (2)√ (3)√ (4)√分析:根据氧化还原反应的基本概念可以得出正确结果。答案:(1)得到 降低 还原 (2)失去 升高 氧化
氧化还原反应基本概念间的关系2.氧化还原反应概念间的关系 3.氧化还原反应与四种基本反应类型的关系
(1)置换反应一定是氧化还原反应;
(2)复分解反应一定不是氧化还原反应;
(3)有单质参加的化合反应和有单质生成的分解反应是氧化还原反应。
关系如图所示: [例1] 已知CaH2中Ca为+2价,对于CaH2+2H2O===
Ca(OH)2+2H2↑下列说法正确的是 ( )
A.H2都是还原产物
B.H2都是氧化产物
C.CaH2中的氢元素既被氧化又被还原
D.氧化产物与还原产物的质量比为1∶1[答案] D 分析氧化还原反应中基本概念及其关系的方法
(1)正确标出反应前后变价元素的化合价。
(2)找出化合价变化(升、降)与氧化还原反应中各概念之间的对应关系。
(3)在分析电子转移总数时,不能将得电子数和失电子数加和作为转移电子数。氧化还原反应中电子转移的表示方法1.双线桥法
表示反应前后同一元素原子间电子的转移情况。
(1)双线桥法的基本写法思路:(2)注意事项:
①箭头、箭尾对应化合价变化的同种元素。
②必须注明“得到”或“失去”的字样。
③还原剂失去电子总数与氧化剂得到电子总数相等。2.单线桥法
表示反应前后不同元素原子间电子的转移情况。
(1)单线桥法的基本写法思路:(2)注意事项:
①单线桥表示反应物中变价元素原子得失电子的情况;
②不需标明“得”或“失”,只标明电子转移数目;
③箭头标明电子转移的方向;
④单线桥箭头从失电子的元素原子指向得电子的元素
原子。 [例2] (1)分析下列反应的化学方程式,是氧化还原反应的用双线桥法标出电子转移的方向和数目,指出被氧化和被还原的元素。
①2Na+ Cl22NaCl__________________________
②NaOH+HCl===NaCl+H2O_____________________
(2)分析下列反应的化学方程式,是氧化还原反应的用单线桥法标出电子转移的方向和数目。
①BaCl2+Na2SO4===BaSO4↓+2NaCl_______________
②Fe+2HCl===FeCl2+H2↑________________________ [解析] 首先分析各个反应中元素的化合价的变化,根据化合价升高的元素,失去电子,被氧化;化合价降低的元素,得到电子,被还原;用箭头标出电子转移的情况时,要注意单、双线桥的表示方法的特点及各自的注意事项。 (1)表示氧化还原反应中电子转移、化合价升降、物质被氧化、被还原等关系时,用“双线桥”法较方便;表示电子转移的方向和数目时,用“单线桥”法较方便。
(2)双线桥法“线桥”上以“a×be-”的形式表示电子转移数。a表示得或失电子的原子个数,b表示每个原子得到或失去的电子数,当a或b为1时,可省略。点击下图进入 (1)氧化还原反应的本质是电子转移(得失或偏移);特征是反应前后元素的化合价发生变化。判断方法为标明元素的化合价,分析元素的化合价是否变化。 (3)有单质参加的化合反应和有单质生成的分解反应是氧化还原反应;置换反应都是氧化还原反应;复分解反应都不是氧化还原反应。点击下图进入
