2013高一化学人教版必修一课件第三章 第一节 第二课时 铝与氢氧化钠溶液的反应 物质的量在化学方程式计算中的应用
文档属性
| 名称 | 2013高一化学人教版必修一课件第三章 第一节 第二课时 铝与氢氧化钠溶液的反应 物质的量在化学方程式计算中的应用 |  | |
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-10-24 12:02:40 | ||
图片预览









文档简介
课件38张PPT。第三章
第一节
第二课时 课前预习
·巧设计名师课堂
·一点通考点一创新演练
·大冲关设计1设计2考点二设计3课下30分钟演练课堂10分钟练习课堂5分钟归纳第一节 金属的化学性质第二课时 铝与氢氧化钠溶液的反应
物质的量在化学方程式计算中的应用 (1)铝和稀硫酸反应的离子方程式是2Al+6H+===
2Al3++3H2↑,反应的还原剂是 ,氧化剂是 。
(2)在标准状况下,46 g钠和足量的水反应,则生成H2的质量为 ,即2 mol钠和足量的水反应,生成H2的物质的量为 mol,其体积为 L。AlH2SO42 g122.4 一、铝与氢氧化钠溶液的反应
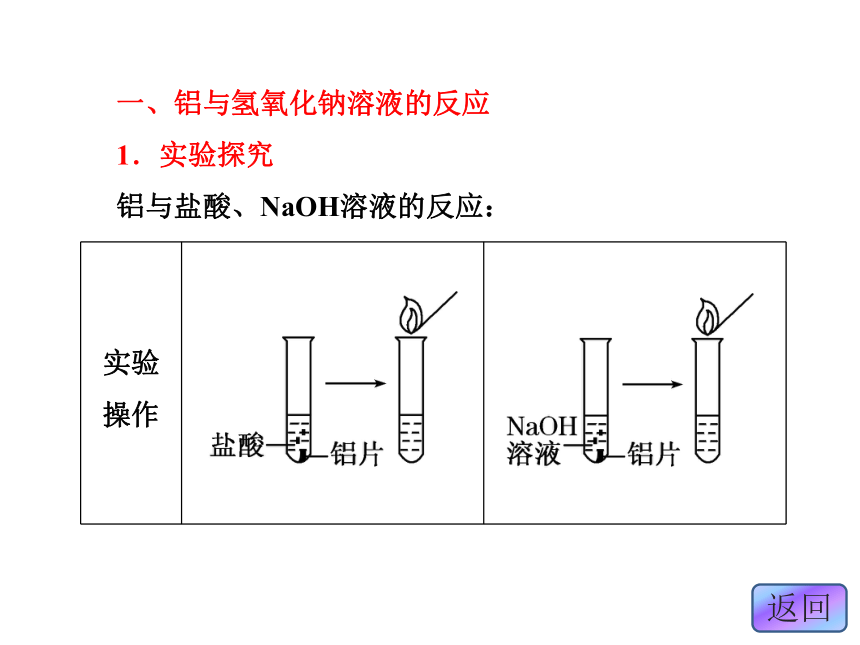
1.实验探究
铝与盐酸、NaOH溶液的反应:气泡溶解爆鸣气泡溶解爆鸣2Al+6HCl===2AlCl3+3H2↑2Al+6H+===2Al3++3H2↑2Al+2NaOH+2H2O===2NaAlO2+3H2↑2Al+2OH-+2.实验结论
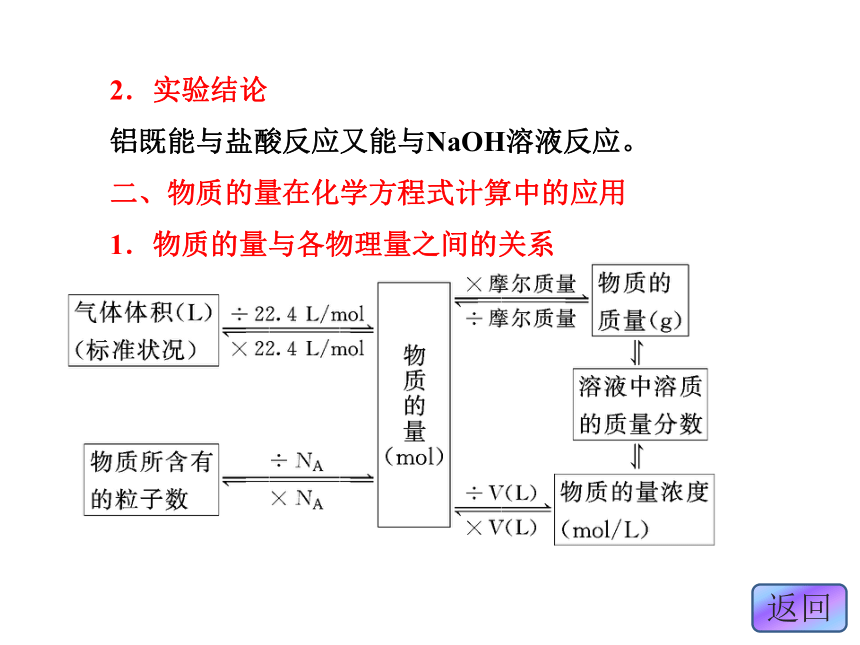
铝既能与盐酸反应又能与NaOH溶液反应。
二、物质的量在化学方程式计算中的应用
1.物质的量与各物理量之间的关系2.化学方程式中化学计量数与各化学计量间的关系
2Na + 2H2O===2NaOH+H2↑
质量之比: 46 g ∶ 36 g ∶ 80 g ∶ 2 g
计量数之比: 2 ∶ 2 ∶ 2 ∶ 1
扩大NA倍: 2NA ∶ 2NA ∶ 2NA ∶ NA
物质的量之比: 2 mol ∶ 2 mol ∶ 2 mol ∶ 1 mol
结论:化学方程式中化学计量数之比等于 之比,也等于 之比,对于有气体参与的反应还等于
之比。粒子个数物质的量体积1.铝制容器能否用来长期存放酸性或碱性食物?
答案:不能,铝与酸或碱都能反应,因此铝制容器不宜用来长期存放酸性或碱性食物。2.判断正误(正确的打“√”,错误的打“×”号)。
(1)铝和盐酸、NaOH溶液的反应中,铝都失去电子
( )
(2)等体积等浓度的盐酸、NaOH溶液与过量Al反应,产生H2的物质的量相等 ( )
(3)铝与NaOH溶液反应中,每转移3 mol e-,就生成1.5 mol H2 ( )
(4)化学方程式中各物质的化学计量数之比等于各物质的质量之比 ( )
答案:(1)√ (2)× (3)√ (4)×3.连线题。
具体反应
(1) 2 mol盐酸与足量Al反应
(2) 2 mol NaOH溶液与足量Al反应 答案:(1)—A、C (2)—B、DA.22.4 L
B.3 mol
C.2 g
D.67.2 L 4.化学反应遵循质量守恒,是否物质的物质的量也
守恒呢?
答案:不是,化学反应前后质量是守恒的,但物质的量之比等于化学计量数之比,所以反应后物质的量可能不变,也可能减小,也可能增大。铝与盐酸、NaOH溶液反应的比较1.反应原理
(1)铝与盐酸反应:
2Al+6HCl===2AlCl3+3H2↑,
Al是还原剂,HCl是氧化剂。
(2)铝跟氢氧化钠溶液的反应是分步进行的:
①2Al+6H2O===2Al(OH)3+3H2↑;
②Al(OH)3+NaOH===NaAlO2+2H2O,
总反应为:
2Al+2NaOH+6H2O===2NaAlO2+3H2↑+4H2O,
Al是还原剂,H2O是氧化剂。 2.“量”的关系
(1)等量的铝分别与足量的盐酸和氢氧化钠溶液反应,消耗HCl和NaOH的物质的量之比为3∶1。
(2)等量的铝分别与足量的盐酸和氢氧化钠溶液反应,产生H2的体积比为1∶1。
(3)足量的铝分别与等物质的量浓度、等体积的盐酸和氢氧化钠溶液反应,产生H2的体积比为1∶3。 (4)一定量的铝分别与一定量的盐酸、氢氧化钠溶液反应,若产生氢气的体积比为 1/3 ①铝与盐酸反应时,铝过量而盐酸不足。
②铝与氢氧化钠溶液反应时,铝不足而氢氧化钠过量。 [例1] 等体积、等物质的量浓度的盐酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5∶7,则甲、乙两烧杯中的反应情况可能分别是 ( )
A.甲、乙中都是铝过量
B.甲中铝过量,乙中碱过量
C.甲中酸过量,乙中铝过量
D.甲中酸过量,乙中碱过量[答案] B应用物质的量进行化学方程式计算的基本步骤和类型1.基本步骤 2.计算类型
(1)基本计算:
已知一种反应物(或生成物)的量求解其他物质的有关量,此时,只要按照化学方程式的量的关系,列出已知物质和待求物质的比例式计算便可。
(2)混合物反应的计算:
设出混合物中各物质的物质的量为x、y、z,按照化学方程式的量的关系,并用x、y、z表示,列出方程组解答。 (3)过量计算:
给出了两种反应物的量,求解某产物的量。
方法:按照化学方程式的量的关系进行判断,哪一种物质过量,然后根据不足的物质的量进行求解。 [例2] 向500 mL NaOH溶液中投入10.8 g Al,二者恰好完全反应后,计算:
(1)Al的物质的量。
(2)参加反应的NaOH的物质的量和溶液的物质的量浓度。
(3)生成标准状况下H2的体积。 (1)各种符号的书写要规范,大写字母与小写字母的意义各不相同。如“M”表示摩尔质量,而“m”表示质量;“N”表示微粒数,而“n”表示物质的量。
(2)当已知物理量与被求物理量不一致时,计算时题目中的数据必须带单位,以体现“上下一致,左右相当”的原则。点击下图进入 (1)铝是既能与酸反应又能与碱溶液反应生成H2的
金属。
(2)在反应2Al+2NaOH+2H2O===2NaAlO2+3H2↑中,铝作还原剂,水作氧化剂。
(3)化学方程式中各物质的化学计量数之比等于各物质的物质的量之比。
(4)在根据化学方程式计算时,物理量选用的原则是:上下一致,左右相当。点击下图进入
第一节
第二课时 课前预习
·巧设计名师课堂
·一点通考点一创新演练
·大冲关设计1设计2考点二设计3课下30分钟演练课堂10分钟练习课堂5分钟归纳第一节 金属的化学性质第二课时 铝与氢氧化钠溶液的反应
物质的量在化学方程式计算中的应用 (1)铝和稀硫酸反应的离子方程式是2Al+6H+===
2Al3++3H2↑,反应的还原剂是 ,氧化剂是 。
(2)在标准状况下,46 g钠和足量的水反应,则生成H2的质量为 ,即2 mol钠和足量的水反应,生成H2的物质的量为 mol,其体积为 L。AlH2SO42 g122.4 一、铝与氢氧化钠溶液的反应
1.实验探究
铝与盐酸、NaOH溶液的反应:气泡溶解爆鸣气泡溶解爆鸣2Al+6HCl===2AlCl3+3H2↑2Al+6H+===2Al3++3H2↑2Al+2NaOH+2H2O===2NaAlO2+3H2↑2Al+2OH-+2.实验结论
铝既能与盐酸反应又能与NaOH溶液反应。
二、物质的量在化学方程式计算中的应用
1.物质的量与各物理量之间的关系2.化学方程式中化学计量数与各化学计量间的关系
2Na + 2H2O===2NaOH+H2↑
质量之比: 46 g ∶ 36 g ∶ 80 g ∶ 2 g
计量数之比: 2 ∶ 2 ∶ 2 ∶ 1
扩大NA倍: 2NA ∶ 2NA ∶ 2NA ∶ NA
物质的量之比: 2 mol ∶ 2 mol ∶ 2 mol ∶ 1 mol
结论:化学方程式中化学计量数之比等于 之比,也等于 之比,对于有气体参与的反应还等于
之比。粒子个数物质的量体积1.铝制容器能否用来长期存放酸性或碱性食物?
答案:不能,铝与酸或碱都能反应,因此铝制容器不宜用来长期存放酸性或碱性食物。2.判断正误(正确的打“√”,错误的打“×”号)。
(1)铝和盐酸、NaOH溶液的反应中,铝都失去电子
( )
(2)等体积等浓度的盐酸、NaOH溶液与过量Al反应,产生H2的物质的量相等 ( )
(3)铝与NaOH溶液反应中,每转移3 mol e-,就生成1.5 mol H2 ( )
(4)化学方程式中各物质的化学计量数之比等于各物质的质量之比 ( )
答案:(1)√ (2)× (3)√ (4)×3.连线题。
具体反应
(1) 2 mol盐酸与足量Al反应
(2) 2 mol NaOH溶液与足量Al反应 答案:(1)—A、C (2)—B、DA.22.4 L
B.3 mol
C.2 g
D.67.2 L 4.化学反应遵循质量守恒,是否物质的物质的量也
守恒呢?
答案:不是,化学反应前后质量是守恒的,但物质的量之比等于化学计量数之比,所以反应后物质的量可能不变,也可能减小,也可能增大。铝与盐酸、NaOH溶液反应的比较1.反应原理
(1)铝与盐酸反应:
2Al+6HCl===2AlCl3+3H2↑,
Al是还原剂,HCl是氧化剂。
(2)铝跟氢氧化钠溶液的反应是分步进行的:
①2Al+6H2O===2Al(OH)3+3H2↑;
②Al(OH)3+NaOH===NaAlO2+2H2O,
总反应为:
2Al+2NaOH+6H2O===2NaAlO2+3H2↑+4H2O,
Al是还原剂,H2O是氧化剂。 2.“量”的关系
(1)等量的铝分别与足量的盐酸和氢氧化钠溶液反应,消耗HCl和NaOH的物质的量之比为3∶1。
(2)等量的铝分别与足量的盐酸和氢氧化钠溶液反应,产生H2的体积比为1∶1。
(3)足量的铝分别与等物质的量浓度、等体积的盐酸和氢氧化钠溶液反应,产生H2的体积比为1∶3。 (4)一定量的铝分别与一定量的盐酸、氢氧化钠溶液反应,若产生氢气的体积比为 1/3
②铝与氢氧化钠溶液反应时,铝不足而氢氧化钠过量。 [例1] 等体积、等物质的量浓度的盐酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5∶7,则甲、乙两烧杯中的反应情况可能分别是 ( )
A.甲、乙中都是铝过量
B.甲中铝过量,乙中碱过量
C.甲中酸过量,乙中铝过量
D.甲中酸过量,乙中碱过量[答案] B应用物质的量进行化学方程式计算的基本步骤和类型1.基本步骤 2.计算类型
(1)基本计算:
已知一种反应物(或生成物)的量求解其他物质的有关量,此时,只要按照化学方程式的量的关系,列出已知物质和待求物质的比例式计算便可。
(2)混合物反应的计算:
设出混合物中各物质的物质的量为x、y、z,按照化学方程式的量的关系,并用x、y、z表示,列出方程组解答。 (3)过量计算:
给出了两种反应物的量,求解某产物的量。
方法:按照化学方程式的量的关系进行判断,哪一种物质过量,然后根据不足的物质的量进行求解。 [例2] 向500 mL NaOH溶液中投入10.8 g Al,二者恰好完全反应后,计算:
(1)Al的物质的量。
(2)参加反应的NaOH的物质的量和溶液的物质的量浓度。
(3)生成标准状况下H2的体积。 (1)各种符号的书写要规范,大写字母与小写字母的意义各不相同。如“M”表示摩尔质量,而“m”表示质量;“N”表示微粒数,而“n”表示物质的量。
(2)当已知物理量与被求物理量不一致时,计算时题目中的数据必须带单位,以体现“上下一致,左右相当”的原则。点击下图进入 (1)铝是既能与酸反应又能与碱溶液反应生成H2的
金属。
(2)在反应2Al+2NaOH+2H2O===2NaAlO2+3H2↑中,铝作还原剂,水作氧化剂。
(3)化学方程式中各物质的化学计量数之比等于各物质的物质的量之比。
(4)在根据化学方程式计算时,物理量选用的原则是:上下一致,左右相当。点击下图进入
