2013高一化学人教版必修一课件第三章 章末复习方案与全优评估
文档属性
| 名称 | 2013高一化学人教版必修一课件第三章 章末复习方案与全优评估 |  | |
| 格式 | zip | ||
| 文件大小 | 786.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-10-24 12:08:28 | ||
图片预览










文档简介
课件35张PPT。考点三第三章
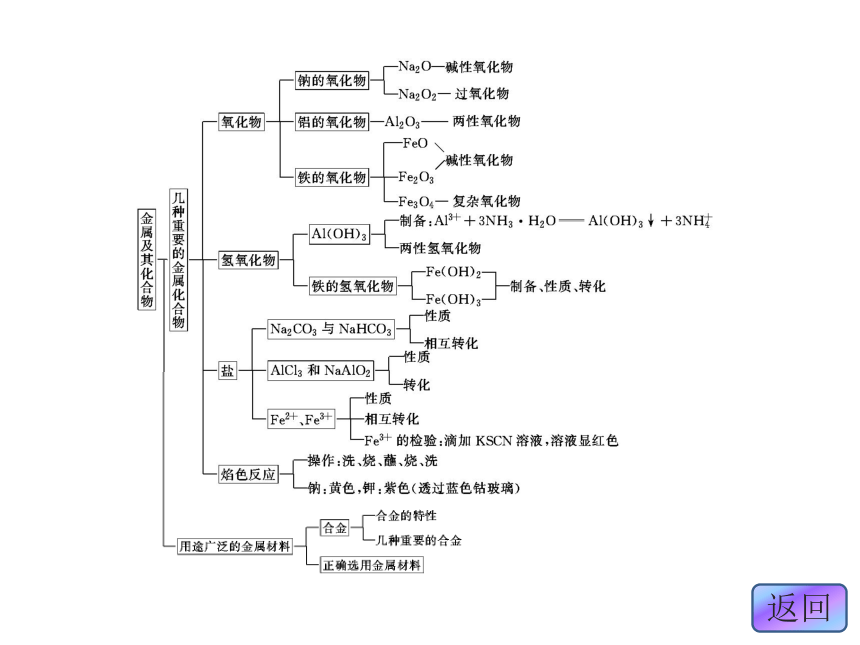
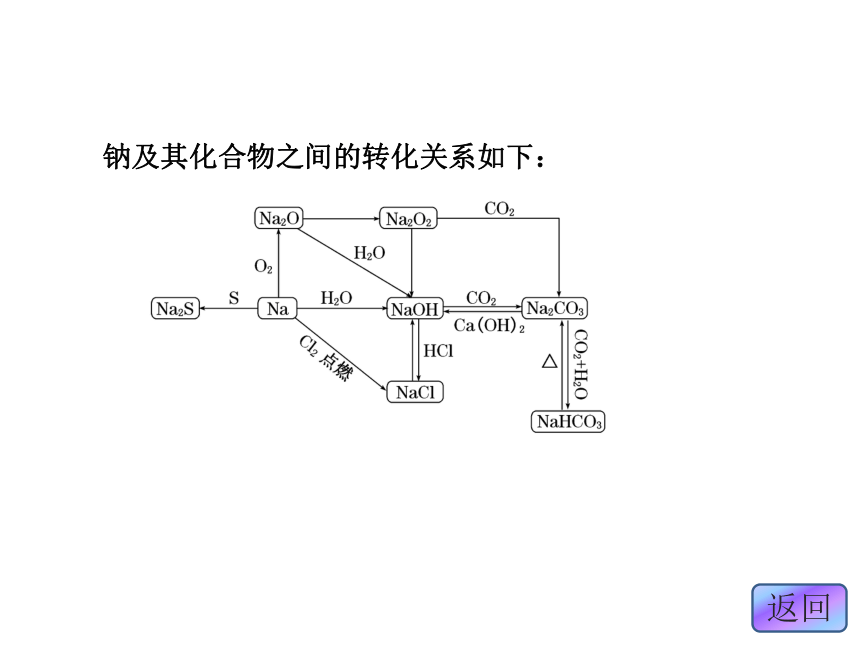
章末复习方案与全优评估归纳·整合·串联整合·迁移·发散考点一检测·发现·闯关考点二钠及其化合物的性质 有关钠及其化合物性质的考查是高考中经常出现的内容,有多种考查方式。复习要从以下几方面入手:了解钠元素在自然界中的存在,了解钠单质的生产原理;能用实验的方法探索和认识钠单质及Na2O、Na2O2、Na2CO3、NaHCO3等重要化合物的性质,了解它们的主要用途;掌握与Na、Na2O2、NaOH、NaHCO3、Na2CO3的性质有关的化学计算的解题方法。钠及其化合物之间的转化关系如下:[考题印证]1.(2011·北京高考)下列实验方案中,不能测定Na2CO3
和NaHCO3混合物中Na2CO3质量分数的是 ( )
A.取a克混合物充分加热,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸
干、灼烧,得b克固体
C. 取a克混合物与足量稀硫酸充分反应,逸出气体用碱
石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、
洗涤、烘干,得b克固体 解析:A选项采用差量法,减少的质量为碳酸氢钠分解生成的二氧化碳和水的质量,由此可求出碳酸氢钠的质量,进而求出碳酸钠的质量分数;B选项中b克固体为生成的氯化钠的质量,根据钠原子守恒和混合物总质量可列式计算出碳酸钠的质量,进而求出碳酸钠的质量分数;C选项中碱石灰增加的质量为盐与酸反应生成的二氧化碳和水的质量及溶液中挥发出来的水蒸气的质量,因此不能通过数据准确计算出碳酸钠的质量分数;D选项中沉淀的质量即为碳酸钡的质量,根据碳酸钡的质量和混合物总质量可以列式求出碳酸钠的质量,进而求出碳酸钠的质量分数。
答案:C2.(2010·上海高考)将0.4 g NaOH和1.06 g Na2CO3混合并
配成溶液,向溶液中滴加0.1 mol/L稀盐酸。下列图象
能正确表示加入盐酸的体积和生成CO2的物质的量的
关系是 ( )答案:C铝及其化合物的性质 铝是高中化学学习的重要金属之一,新课标要求大家掌握铝及其化合物的性质并了解其应用。复习时可从以下几方面入手:掌握铝、氧化铝、氢氧化铝的性质,熟悉铝及其化合物之间的转化,理解有关滴加顺序的问题以及与Al(OH)3沉淀量有关的图像问题。铝及其化合物之间的转化关系如下:[考题印证]3.(2011·福建高考,节选)化学兴趣小组对某品牌牙膏中
摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙
膏中其他成分遇到盐酸时无气体产生。
摩擦剂中氢氧化铝的定性检验:
取适量牙膏样品,加水充分搅拌、过滤。
(1)往滤渣中加入过量NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是_____________________。
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察到的现象是________________________________。4.(2010·山东高考节选)对金属制品进行抗腐蚀处理,
可延长其使用寿命。
以下为铝材表面处理的一种方法:碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是________________________________
_______(用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的________。
A.NH3 B.CO2 C.NaOH D.HNO3铁及其化合物的相互转化 铁是高中化学学习的重要金属之一,在复习时应注意从以下几个方面进行掌握:铁及铁的氧化物的化学性质;铁的氢氧化物的制取和性质;从氧化还原反应的角度掌握Fe2+、Fe3+的性质及其相互转化关系;会用化学方法鉴别Fe2+与Fe3+;与Fe相关的计算等。这部分的知识在高考中主要以选择题的形式出现,在实验题或推断题中也常有涉及。铁及其化合物的转化关系如下:[考题印证] (1)某学习小组对加碘盐进行了如下实验:取一定量某加碘盐(可能含有 KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得试液分为 3 份,第一份试液中滴加 KSCN 溶液后显红色;第二份试液中加足量 KI 固体,溶液显淡黄色,用 CCl4 萃取,下层溶液显紫红色;第三份试液中加入适量 KIO3固体后,滴加淀粉试剂,溶液不变色。①加 KSCN 溶液显红色,该红色物质是________(用化学式表示);CCl4 中显紫红色的物质是________(写化学式)。
②第二份试液中加入足量 KI 固体后,反应的离子方程式为___________、___________。
(2) 对含 Fe2+较多的食盐(假设不含 Fe3+),可选用 KI 作为加碘剂。请设计实验方案,检验该加碘盐中的 Fe2+:________
___________________________________________________。
6.已知有以下物质相互转化,其中A为常见金属,C为碱。试回答:
(1)写出F的化学式________,H的化学式___________。
(2)写出由E转变成F的化学方程式:_______________。
(3)向G溶液加入A的有关离子反应方程式:________。
(4)写出A在一定条件下与水反应的化学方程式:______。解析:据框图转化可知,溶液D与硝酸酸化的硝酸银反应后的溶液中含有K+,白色沉淀H是AgCl,则D为KCl;又根据红褐色沉淀F为Fe(OH)3,则E为Fe(OH)2,结合复分解反应的特点知B为FeCl2,C为KOH,A为Fe。点击下图进入
章末复习方案与全优评估归纳·整合·串联整合·迁移·发散考点一检测·发现·闯关考点二钠及其化合物的性质 有关钠及其化合物性质的考查是高考中经常出现的内容,有多种考查方式。复习要从以下几方面入手:了解钠元素在自然界中的存在,了解钠单质的生产原理;能用实验的方法探索和认识钠单质及Na2O、Na2O2、Na2CO3、NaHCO3等重要化合物的性质,了解它们的主要用途;掌握与Na、Na2O2、NaOH、NaHCO3、Na2CO3的性质有关的化学计算的解题方法。钠及其化合物之间的转化关系如下:[考题印证]1.(2011·北京高考)下列实验方案中,不能测定Na2CO3
和NaHCO3混合物中Na2CO3质量分数的是 ( )
A.取a克混合物充分加热,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸
干、灼烧,得b克固体
C. 取a克混合物与足量稀硫酸充分反应,逸出气体用碱
石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、
洗涤、烘干,得b克固体 解析:A选项采用差量法,减少的质量为碳酸氢钠分解生成的二氧化碳和水的质量,由此可求出碳酸氢钠的质量,进而求出碳酸钠的质量分数;B选项中b克固体为生成的氯化钠的质量,根据钠原子守恒和混合物总质量可列式计算出碳酸钠的质量,进而求出碳酸钠的质量分数;C选项中碱石灰增加的质量为盐与酸反应生成的二氧化碳和水的质量及溶液中挥发出来的水蒸气的质量,因此不能通过数据准确计算出碳酸钠的质量分数;D选项中沉淀的质量即为碳酸钡的质量,根据碳酸钡的质量和混合物总质量可以列式求出碳酸钠的质量,进而求出碳酸钠的质量分数。
答案:C2.(2010·上海高考)将0.4 g NaOH和1.06 g Na2CO3混合并
配成溶液,向溶液中滴加0.1 mol/L稀盐酸。下列图象
能正确表示加入盐酸的体积和生成CO2的物质的量的
关系是 ( )答案:C铝及其化合物的性质 铝是高中化学学习的重要金属之一,新课标要求大家掌握铝及其化合物的性质并了解其应用。复习时可从以下几方面入手:掌握铝、氧化铝、氢氧化铝的性质,熟悉铝及其化合物之间的转化,理解有关滴加顺序的问题以及与Al(OH)3沉淀量有关的图像问题。铝及其化合物之间的转化关系如下:[考题印证]3.(2011·福建高考,节选)化学兴趣小组对某品牌牙膏中
摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙
膏中其他成分遇到盐酸时无气体产生。
摩擦剂中氢氧化铝的定性检验:
取适量牙膏样品,加水充分搅拌、过滤。
(1)往滤渣中加入过量NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是_____________________。
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察到的现象是________________________________。4.(2010·山东高考节选)对金属制品进行抗腐蚀处理,
可延长其使用寿命。
以下为铝材表面处理的一种方法:碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是________________________________
_______(用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的________。
A.NH3 B.CO2 C.NaOH D.HNO3铁及其化合物的相互转化 铁是高中化学学习的重要金属之一,在复习时应注意从以下几个方面进行掌握:铁及铁的氧化物的化学性质;铁的氢氧化物的制取和性质;从氧化还原反应的角度掌握Fe2+、Fe3+的性质及其相互转化关系;会用化学方法鉴别Fe2+与Fe3+;与Fe相关的计算等。这部分的知识在高考中主要以选择题的形式出现,在实验题或推断题中也常有涉及。铁及其化合物的转化关系如下:[考题印证] (1)某学习小组对加碘盐进行了如下实验:取一定量某加碘盐(可能含有 KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得试液分为 3 份,第一份试液中滴加 KSCN 溶液后显红色;第二份试液中加足量 KI 固体,溶液显淡黄色,用 CCl4 萃取,下层溶液显紫红色;第三份试液中加入适量 KIO3固体后,滴加淀粉试剂,溶液不变色。①加 KSCN 溶液显红色,该红色物质是________(用化学式表示);CCl4 中显紫红色的物质是________(写化学式)。
②第二份试液中加入足量 KI 固体后,反应的离子方程式为___________、___________。
(2) 对含 Fe2+较多的食盐(假设不含 Fe3+),可选用 KI 作为加碘剂。请设计实验方案,检验该加碘盐中的 Fe2+:________
___________________________________________________。
6.已知有以下物质相互转化,其中A为常见金属,C为碱。试回答:
(1)写出F的化学式________,H的化学式___________。
(2)写出由E转变成F的化学方程式:_______________。
(3)向G溶液加入A的有关离子反应方程式:________。
(4)写出A在一定条件下与水反应的化学方程式:______。解析:据框图转化可知,溶液D与硝酸酸化的硝酸银反应后的溶液中含有K+,白色沉淀H是AgCl,则D为KCl;又根据红褐色沉淀F为Fe(OH)3,则E为Fe(OH)2,结合复分解反应的特点知B为FeCl2,C为KOH,A为Fe。点击下图进入
