2013高一化学人教版必修一课件第四章 第四节 第二课时 硫酸和硝酸的氧化性
文档属性
| 名称 | 2013高一化学人教版必修一课件第四章 第四节 第二课时 硫酸和硝酸的氧化性 |  | |
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-10-24 12:13:22 | ||
图片预览











文档简介
课件42张PPT。第四章
第四节
第 二课时
课前预习
·巧设计名师课堂
·一点通考点一创新演练
·大冲关设计1设计2考点二设计3课下30分钟演练课堂10分钟练习课堂5分钟归纳第四节 氨 硝酸 硫酸第二课时 硫酸和硝酸的氧化性 (1)H2SO4的电离方程式是 。
在反应Zn+H2SO4(稀)===ZnSO4+H2↑中,失电子的是Zn,得电子的是 ,稀硫酸表现的性质是 。
(2)浓H2SO4具有吸水性,通常用作 。浓H2SO4溶于水会放出大量的热,故稀释浓H2SO4时,应将 缓缓加入到 并不断地 进行搅拌。
(3)从氧化还原反应的价态规律分析,H2SO4中的硫元素、HNO3中的氮元素 。 H+酸性和弱氧化性干燥剂浓H2SO4水中用玻璃棒只有氧化性 一、浓硫酸的性质
1.吸水性
浓硫酸能吸收气体、液体中的水分以及固体中的结晶水,故常作 。
2.脱水性
浓硫酸能将有机物中的 按水的组成比脱去,剩余黑色的炭。干燥剂氢、氧元素3.强氧化性
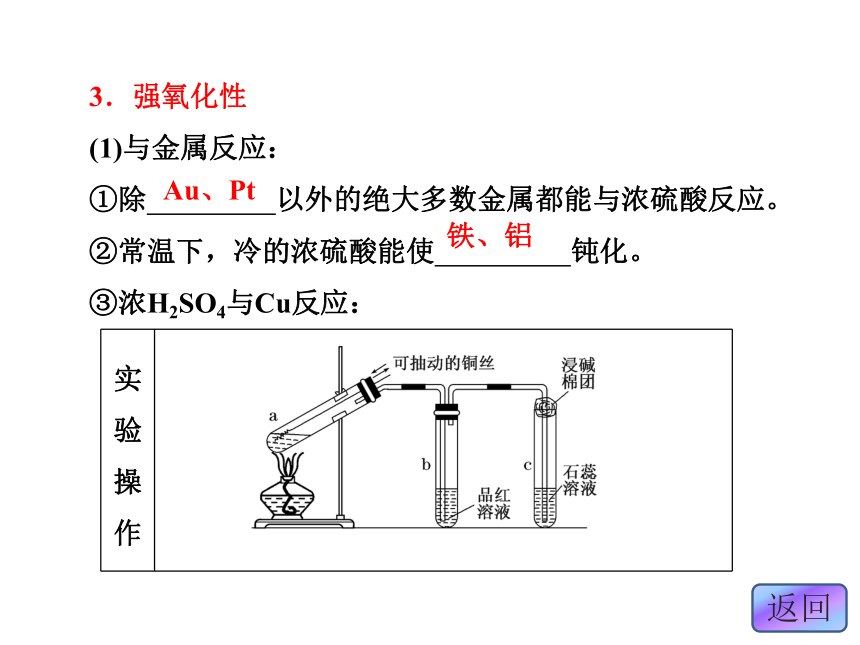
(1)与金属反应:
①除 以外的绝大多数金属都能与浓硫酸反应。
②常温下,冷的浓硫酸能使 钝化。
③浓H2SO4与Cu反应:Au、Pt铁、铝有气泡逸出无色红色蓝色 (2)与非金属反应:
加热时与木炭发生反应:
。二、硝酸的性质
1.强氧化性
(1)与金属反应:
①除 以外的绝大多数金属都能与硝酸反应。
②常温下,冷的浓硝酸能使 钝化。
③与铜反应(写出化学方程式):
浓硝酸: ,
稀硝酸: 。金铂铁、铝4HNO3(浓)+Cu===Cu(NO3)2+2NO2↑+2H2O8HNO3(稀)+3Cu===3Cu(NO3)2+2NO↑+4H2O(2)与非金属反应:
加热时浓硝酸与木炭发生反应:
。
(3)王水:
①组成: 与 ,体积比为1∶3;
②性质:能使一些不溶于硝酸的金属如 等溶解。浓硝酸浓盐酸金、铂
2.不稳定性
(1)化学方程式: 。
(2)实验室中浓硝酸显黄色的原因:
浓硝酸分解生成的NO2又溶于硝酸所致。1.将下列现象与浓H2SO4表现的性质连接起来。
(1)浓H2SO4使铁、铝钝化 A.吸水性
(2)浓H2SO4滴在纸上,使纸变黑 B.脱水性
(3)浓H2SO4干燥SO2气体 C.强氧化性
答案:(1)—C (2)—B (3)—A2.判断正误(正确的打“√”号,错误的打“×”号)。
(1)稀H2SO4和Fe反应的离子方程式为:2Fe+6H+===
2Fe3++3H2↑ ( )
(2)浓H2SO4可用作SO2、NH3的干燥剂 ( )
(3)冷的浓H2SO4使铁、铝钝化属于物理变化 ( )
(4)铜和稀HNO3反应中HNO3既体现了氧化性,又体现了
酸性 ( )
(5)浓盐酸和浓硝酸按体积比1∶3组成王水 ( )
答案:(1)× (2)× (3)× (4)√ (5)×3.思考:Cu和一定浓度的HNO3充分反应后铜过量,
若向反应后混合物中滴加稀H2SO4,铜能否继续
溶解?4.实验室中应如何保存浓硝酸?
答案:因浓HNO3见光或受热易分解,所以应盛放
在棕色细口瓶中并置于冷暗处。浓硫酸的强氧化性 1.与金属的反应(体现酸性和氧化性)
(1)与较活泼金属反应:
①铁、铝:
常温下,当铁、铝等较活泼的金属遇到浓硫酸时,会与浓硫酸发生反应,表面生成一层致密的氧化物薄膜而出现“钝化”现象。加热时,反应生成硫酸盐和SO2。
②其他活泼金属:除铁、铝外的其他活泼金属与浓硫酸反应时,开始产生SO2,后来产生H2。 [例1] 下列叙述正确的是 ( )
A.浓硫酸是一种干燥剂,能够干燥氢气、氧气、氨气等气体,但不能干燥有较强还原性的HI、H2S等气体
B.浓硫酸与单质硫反应的方程式为:S+2H2SO4(浓)
3SO2↑+2H2O,在此反应中,浓硫酸既表现了其强氧化性又表现了其酸性 C.把足量铜粉投入到只含H2SO4 2 mol的浓硫酸中,得到气体体积标准状况下为22.4 L
D.常温下能够用铁、铝等容器盛放浓H2SO4,是因为浓H2SO4的强氧化性使其钝化 [解析] A项浓硫酸具有吸水性,但由于其具有强氧化性和酸性,故不能用来干燥具有还原性的气体和碱性气体(NH3)。B项浓硫酸与S、C等非金属单质作用时,由于没有盐生成,故只表现其强氧化性。C项Cu与浓H2SO4反应时,浓H2SO4浓度逐渐降低,当成为稀H2SO4时,反应停止,故产生的SO2在标准状况下不足22.4 L。答案为D。
[答案] D (1)浓硫酸与金属反应时,既表现酸性又表现强氧化性,而与非金属反应时,只表现强氧化性。
(2)浓H2SO4与金属反应时,随着反应的进行,浓硫酸浓度变小,一旦变为稀硫酸,不再与不活泼金属反应。但足量的活泼金属如Zn与浓H2SO4反应时,开始阶段浓H2SO4体现其强氧化性,产生SO2气体,随着反应的进行,当浓硫酸变为稀H2SO4时,Zn与稀H2SO4反应产生H2。硝酸的强氧化性 1.具体表现
(1)硝酸与金属的反应:
①除Au、Pt等少数金属外,硝酸几乎可以氧化所有的金属。
如3Ag+4HNO3(稀)===3AgNO3+NO↑+2H2O。
②活泼金属与HNO3反应不生成H2,HNO3的浓度不同,还原产物不同。③常温下浓硝酸能使Fe、Al钝化,加热时反应。 (2)硝酸与非金属的反应:
①反应规律:非金属单质+浓硝酸―→最高价氧化物或高价含氧酸+NO2↑+H2O。
②反应举例:
(3)硝酸与还原性化合物的反应:
硝酸的强氧化性还表现在可以氧化具有还原性的化合物或离子,如HI、HBr、SO2、Fe2+、FeO、Br-、I-、S2-、SO 等均能被HNO3氧化。 2.关于硝酸与金属反应的计算
(1)守恒法:
金属与HNO3的反应运用“守恒法”求解,一般类型有:
①电子守恒:
金属失电子数=生成气体时HNO3得电子数。
②物料守恒:
消耗HNO3的量=盐中NO 的量(表现酸性的HNO3)+气体中的N原子的量(被还原的HNO3)。 [例2] 38.4 g铜跟适量的浓硝酸反应,铜全部作用后,共收集到气体22.4 L(标准状况),反应消耗的硝酸可能是 ( )
A.1.0 mol B.1.6 mol
C.2.2 mol D.2.4 mol[答案] C点击下图进入 (3)稀HNO3的还原产物为NO:
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O,
浓HNO3的还原产物为NO2:
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O,C+4HNO3(浓) CO2↑+4NO2↑+2H2O。
(4)铁、铝在常温下,遇到浓H2SO4或浓HNO3发生钝化,这体现了二者都具有强氧化性。点击下图进入
第四节
第 二课时
课前预习
·巧设计名师课堂
·一点通考点一创新演练
·大冲关设计1设计2考点二设计3课下30分钟演练课堂10分钟练习课堂5分钟归纳第四节 氨 硝酸 硫酸第二课时 硫酸和硝酸的氧化性 (1)H2SO4的电离方程式是 。
在反应Zn+H2SO4(稀)===ZnSO4+H2↑中,失电子的是Zn,得电子的是 ,稀硫酸表现的性质是 。
(2)浓H2SO4具有吸水性,通常用作 。浓H2SO4溶于水会放出大量的热,故稀释浓H2SO4时,应将 缓缓加入到 并不断地 进行搅拌。
(3)从氧化还原反应的价态规律分析,H2SO4中的硫元素、HNO3中的氮元素 。 H+酸性和弱氧化性干燥剂浓H2SO4水中用玻璃棒只有氧化性 一、浓硫酸的性质
1.吸水性
浓硫酸能吸收气体、液体中的水分以及固体中的结晶水,故常作 。
2.脱水性
浓硫酸能将有机物中的 按水的组成比脱去,剩余黑色的炭。干燥剂氢、氧元素3.强氧化性
(1)与金属反应:
①除 以外的绝大多数金属都能与浓硫酸反应。
②常温下,冷的浓硫酸能使 钝化。
③浓H2SO4与Cu反应:Au、Pt铁、铝有气泡逸出无色红色蓝色 (2)与非金属反应:
加热时与木炭发生反应:
。二、硝酸的性质
1.强氧化性
(1)与金属反应:
①除 以外的绝大多数金属都能与硝酸反应。
②常温下,冷的浓硝酸能使 钝化。
③与铜反应(写出化学方程式):
浓硝酸: ,
稀硝酸: 。金铂铁、铝4HNO3(浓)+Cu===Cu(NO3)2+2NO2↑+2H2O8HNO3(稀)+3Cu===3Cu(NO3)2+2NO↑+4H2O(2)与非金属反应:
加热时浓硝酸与木炭发生反应:
。
(3)王水:
①组成: 与 ,体积比为1∶3;
②性质:能使一些不溶于硝酸的金属如 等溶解。浓硝酸浓盐酸金、铂
2.不稳定性
(1)化学方程式: 。
(2)实验室中浓硝酸显黄色的原因:
浓硝酸分解生成的NO2又溶于硝酸所致。1.将下列现象与浓H2SO4表现的性质连接起来。
(1)浓H2SO4使铁、铝钝化 A.吸水性
(2)浓H2SO4滴在纸上,使纸变黑 B.脱水性
(3)浓H2SO4干燥SO2气体 C.强氧化性
答案:(1)—C (2)—B (3)—A2.判断正误(正确的打“√”号,错误的打“×”号)。
(1)稀H2SO4和Fe反应的离子方程式为:2Fe+6H+===
2Fe3++3H2↑ ( )
(2)浓H2SO4可用作SO2、NH3的干燥剂 ( )
(3)冷的浓H2SO4使铁、铝钝化属于物理变化 ( )
(4)铜和稀HNO3反应中HNO3既体现了氧化性,又体现了
酸性 ( )
(5)浓盐酸和浓硝酸按体积比1∶3组成王水 ( )
答案:(1)× (2)× (3)× (4)√ (5)×3.思考:Cu和一定浓度的HNO3充分反应后铜过量,
若向反应后混合物中滴加稀H2SO4,铜能否继续
溶解?4.实验室中应如何保存浓硝酸?
答案:因浓HNO3见光或受热易分解,所以应盛放
在棕色细口瓶中并置于冷暗处。浓硫酸的强氧化性 1.与金属的反应(体现酸性和氧化性)
(1)与较活泼金属反应:
①铁、铝:
常温下,当铁、铝等较活泼的金属遇到浓硫酸时,会与浓硫酸发生反应,表面生成一层致密的氧化物薄膜而出现“钝化”现象。加热时,反应生成硫酸盐和SO2。
②其他活泼金属:除铁、铝外的其他活泼金属与浓硫酸反应时,开始产生SO2,后来产生H2。 [例1] 下列叙述正确的是 ( )
A.浓硫酸是一种干燥剂,能够干燥氢气、氧气、氨气等气体,但不能干燥有较强还原性的HI、H2S等气体
B.浓硫酸与单质硫反应的方程式为:S+2H2SO4(浓)
3SO2↑+2H2O,在此反应中,浓硫酸既表现了其强氧化性又表现了其酸性 C.把足量铜粉投入到只含H2SO4 2 mol的浓硫酸中,得到气体体积标准状况下为22.4 L
D.常温下能够用铁、铝等容器盛放浓H2SO4,是因为浓H2SO4的强氧化性使其钝化 [解析] A项浓硫酸具有吸水性,但由于其具有强氧化性和酸性,故不能用来干燥具有还原性的气体和碱性气体(NH3)。B项浓硫酸与S、C等非金属单质作用时,由于没有盐生成,故只表现其强氧化性。C项Cu与浓H2SO4反应时,浓H2SO4浓度逐渐降低,当成为稀H2SO4时,反应停止,故产生的SO2在标准状况下不足22.4 L。答案为D。
[答案] D (1)浓硫酸与金属反应时,既表现酸性又表现强氧化性,而与非金属反应时,只表现强氧化性。
(2)浓H2SO4与金属反应时,随着反应的进行,浓硫酸浓度变小,一旦变为稀硫酸,不再与不活泼金属反应。但足量的活泼金属如Zn与浓H2SO4反应时,开始阶段浓H2SO4体现其强氧化性,产生SO2气体,随着反应的进行,当浓硫酸变为稀H2SO4时,Zn与稀H2SO4反应产生H2。硝酸的强氧化性 1.具体表现
(1)硝酸与金属的反应:
①除Au、Pt等少数金属外,硝酸几乎可以氧化所有的金属。
如3Ag+4HNO3(稀)===3AgNO3+NO↑+2H2O。
②活泼金属与HNO3反应不生成H2,HNO3的浓度不同,还原产物不同。③常温下浓硝酸能使Fe、Al钝化,加热时反应。 (2)硝酸与非金属的反应:
①反应规律:非金属单质+浓硝酸―→最高价氧化物或高价含氧酸+NO2↑+H2O。
②反应举例:
(3)硝酸与还原性化合物的反应:
硝酸的强氧化性还表现在可以氧化具有还原性的化合物或离子,如HI、HBr、SO2、Fe2+、FeO、Br-、I-、S2-、SO 等均能被HNO3氧化。 2.关于硝酸与金属反应的计算
(1)守恒法:
金属与HNO3的反应运用“守恒法”求解,一般类型有:
①电子守恒:
金属失电子数=生成气体时HNO3得电子数。
②物料守恒:
消耗HNO3的量=盐中NO 的量(表现酸性的HNO3)+气体中的N原子的量(被还原的HNO3)。 [例2] 38.4 g铜跟适量的浓硝酸反应,铜全部作用后,共收集到气体22.4 L(标准状况),反应消耗的硝酸可能是 ( )
A.1.0 mol B.1.6 mol
C.2.2 mol D.2.4 mol[答案] C点击下图进入 (3)稀HNO3的还原产物为NO:
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O,
浓HNO3的还原产物为NO2:
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O,C+4HNO3(浓) CO2↑+4NO2↑+2H2O。
(4)铁、铝在常温下,遇到浓H2SO4或浓HNO3发生钝化,这体现了二者都具有强氧化性。点击下图进入
