2013高一化学人教版必修一课件第四章 第三节 第一课时 硫和硫的氧化物
文档属性
| 名称 | 2013高一化学人教版必修一课件第四章 第三节 第一课时 硫和硫的氧化物 |
|
|
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-10-24 00:00:00 | ||
图片预览










文档简介
课件38张PPT。第四章
第三节
第 一课时
课前预习
·巧设计名师课堂
·一点通考点一创新演练
·大冲关设计1设计2考点二设计3课下30分钟演练课堂10分钟练习课堂5分钟归纳第三节 硫和氮的氧化物第一课时 硫和硫的氧化物 (1)从氧化还原反应的价态规律分析,H2S中的硫元素只有 ,H2SO4中的硫元素只有 ,S、SO2、H2SO3中的硫元素既有 ,又有 。
(2)SO2是 氧化物,与足量NaOH溶液反应的离子方程式为: 。
(3)H2SO3(亚硫酸)是 弱酸,酸性比H2CO3 。
(4)将Cl2通入到紫色石蕊试液中,现象为
还原性氧化性氧化性还原性酸性二元强先变红后褪色SO2+2OH-===SO +H2O2-3。一、硫
1.存在2.物理性质硫黄黄色固体不微易3.化学性质 二、硫的氧化物
1.二氧化硫
(1)物理性质:
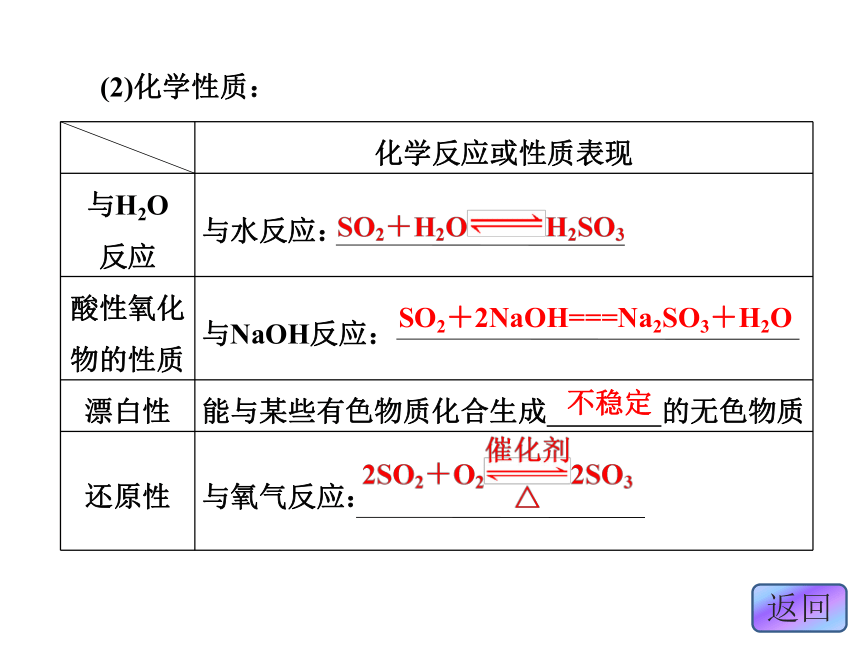
色、味、态: ;密度:比空气 ;溶解性: 于水;毒性: 。无色刺激性气味气体大易溶有毒(2)化学性质:SO2+2NaOH===Na2SO3+H2O不稳定2.三氧化硫
三氧化硫具有酸性氧化物的通性,主要反应如下:1.正误判断(正确的打“√”号,错误的打“×”号)。
(1)硫在自然界中不仅有游离态存在,还有化合态存在
( )
(2)试管壁上附着的硫黄用酒精洗涤即可 ( )
(3)SO2通入石蕊试液中,可使溶液先变红后褪色 ( )
(4)SO2与HClO的漂白原理相同 ( )
答案:(1)√ (2)× (3)× (4)×答案:相同条件下,一个化学反应同时能向正、逆两个方向进行,称为可逆反应。该题两反应不是同时进行,条件不同,故不是可逆反应。
3.请将下列反应或现象与相应的性质连接起来。
(1)SO2使品红溶液褪色 A.还原性
(2)2SO2+O2 2SO3 B.酸性氧化物的性质
(3)SO2使澄清石灰水变浑浊 C.漂白性
答案:(1)—C (2)—A (3)—B4.下列对于SO2和SO3的叙述正确的是 ( )
A.通常条件下,都是无色气体,都易溶于水
B.都是酸性氧化物,其水溶液都是强酸
C.都可使品红溶液褪色,加热时红色又能再现
D.都能跟碱溶液反应
分析:通常条件下,SO3是无色液体,SO2溶于水生成H2SO3,其为弱酸。SO2能使品红溶液褪色,加热时红色复现,SO3则不能,但SO2和SO3都是酸性氧化物,都能跟碱反应,故D项正确。
答案:D常见漂白剂的漂白原理1.漂白剂的分类
(1)Cl2、Ca(ClO)2、H2O2、Na2O2、O3等——氧化型
原理:漂白剂本身是氧化剂,利用其氧化性氧化有色物质,使之失去原有的颜色。加热时不能恢复原有的颜色。
(2)SO2——化合型:
原理:漂白剂与有色物质化合生成新的无色物质,使之失去原来的颜色。加热时能恢复原来的颜色。 (3)活性炭、胶体——吸附型:
原理:有些固体物质疏松、多孔,具有较大的表面积,可以吸附有色物质使之失去原来的颜色。部分吸附剂可以重复使用。2.SO2和Cl2的漂白性比较
(1)通入品红溶液:(2)通入紫色石蕊试液: [例1][双选题]有关二氧化硫的说法错误的是 ( )
A.SO2能使氯水褪色,体现了SO2的漂白性。
B.将SO2通到显红色的酚酞试液中,发现红色消失,主要原因是SO2溶于水中显酸性
C.给已被SO2漂白的品红溶液用酒精灯加热,可恢复原来的红色
D.SO2不能使酸性KMnO4溶液褪色[解析] A项,SO2使氯水褪色,体现了SO2的还原性。A错误;B项,酚酞显红色是因为溶液呈碱性,通入二氧化硫褪色是因为碱性消失,说明二氧化硫溶于水显酸性,B正确;C项,SO2与品红结合生成无色不稳定的化合物,加热又生成品红,C项正确;SO2具有还原性,可还原KMnO4而使其溶液褪色,D项错误。
[答案] AD (1)漂白是指使有机色质褪色,即使能使无机色质褪色,也不称漂白作用。
(2)SO2可使酸性KMnO4溶液、氯水等褪色,不是SO2的漂白性,而是SO2的还原性。
(3)SO2还可以使含有酚酞的NaOH溶液褪色,也不是SO2的漂白性,而是SO2的酸性氧化物的性质。SO2的性质SO2和CO2性质的比较
(1)物理性质:(2)化学性质: [例2] 下列溶液中能够区别SO2和CO2气体的是( )
①澄清石灰水 ②H2S溶液 ③KMnO4酸性溶液 ④氯水 ⑤品红溶液
A.仅①②③ B.仅②③④
C.除①以外 D.全部 [解析] CO2和SO2均能使澄清石灰水变浑浊,①错误;SO2气体与H2S发生反应:2H2S+SO2===3S↓+2H2O,有黄色沉淀生成,而CO2与H2S不反应,②正确;SO2能使KMnO4溶液、氯水、品红溶液因发生化学反应而褪色,而CO2与上述物质均不反应,故③、④、⑤正确。故选C。
[答案] C CO2和SO2性质的异同点
(1)相同点:都具有酸性氧化物的通性,如都能使澄清石灰水变浑浊,因此不能用澄清石灰水区分CO2和SO2。
(2)不同点:SO2有漂白性和还原性,而CO2没有,如可以用品红溶液、氯水、酸性KMnO4溶液区分二者,SO2有刺激性气味,CO2没有。点击下图进入 (1)硫以游离态和化合态两种形式存在于自然界中。硫在O2中燃烧生成SO2。
(2)SO2是酸性氧化物,可与碱、碱性氧化物反应。
SO2+2NaOH===Na2SO3+H2O,SO2+CaO===CaSO3
(3)SO2具有还原性,可被O2、氯水、溴水、酸性KMnO4溶液等氧化剂氧化。 (4)SO2具有漂白性,可与某些有色物质(品红、草帽辫等)化合生成无色不稳定的化合物,受热后又恢复原色。
(5)SO3是一种酸性氧化物,可与碱性氧化物、碱反应。点击下图进入
第三节
第 一课时
课前预习
·巧设计名师课堂
·一点通考点一创新演练
·大冲关设计1设计2考点二设计3课下30分钟演练课堂10分钟练习课堂5分钟归纳第三节 硫和氮的氧化物第一课时 硫和硫的氧化物 (1)从氧化还原反应的价态规律分析,H2S中的硫元素只有 ,H2SO4中的硫元素只有 ,S、SO2、H2SO3中的硫元素既有 ,又有 。
(2)SO2是 氧化物,与足量NaOH溶液反应的离子方程式为: 。
(3)H2SO3(亚硫酸)是 弱酸,酸性比H2CO3 。
(4)将Cl2通入到紫色石蕊试液中,现象为
还原性氧化性氧化性还原性酸性二元强先变红后褪色SO2+2OH-===SO +H2O2-3。一、硫
1.存在2.物理性质硫黄黄色固体不微易3.化学性质 二、硫的氧化物
1.二氧化硫
(1)物理性质:
色、味、态: ;密度:比空气 ;溶解性: 于水;毒性: 。无色刺激性气味气体大易溶有毒(2)化学性质:SO2+2NaOH===Na2SO3+H2O不稳定2.三氧化硫
三氧化硫具有酸性氧化物的通性,主要反应如下:1.正误判断(正确的打“√”号,错误的打“×”号)。
(1)硫在自然界中不仅有游离态存在,还有化合态存在
( )
(2)试管壁上附着的硫黄用酒精洗涤即可 ( )
(3)SO2通入石蕊试液中,可使溶液先变红后褪色 ( )
(4)SO2与HClO的漂白原理相同 ( )
答案:(1)√ (2)× (3)× (4)×答案:相同条件下,一个化学反应同时能向正、逆两个方向进行,称为可逆反应。该题两反应不是同时进行,条件不同,故不是可逆反应。
3.请将下列反应或现象与相应的性质连接起来。
(1)SO2使品红溶液褪色 A.还原性
(2)2SO2+O2 2SO3 B.酸性氧化物的性质
(3)SO2使澄清石灰水变浑浊 C.漂白性
答案:(1)—C (2)—A (3)—B4.下列对于SO2和SO3的叙述正确的是 ( )
A.通常条件下,都是无色气体,都易溶于水
B.都是酸性氧化物,其水溶液都是强酸
C.都可使品红溶液褪色,加热时红色又能再现
D.都能跟碱溶液反应
分析:通常条件下,SO3是无色液体,SO2溶于水生成H2SO3,其为弱酸。SO2能使品红溶液褪色,加热时红色复现,SO3则不能,但SO2和SO3都是酸性氧化物,都能跟碱反应,故D项正确。
答案:D常见漂白剂的漂白原理1.漂白剂的分类
(1)Cl2、Ca(ClO)2、H2O2、Na2O2、O3等——氧化型
原理:漂白剂本身是氧化剂,利用其氧化性氧化有色物质,使之失去原有的颜色。加热时不能恢复原有的颜色。
(2)SO2——化合型:
原理:漂白剂与有色物质化合生成新的无色物质,使之失去原来的颜色。加热时能恢复原来的颜色。 (3)活性炭、胶体——吸附型:
原理:有些固体物质疏松、多孔,具有较大的表面积,可以吸附有色物质使之失去原来的颜色。部分吸附剂可以重复使用。2.SO2和Cl2的漂白性比较
(1)通入品红溶液:(2)通入紫色石蕊试液: [例1][双选题]有关二氧化硫的说法错误的是 ( )
A.SO2能使氯水褪色,体现了SO2的漂白性。
B.将SO2通到显红色的酚酞试液中,发现红色消失,主要原因是SO2溶于水中显酸性
C.给已被SO2漂白的品红溶液用酒精灯加热,可恢复原来的红色
D.SO2不能使酸性KMnO4溶液褪色[解析] A项,SO2使氯水褪色,体现了SO2的还原性。A错误;B项,酚酞显红色是因为溶液呈碱性,通入二氧化硫褪色是因为碱性消失,说明二氧化硫溶于水显酸性,B正确;C项,SO2与品红结合生成无色不稳定的化合物,加热又生成品红,C项正确;SO2具有还原性,可还原KMnO4而使其溶液褪色,D项错误。
[答案] AD (1)漂白是指使有机色质褪色,即使能使无机色质褪色,也不称漂白作用。
(2)SO2可使酸性KMnO4溶液、氯水等褪色,不是SO2的漂白性,而是SO2的还原性。
(3)SO2还可以使含有酚酞的NaOH溶液褪色,也不是SO2的漂白性,而是SO2的酸性氧化物的性质。SO2的性质SO2和CO2性质的比较
(1)物理性质:(2)化学性质: [例2] 下列溶液中能够区别SO2和CO2气体的是( )
①澄清石灰水 ②H2S溶液 ③KMnO4酸性溶液 ④氯水 ⑤品红溶液
A.仅①②③ B.仅②③④
C.除①以外 D.全部 [解析] CO2和SO2均能使澄清石灰水变浑浊,①错误;SO2气体与H2S发生反应:2H2S+SO2===3S↓+2H2O,有黄色沉淀生成,而CO2与H2S不反应,②正确;SO2能使KMnO4溶液、氯水、品红溶液因发生化学反应而褪色,而CO2与上述物质均不反应,故③、④、⑤正确。故选C。
[答案] C CO2和SO2性质的异同点
(1)相同点:都具有酸性氧化物的通性,如都能使澄清石灰水变浑浊,因此不能用澄清石灰水区分CO2和SO2。
(2)不同点:SO2有漂白性和还原性,而CO2没有,如可以用品红溶液、氯水、酸性KMnO4溶液区分二者,SO2有刺激性气味,CO2没有。点击下图进入 (1)硫以游离态和化合态两种形式存在于自然界中。硫在O2中燃烧生成SO2。
(2)SO2是酸性氧化物,可与碱、碱性氧化物反应。
SO2+2NaOH===Na2SO3+H2O,SO2+CaO===CaSO3
(3)SO2具有还原性,可被O2、氯水、溴水、酸性KMnO4溶液等氧化剂氧化。 (4)SO2具有漂白性,可与某些有色物质(品红、草帽辫等)化合生成无色不稳定的化合物,受热后又恢复原色。
(5)SO3是一种酸性氧化物,可与碱性氧化物、碱反应。点击下图进入
