2013高一化学人教版必修一课件第四章 第一节 第二课时 硅酸盐的硅单质
文档属性
| 名称 | 2013高一化学人教版必修一课件第四章 第一节 第二课时 硅酸盐的硅单质 | 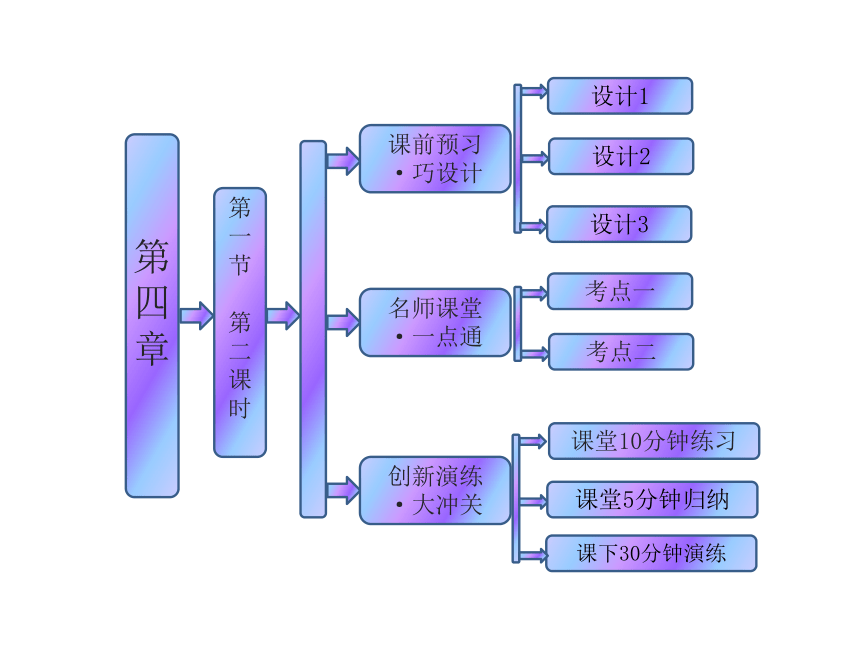 | |
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-10-24 12:20:54 | ||
图片预览









文档简介
课件39张PPT。第四章
第一节
第二课时
课前预习
·巧设计名师课堂
·一点通考点一创新演练
·大冲关设计1设计2考点二设计3课下30分钟演练课堂10分钟练习课堂5分钟归纳第一节 无机非金属材料的主角——硅第二课时 硅酸盐和硅单质 (1)SiO2与CO2性质差异的主要原因是 ,SiO2的基本的结构单元是 。
(2)用化学方程式表示:
①氢氟酸刻玻璃: 。
②SiO2与NaOH溶液反应:
。
③硅酸钠溶液久置空气中变质:
。结构不同四面体4HF+SiO2===SiF4↑+2H2OSiO2+2NaOH===Na2SiO3+H2ONa2SiO3+CO2+H2O===Na2CO3+H2SiO3↓一、硅酸盐的性质及应用
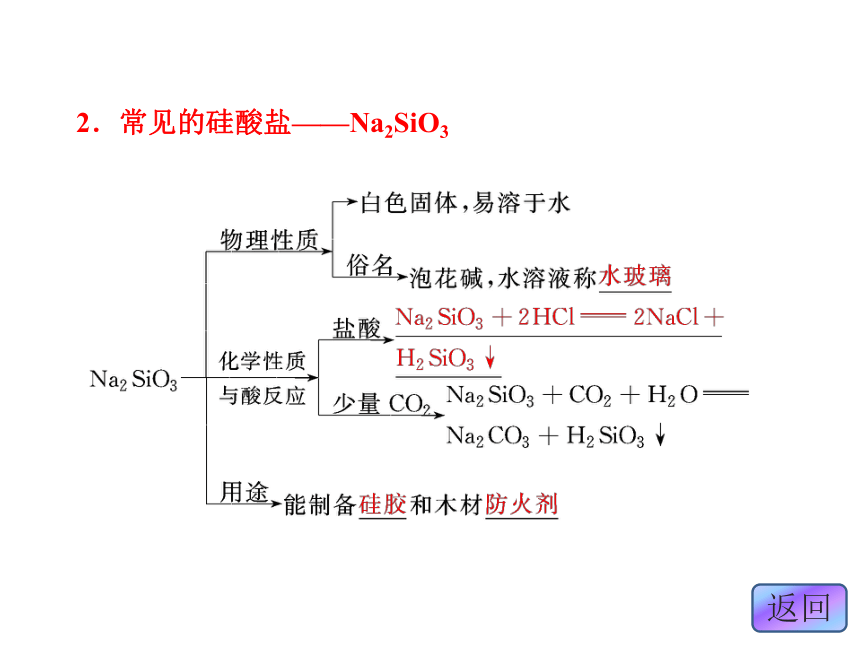
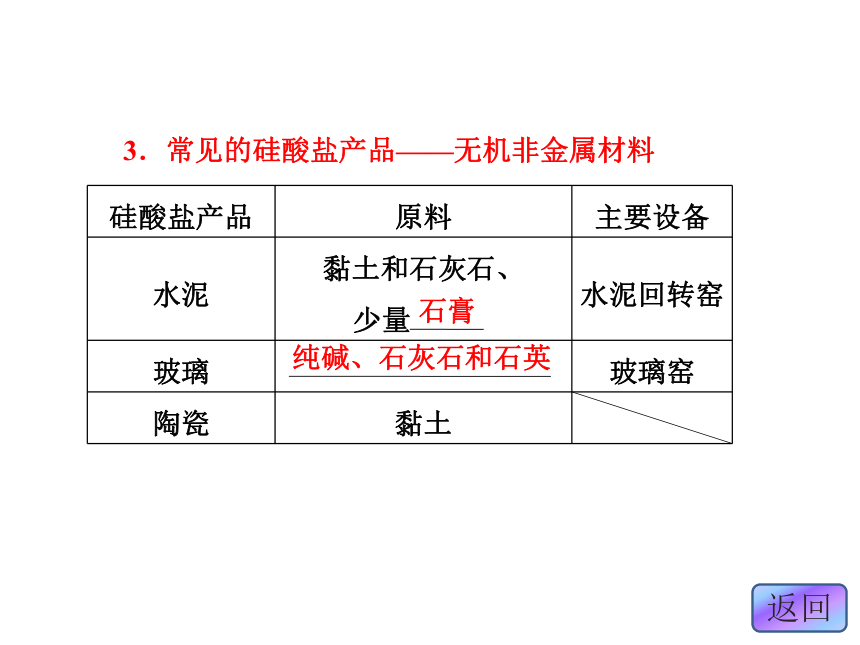
1.硅酸盐的组成及性质2.常见的硅酸盐——Na2SiO33.常见的硅酸盐产品——无机非金属材料石膏纯碱、石灰石和石英
4.特殊功能的含硅物质
(1)金刚砂(SiC)具有类似 的结构,硬度很大,可用作砂纸、砂轮磨料。
(2)硅钢(含Si 4%)具有很高的 ,主要用作变压器铁芯。
(3)硅橡胶,既耐高温又耐低温,用于制造火箭、导弹的零件。
(4)人工制造的分子筛(具有均匀微孔结构的铝硅酸盐),主要用作吸附剂和 。金刚石导磁性催化剂 二、硅单质
1.种类及结构
单质硅分为晶体硅和 两类,晶体硅的结构与 类似。
2.性质
(1)物理性质: 无定形金刚石灰黑色固体
半导体 (2)化学性质:在常温下化学性质不活泼,但能
发生反应。
3.用途
(1) 材料,如硅芯片等。
(2)新型能源,如 等。F2、HF、强碱半导体光电池1.下列物质中,不含有硅酸盐的是 ( )
A.水玻璃 B.硅芯片
C.黏土 D.普通水泥
分析:水玻璃中含有硅酸钠,普通水泥中含有硅酸钙、硅酸钠,黏土含有复杂的硅酸盐,硅芯片中含的是硅单质。
答案:B2.将下列硅酸盐改写成氧化物的形式。
(1)NaAlSi3O8_________________________________
(2)Mg2Si3O8·nH2O_____________________________
(3)普通玻璃(Na2SiO3·CaSiO3·4SiO2)________________________
答案:(1)Na2O·Al2O3·6SiO2
(2)2MgO·3SiO2·nH2O
(3)Na2O·CaO·6SiO23.判断正误(正确的打“√”号,错误的打“×”号)。
(1)硅酸盐一般易溶于水,化学性质很稳定。 ( )
(2)硅酸盐是SiO2和金属氧化物组成的混合物。 ( )
(3)Na2SiO3固体是一种很好的干燥剂。 ( )
(4)水泥、玻璃、陶瓷都属于传统的无机非金属材料。
( )
答案:(1)× (2)× (3)× (4)√4.下列说法错误的是 ( )
A.硅是制造太阳能电池的常用材料
B.二氧化硅是制造光导纤维的材料
C.常温下硅性质活泼,可以与氯气、强酸、强碱溶
液等起反应
D.水玻璃可用作木材防火剂
分析:常温下硅单质性质稳定,与Cl2、强酸、强碱等物质均不反应,C错误。
答案:C硅及其化合物的“特性” [例1]下列有关硅及其化合物的说法正确的是
A.晶体硅具有金属光泽,可以导电,属于金属材料?
B.常温下,硅的化学性质稳定,所以自然界中的硅大部分以游离态存在
C.SiO2是一种酸性氧化物,能够与水反应生成相应的酸
D.除去SiO2中混有的CaCO3可加入适量的稀盐酸 [解析] A项,晶体硅虽然具有金属光泽,但它属于非金属单质;其导电性介于导体和绝缘体之间,是良好的半导体材料。B项,虽然常温下硅的化学性质稳定,但自然界中没有游离态的硅,它主要以二氧化硅和硅酸盐的形式存在;C项,SiO2是一种酸性氧化物,但它不溶于水也不与水反应。D项,SiO2不溶于稀盐酸,可使用稀盐酸除去其中混有的CaCO3,化学方程式为CaCO3+2HCl===CaCl2+CO2↑+H2O。
[答案] D (1)F2与Si、HF与SiO2在常温下反应的原因是产物SiF4特别稳定。
(2)SiO2既能与NaOH溶液反应,也能与氢氟酸反应,但SiO2不属于两性氧化物而属于酸性氧化物。单质硅的性质与制备 [例2] 如图中的每一方格表示相关的一种反应物或生成物。其中B是一种单质,其余物质也都是有B元素的化合物。C是一种钠盐,E是C对应的酸,B的结构类似金刚石,D为B的氧化物(其他不含B元素的反应产物以及各步反应添加的必要试剂和反应条件已被略去),请填写空白:(1)A、D、E的化学式分别为_______、_______、_______。
(2)A和B的互相转化在工业上有什么实际意义?
_________________________________________________。
(3)写出D→C反应的化学方程式:
________________________________________________。
(4)写出E→D反应的化学方程式:_______________________________________________。 [解析] 本题的突破口是:“B是一种单质”“B的结构类似金刚石”。据此,容易推断出B是晶体硅。硅与氯气在加热条件下生成SiCl4,因此,A为SiCl4。经过分馏提纯后得到纯净的SiCl4,SiCl4可以被氢气还原得纯净的硅。根据D能转化成B(Si),可知D为SiO2,由此可知其他答案。点击下图进入 (1)硅酸盐是构成地壳岩石的主要成分。
(2)硅酸钠水溶液俗称水玻璃,常用于制备黏合剂、防腐剂和耐火材料。
(3)常见的无机非金属材料有水泥、玻璃和陶瓷。
(4)硅以化合态存在于自然界中,常用作半导体材料和合金材料。点击下图进入
第一节
第二课时
课前预习
·巧设计名师课堂
·一点通考点一创新演练
·大冲关设计1设计2考点二设计3课下30分钟演练课堂10分钟练习课堂5分钟归纳第一节 无机非金属材料的主角——硅第二课时 硅酸盐和硅单质 (1)SiO2与CO2性质差异的主要原因是 ,SiO2的基本的结构单元是 。
(2)用化学方程式表示:
①氢氟酸刻玻璃: 。
②SiO2与NaOH溶液反应:
。
③硅酸钠溶液久置空气中变质:
。结构不同四面体4HF+SiO2===SiF4↑+2H2OSiO2+2NaOH===Na2SiO3+H2ONa2SiO3+CO2+H2O===Na2CO3+H2SiO3↓一、硅酸盐的性质及应用
1.硅酸盐的组成及性质2.常见的硅酸盐——Na2SiO33.常见的硅酸盐产品——无机非金属材料石膏纯碱、石灰石和石英
4.特殊功能的含硅物质
(1)金刚砂(SiC)具有类似 的结构,硬度很大,可用作砂纸、砂轮磨料。
(2)硅钢(含Si 4%)具有很高的 ,主要用作变压器铁芯。
(3)硅橡胶,既耐高温又耐低温,用于制造火箭、导弹的零件。
(4)人工制造的分子筛(具有均匀微孔结构的铝硅酸盐),主要用作吸附剂和 。金刚石导磁性催化剂 二、硅单质
1.种类及结构
单质硅分为晶体硅和 两类,晶体硅的结构与 类似。
2.性质
(1)物理性质: 无定形金刚石灰黑色固体
半导体 (2)化学性质:在常温下化学性质不活泼,但能
发生反应。
3.用途
(1) 材料,如硅芯片等。
(2)新型能源,如 等。F2、HF、强碱半导体光电池1.下列物质中,不含有硅酸盐的是 ( )
A.水玻璃 B.硅芯片
C.黏土 D.普通水泥
分析:水玻璃中含有硅酸钠,普通水泥中含有硅酸钙、硅酸钠,黏土含有复杂的硅酸盐,硅芯片中含的是硅单质。
答案:B2.将下列硅酸盐改写成氧化物的形式。
(1)NaAlSi3O8_________________________________
(2)Mg2Si3O8·nH2O_____________________________
(3)普通玻璃(Na2SiO3·CaSiO3·4SiO2)________________________
答案:(1)Na2O·Al2O3·6SiO2
(2)2MgO·3SiO2·nH2O
(3)Na2O·CaO·6SiO23.判断正误(正确的打“√”号,错误的打“×”号)。
(1)硅酸盐一般易溶于水,化学性质很稳定。 ( )
(2)硅酸盐是SiO2和金属氧化物组成的混合物。 ( )
(3)Na2SiO3固体是一种很好的干燥剂。 ( )
(4)水泥、玻璃、陶瓷都属于传统的无机非金属材料。
( )
答案:(1)× (2)× (3)× (4)√4.下列说法错误的是 ( )
A.硅是制造太阳能电池的常用材料
B.二氧化硅是制造光导纤维的材料
C.常温下硅性质活泼,可以与氯气、强酸、强碱溶
液等起反应
D.水玻璃可用作木材防火剂
分析:常温下硅单质性质稳定,与Cl2、强酸、强碱等物质均不反应,C错误。
答案:C硅及其化合物的“特性” [例1]下列有关硅及其化合物的说法正确的是
A.晶体硅具有金属光泽,可以导电,属于金属材料?
B.常温下,硅的化学性质稳定,所以自然界中的硅大部分以游离态存在
C.SiO2是一种酸性氧化物,能够与水反应生成相应的酸
D.除去SiO2中混有的CaCO3可加入适量的稀盐酸 [解析] A项,晶体硅虽然具有金属光泽,但它属于非金属单质;其导电性介于导体和绝缘体之间,是良好的半导体材料。B项,虽然常温下硅的化学性质稳定,但自然界中没有游离态的硅,它主要以二氧化硅和硅酸盐的形式存在;C项,SiO2是一种酸性氧化物,但它不溶于水也不与水反应。D项,SiO2不溶于稀盐酸,可使用稀盐酸除去其中混有的CaCO3,化学方程式为CaCO3+2HCl===CaCl2+CO2↑+H2O。
[答案] D (1)F2与Si、HF与SiO2在常温下反应的原因是产物SiF4特别稳定。
(2)SiO2既能与NaOH溶液反应,也能与氢氟酸反应,但SiO2不属于两性氧化物而属于酸性氧化物。单质硅的性质与制备 [例2] 如图中的每一方格表示相关的一种反应物或生成物。其中B是一种单质,其余物质也都是有B元素的化合物。C是一种钠盐,E是C对应的酸,B的结构类似金刚石,D为B的氧化物(其他不含B元素的反应产物以及各步反应添加的必要试剂和反应条件已被略去),请填写空白:(1)A、D、E的化学式分别为_______、_______、_______。
(2)A和B的互相转化在工业上有什么实际意义?
_________________________________________________。
(3)写出D→C反应的化学方程式:
________________________________________________。
(4)写出E→D反应的化学方程式:_______________________________________________。 [解析] 本题的突破口是:“B是一种单质”“B的结构类似金刚石”。据此,容易推断出B是晶体硅。硅与氯气在加热条件下生成SiCl4,因此,A为SiCl4。经过分馏提纯后得到纯净的SiCl4,SiCl4可以被氢气还原得纯净的硅。根据D能转化成B(Si),可知D为SiO2,由此可知其他答案。点击下图进入 (1)硅酸盐是构成地壳岩石的主要成分。
(2)硅酸钠水溶液俗称水玻璃,常用于制备黏合剂、防腐剂和耐火材料。
(3)常见的无机非金属材料有水泥、玻璃和陶瓷。
(4)硅以化合态存在于自然界中,常用作半导体材料和合金材料。点击下图进入
